晋汾白猪和新山西黑猪TAP1基因多态性和组织表达谱研究
孙奴奴,李步高,曹果清,赵 银,徐 涛
(1.运城学院生命科学系,山西 运城 044000;2. 山西农业大学动物科技学院,山西 晋中 030801)
抗原处理相关转运体(TAP)是由TAP1和TAP2两种分子组成的异二聚体结构,属于ABC转运体超家族的B族,通常分布于内质网和高尔基体膜上[1],它的主要作用是把肽类在细胞内经过蛋白酶体一系列降解反应之后,产生的片段输入到内质网中,然后和MHC I类物质聚合,最终引起T细胞的特异性反应[2]。编码TAP的基因位于MHCⅡ类区域,有遗传多态性[3]。鉴于其在抗原递呈中所起的重要作用,使它成为某些免疫性疾病易感基因的主要候选者,TAP的异常将严重影响抗原递呈,成为病毒感染及肿瘤细胞逃避免疫监视的重要机制,如卵巢癌、肝癌及宫颈癌[4]。TAP的表达可以被某些细胞因子(如IFN-γ,IFN-α,TNF-α)和脂多糖等诱导[5],TAP表达上调与MHCⅠ类分子递呈和CTL杀伤功能的增强密切相关,因此人们也越来越关注TAP基因表达的调控。
近年来,TAP1基因在长白、大白、杜洛克和皮特兰等国外猪种[6-7]以及梅山猪、霍寿黑猪、皖南黑猪、安庆六白猪、浦东白猪和苏太猪等国内地方猪种[8-11]的研究已经取得了一定进展,研究表明TAP1基因多态性在国内外猪种的基因型分布有一定差异,TAP1基因不同基因型对断奶仔猪F18大肠杆菌的抗性不同,TAP1基因在免疫组织和肠道组织的表达量较高,特别是在受到蓝耳病毒、模拟病毒及大肠杆菌感染后[12-13],TAP1基因的表达量显著升高,因此将TAP1基因作为猪抗病育种的有效遗传标记之一。晋汾白猪是以马身猪、太湖猪、长白猪及大白猪为亲本经历6个世代20年于2012年培育成的瘦肉型猪新品种[14]。新山西黑猪是以马身猪、内江猪、巴克夏猪和国外猪种为亲本经历10年培育的抗病力好、适应性强、肉质鲜美及养殖效益高的培育品种[15]。本研究通过PCR-RFP的方法研究了TAP1基因BSP143I多态位点在晋汾白猪和新山西黑猪的基因型分布,并利用RT-PCR方法检测了TAP1基因在晋汾白猪和新山西黑猪在免疫系统、消化系统、呼吸系统、神经系统、泌尿生殖系统等18个组织的表达谱,为下一步研究TAP1基因作为抗病育种遗传标记在晋汾白猪和新山西黑猪的有效利用提供基本素材。
1 材料与方法
1.1 实验动物与材料
采集来自山西省运城市新龙丰畜牧有限公司健康的晋汾白猪159头和新山西黑猪57头的耳组织置于75 %乙醇溶液中,-20 ℃保存备用;分别采集断奶仔猪晋汾白猪和新山西黑猪的18种组织(心、肝、脾、肺、巨噬细胞、白细胞、肾、淋巴结、子宫、胃、卵巢、皮肤、肌肉、脂肪、大脑、小脑、支气管、盲肠),液氮速冻并迅速转移至-80 ℃冰箱。
2×Taq PCR Master Mix,DNA Marker,RNA提取试剂盒,反转录试剂盒购自北京华越洋生物科技有限公司。
1.2 DNA、RNA提取及cDNA合成
采用酚/氯仿/异戊醇法抽提耳组织DNA,于-20 ℃保存备用;利用Trizol法提取猪各组织总RNA,用1.5 %琼脂糖凝胶电泳检测RNA的完整性,并用ND2000检测RNA的纯度及浓度,于-80 ℃保存备用。cDNA合成:20 μL的反应体系中含dNTP Mix (2.5mM each)4 μL,Primer Mix 2 μL,5-RT Buffer 4 μL,DTT(0.1M),HiFiScript(200 U/μL) 1 μL,Total RNA 300 ng,RNase free ddH2O补足至20 μL。反应条件为42 ℃ 30 min,85 ℃ 5 min。合成的cDNA保存于-20 ℃备用。
1.3 引物的设计与合成
利用primer 5.0软件,参考GeneBank序列BX323833设计引物,本实验引物是由英潍捷基(上海)贸易有限公司合成,序列如表1所示。
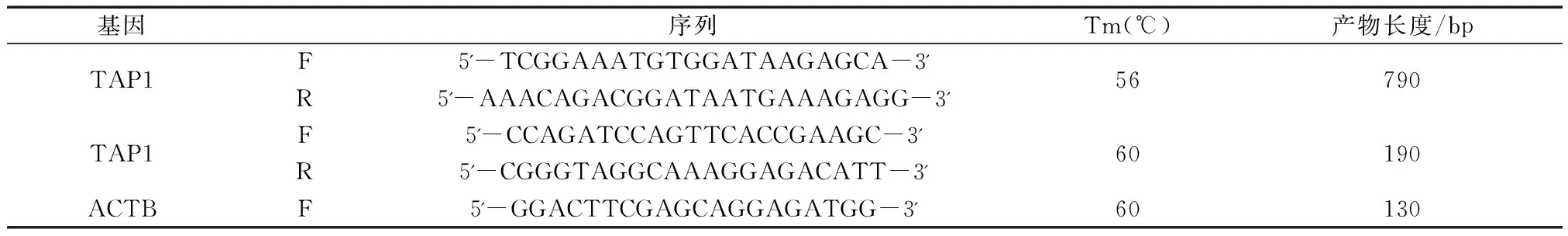
表1 引物序列及相关信息
1.4 PCR-RFLP分析
PCR扩增反应体系:采用10μL反应体系,即模板DNA 0.5 μL,上下游引物各0.2 μL (10 μmol/L),2×Taq PCR Master Mix 5 μL,补ddH2O至总反应体系为10 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃终延伸5 min;PCR产物经1.5 %琼脂糖凝胶电泳检测,有目的条带的PCR产物经BSP143I内切酶37℃消化4 h,酶切产物经2 %琼脂糖凝胶电泳检测,拍照分型。
1.5 RT-PCR
以不同组织cDNA为模板,分别PCR扩增TAP1基因和ACTB基因。采用10 μL反应体系,即cDNA 0.5 μL,上下游引物各0.2 μL(10 μmol/L),2×Taq PCR Master Mix 5 μL,补ddH2O至总反应体系为10 μL。PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,退火温度60 ℃,退火时间30 s,72 ℃延伸30 s,共35个循环;72 ℃终延伸5 min;PCR产物经2 %琼脂糖凝胶电泳检测并拍照保存。
1.6 统计分析
基因分型结果利用popgene 32软件进行群体遗传学分析,利用SAS8.1软件进行卡方检验。
2 结果与分析
2.1 PCR引物的扩增效果检测
以猪基因组DNA为模版,进行PCR反应,经1.5%的琼脂糖凝胶电泳检测,得到790bp左右的单一条带,无杂带污染,结果见图1。
2.2 PCR-RFLP分析结果
PCR产物经过酶Bsp143I消化后,经过琼脂糖凝胶电泳检测,晋汾白猪产生3种条带,分别为AA(790bp)、AG(651 bp/139 bp,790 bp)和GG( 651 bp/139 bp)型,结果见图2;新山西黑猪产生2种带型,分别为AG(651 bp/139 bp,790 bp)和GG( 651 bp/139 bp)型,结果见图3。
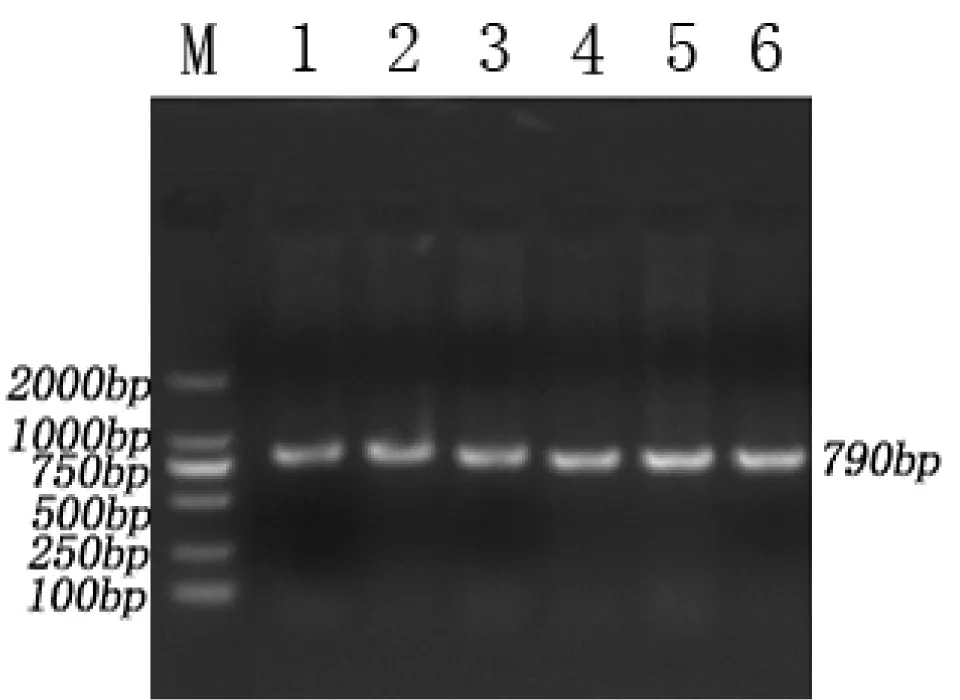
图1 晋汾白猪和新山西黑猪PCR产物电泳结果
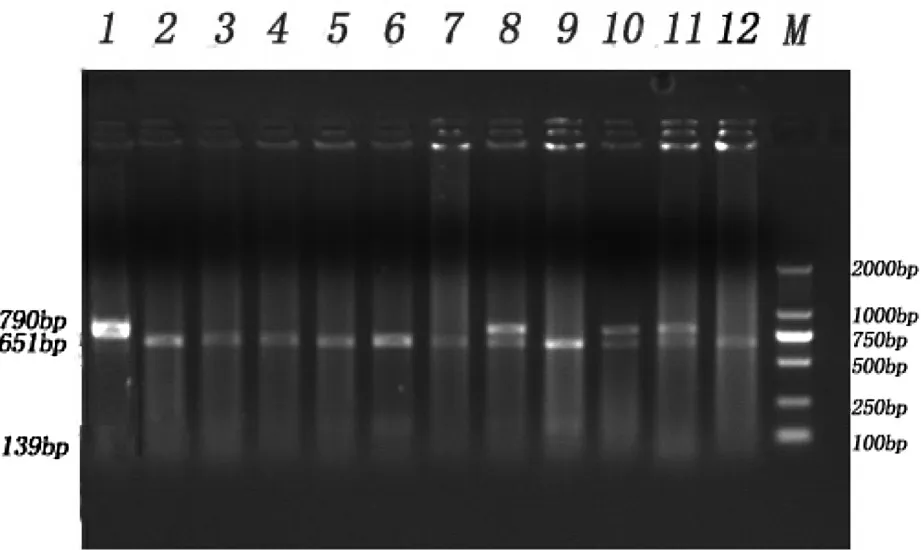
图2 晋汾白猪PCR-RFLP电泳结果

图3 新山西黑猪PCR-RFLP电泳结果
2.3 不同猪种中TAP1基因第3外显子基因型及其等位基因频率分析
基因型分型结果利用PopGen32软件进行分析,分析结果如表2显示,晋汾白猪中共检测出A、G 两种等位基因和AA、AG、GG 3种基因型,新山西黑猪检测出A、G 两种等位基因和AG、GG两种基因型。卡方适合性检验结果表明,晋汾白猪和新山西黑猪在TAP1基因Bsp143I酶切位点基因型符合Hardy-Weinberg平衡状态(P>0.05)。

2.4 不同猪种TAP1基因外显子3的遗传特性分析
对晋汾白猪和新山西黑猪中所检测到的TAP1基因的多态位点进行群体遗传学统计分析,如表3所示,晋汾白猪杂合度和香农指数较高,分别为0.3459,0.4797;新山西黑猪杂合度和香农指数较低,分别为0.1228,0.2308,因此晋汾白猪和新山西黑猪表现具有一定的多态性。晋汾白猪 GG基因型数最多,其基因型频率也最大,AA基因型数最少,晋汾白猪是G等位基因占优势;新山西黑猪GG基因型数也最多,其基因型频率同样也最大,AA基因型数没有检测到,可能群体数还不够大,新山西黑猪是G等位基因占优势。

表3 晋汾白猪和山西黑猪PCR-RFLP的杂合度、纯合度和香农指数
2.5 不同猪种基因型分布差异性分析
对晋汾白猪和新山西黑猪中所检测到的TAP1基因的多态位点运用SAS8.1统计软件进行基因型分布的比较分析,检测结果表明,晋汾白猪和新山西黑猪TAP1基因的多态位点的基因型分布差异极显著(χ2=182.8165,P<0.01)。

表4 TAP1基因在晋汾白猪和新山西黑猪中的基因型分布差异性检测
2.6 TAP1在猪不同组织表达的RT-PCR电泳检测结果
以总RNA反转录的cDNA为模板,分别以TAP1和内参基因ACTB为引物进行PCR扩增,PCR产物经2%的琼脂糖凝胶电泳检测,结果见图4、图5。
TAP1基因在晋汾白猪的18个组织均有表达,其中在心、肝、脾、肾、胃、卵巢、皮肤、肌肉、脂肪、大脑、小脑、支气管、盲肠表达量较高,在肺、肺泡巨噬细胞、白细胞、淋巴结、子宫表达量较低;在新山西黑猪的18个组织均有表达,而且表达量均较高。
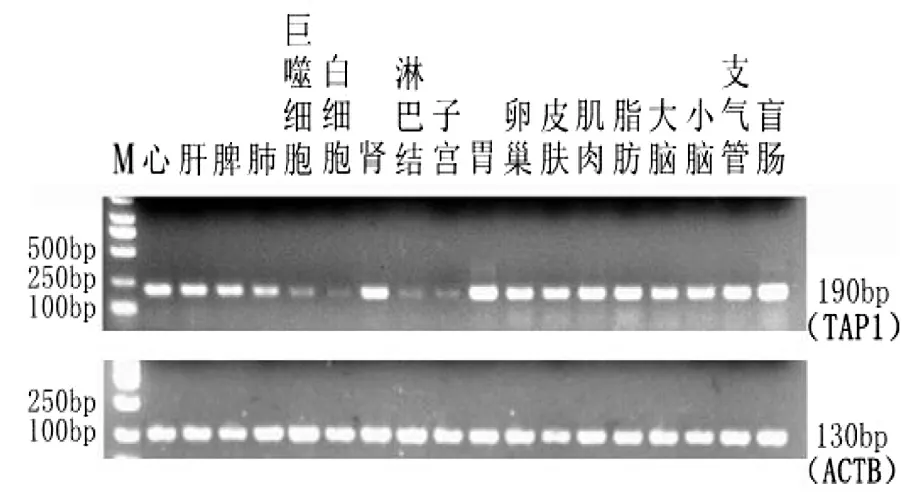
图4 TAP1,ACTB在晋汾白猪不同组织
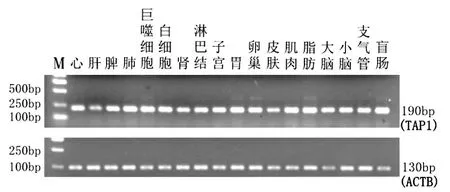
图5 TAP1,ACTB在新山西黑猪不同组织表达的RT-PCR电泳结果
3 讨论
不同动物个体疾病抗性的差异是可以遗传的,抗性基因的单核苷酸突变在一定程度上与动物对疾病的抗性/易感相关,TAP1基因位于SLAⅡ类基因组区域内,编码的蛋白负责抗原的加工递呈。本实验通过PCR-RFLP方法,在159头晋汾白猪中检测到3种基因型(AA、AG、GG),在57头新山西黑猪中检测到2种基因型(AG、GG),发现GG基因型是晋汾白猪和新山西黑猪的优势基因型,G为优势等位基因,并且均符合Hardy-Weinberg平衡,说明TAP1基因在晋汾白猪和新山西黑猪中基本是处于一个自由交配(Hardy-Weinberg平衡)的状态,也就是群体的选育对TAP1基因没有造成影响,对现在的选育性状没有作用。这与先前在长白、大白、杜洛克、皮特兰和圣特西的研究结果一致[6-7,12],而在霍寿黑猪、皖南黑猪、安庆六白猪、苏太猪、浦东白猪和梅山猪等地方猪种的研究发现TAP1基因偏离了Hardy-Weinberg平衡[7-10]。杂合度是衡量群体遗传变异大小的参数,杂合度越低,群体的遗传一致性越高;香农指数是衡量群体间分化水平的量度,是随机交配群体在杂交选育过程中受到遗传漂变、自然选择和变异的综合影响的度量[7]。本研究发现晋汾白猪的杂合度和香农指数高于新山西黑猪的香农指数,并且都高于长白猪的杂合度和香农指数[12],说明中国地方猪种的遗传多态性比外来引进猪种的丰富[7]。运用SAS8.1统计软件分析进行卡方检验,结果表明晋汾白猪和山西黑猪TAP1基因的多态位点的基因型分布差异性极显著(P<0.01),一方面可能由于新山西黑猪没有检测到AA基因型造成的,另一方面新山西黑猪个体数较少,而且个体之间存在全同胞或半同胞的血缘关系。
TAP蛋白作为抗原肽的运输载体,在抗原递呈及免疫应答过程中起着关键的作用,因此TAP1基因的表达量会影响其抗原递呈的功能,当TAP1基因表达量升高时会增强机体抵御细菌或病毒的能力,或者机体在受到病毒或细菌的攻击时,机体血液或组织中的TAP1基因的mRNA水平会显著升高[12-13]。本研究分析了TAP1基因在晋汾白猪和新山西黑猪(断奶仔猪)各18个组织中的表达情况,结果显示TAP1基因在晋汾白猪的肝、脾(免疫组织),胃、盲肠(消化组织),肾、卵巢(泌尿生殖组织),心、支气管(循环呼吸组织),大脑、小脑(神经组织)以及皮肤、肌肉、脂肪的表达量均比较高;TAP1基因在新山西黑猪的免疫、消化、泌尿生殖、循环呼吸及神经组织等18个组织均有较高的表达。而先前我们发现成年梅山猪TAP1基因选择性地在淋巴结、骨髓、肺、脂肪、皮肤、胃、肾、附睾、膀胱、子宫、卵巢表达[12],另有研究发现TAP1基因的表达在35日龄的断奶猪比8、18日龄的未断奶的肺、脾、淋巴结、十二指肠和空肠表达量高[16],一方面说明断奶仔猪一般抗病力和机体免疫能力较弱,几乎所有的组织都需要TAP1基因的高表达来抵御疾病的侵袭,成年猪对疾病的抵抗力加强,TAP1基因在呼吸、消化、泌尿生殖等组织选择性地高表达;另一方面提示TAP1基因的高表达与抵御肺部、肠道、肾及子宫等部位的疾病有关。TAP1基因BSP143I多态位点的不同基因型也会影响组织的表达,zhao[11]等研究表明,GG基因型的个体在肝、肺、肾、胸腺、淋巴结、十二指肠和空肠的表达量比AG、AA基因型的个体高,wang[16]等研究发现TAP1基因在FUT1抗性型猪各免疫组织及肠道组织的表达均显著高于敏感型猪。
4 结论
本实验通过对晋汾白猪和新山西黑猪TAP1基因在DNA水平及mRNA水平的研究,初步了解了TAP1基因BSP143I多态位点在山西两个地方猪种的基因型分布及杂合度、香农指数等群体遗传学分析,以及断奶仔猪18个组织的表达谱分析,为下一步TAP1基因作为抗病遗传标记用于山西地方猪种的抗病育种研究提供了基本的理论素材和指导依据。

