副猪嗜血杆菌的分离鉴定及三价灭活疫苗免疫效力分析
高日明 , 范秀丽 , 李玉安 , 李甜甜 , 范 娟 , 关平原 , 杨汉春
(1.中国农业大学动物医学院 , 北京海淀100193 ; 2.金宇保灵生物药品有限公司 , 内蒙古呼和浩特010030 ; 3.扬州优邦生物药品有限公司 , 江苏扬州225008 ;4.内蒙古农业大学兽医学院 , 内蒙古呼和浩特010018)
副猪嗜血杆菌(Haemophilusparasuis,H.parasuis)主要引发猪的多发性浆膜炎、脑膜炎和关节炎。H.parasuis是最常见的继发性感染菌之一,临床上常继发于PRRS和PMWS[1],主要引起4~12周龄仔猪发病,且抗生素对其治疗效果不显著,给我国养猪业带来了巨大的经济损失。截至目前,H.parasuis已有15个血清型被确定,但仍有部分菌株尚未确定血清分型。许多临床分离株已经鉴定,且血清型4、5、12、13型和14型被认为是我国当前流行的主要H.parasuis[2-3]。
临床上抗生素的广泛使用造成了耐药性的H.parasuis不断产生,给该疾病的控制带来了巨大的挑战。疫苗免疫仍被认为是当前防控格拉泽病重要手段且能预防耐药性的产生[4]。有报道表明,含有重组转铁结合蛋白B(TbpB)、富含TbpB的外膜蛋白及OMP2或D15及来自OMP的PalA和HPS-06257的亚单位疫苗对HPS攻毒只能提供部分保护[4-6]。当前,H.parasuis血清1型、4型、5型及血清6型的部分菌株分别作为商业灭活疫苗已在中国、美国和西班牙广泛使用,在该病的预防上发挥着重要的作用[7]。
本研究于2009年至2016年期间分别采集华东地区45个发病猪场发病猪或濒死猪病料进行细菌分离。首先对分离株的16S rRNA基因进行PCR初步鉴定,随后对鉴定的阳性分离株进行血清型鉴定,根据优势流行不同血清型各菌株制备了副猪嗜血杆菌病三价灭活疫苗,并对该疫苗的免疫效力进行了评估,攻毒试验结果表明,该疫苗可有效抵抗对应血清型强毒株的攻击,为多价副猪嗜血杆菌的疫苗研制奠定了基础。
1 材料与方法
1.1 病料来源 扬州优邦生物药品有限公司2009年至2016年分别从华东地区45个猪场发病猪只139头发病猪采集453份病料(包括心脏、肝脏、脾脏、肺脏、心包积液、胸腔积液、关节积液)。
1.2 试剂背景 TSB培养基,购自美国BD (Becton, Dickinson and Company)公司;Rehydragel系列铝胶佐剂,购自美国通用化学(General Chemical)公司;新生牛血清,购自杭州四季青生物有限公司;烟酰胺腺嘌呤二核苷酸(NAD),购自生工生物工程(上海)股份有限公司;无菌脱纤绵羊血,购自南京便诊生物科技有限公司;生化微量鉴定管,购自杭州天和微生物试剂有限公司。H.parasuis4型、5型和12型标准阳性血清由东北农业大学馈赠,标准阴性血清为HSP抗原、抗体检测均为阴性健康仔猪血清。副猪嗜血杆菌凝集抗原制备方法参照王建学位论文[8]。
1.3 方法
1.3.1 副猪嗜血杆菌分离、培养与纯化 从采集的猪病料(心脏、肝脏、脾脏、肺脏、心包积液、胸腔积液、关节积液)中无菌取样并接种TSA,置于37 ℃、5% CO2中培养24~48 h,观察结果。挑取圆形、光滑、湿润和无色透明的可疑菌落,再次接种TSA、巧克力琼脂平板、兔鲜血琼脂平板及普通营养琼脂平板,反复进行2~3次纯化,直到无杂菌为止。
1.3.2 分离株染色和镜检 挑取TSA琼脂培养基上生长细小、透明、露珠状疑似菌落涂片,革兰染色镜检,显微镜下观察细菌的形态特征。
1.3.3 生化鉴定 挑取已纯化单菌落分别接种相应的生化鉴定管(含2 μg/mL NAD),于37 ℃、5% CO2中培养48 h后,观察结果。
1.3.4 血清分型 将经鉴定为H.parasuis的菌株送至扬州大学农业部禽用生物制剂创制重点实验室利用玻板凝集法进行血清学分型[9]。
1.3.5 分离菌株Omp P5 基因扩增与鉴定
1.3.5.1 引物设计 参照Oliveira 等[10]的报道合成引物。16S rRNA基因引物序列为上游引物P1为5′-GTGATGAGGAAGGGTGGTGT-3′,下游引物P2为5′-GGCTTCGTCACCCTCTGT-3′,预期扩增片段大小为821 bp,引物由南京金斯瑞生物科技有限公司合成。
1.3.5.2 PCR鉴定 取分离株培养菌液离心收集菌体加PBS重悬后沸水浴10 min,12 000 r/min离心,取上清获得分离株基因组。PCR 反应体系(25 μL):MixTaq12.5 μL,上游引物P1(10 pmol/μL) 0.5 μL,下游引物P2(10 pmol/μL) 0.5 μL,基因组模板2 μL。进行PCR反应,反应结束进行1%琼脂糖凝胶电泳并观察结果。
1.3.5.3 副猪嗜血杆菌分离株对BALB/c小鼠的致病性试验 将240只BALB/c小鼠随机分成24组,每组10只,设置23组为H.parasuis攻毒组,1组为PBS对照组。4~1至4~6共6组均攻击4型菌株(2.5×109CFU/只),5~1至5~9共9组均攻击5型菌株(2.5×109CFU/只),12~1至12~8共8组均攻击12型菌株(2.5×109CFU/只),对照组腹腔注射等量PBS,攻毒后14 d观察小鼠死亡情况。
1.3.6 副猪嗜血杆菌三价灭活疫苗的制备 取分离株中筛选出的4型SH株、5型GD株和12型JS株划线接种于TSA平板,37 ℃培养24~48 h,挑取单个菌落接种于TSB液体培养基培养12 h进行细菌计数,使3种血清型的细菌浓度达2.5×1010CFU/mL,等体积混合,加入终浓度为0.2%甲醛,于37 ℃、100 r/min灭活24 h,与铝胶佐剂1∶5混合,制成铝胶灭活疫苗。
1.3.7 疫苗免疫效力评估
1.3.7.1 副猪嗜血杆菌病三价灭活疫苗免疫猪血清抗体检测 将20头14日龄的健康仔猪设置为免疫组(免疫/攻毒组),并设置15头阴性对照组。免疫组颈部肌肉注射2.0 mL副猪嗜血杆菌3价灭活疫苗,首免21 d后以相同剂量加强免疫1次,对照组以相同免疫程序注射2.0 mL PBS。首免后分别在1、2、3、4周和5周时采血并分离血清,利用微量凝集法测定针对3种不同血清型副猪嗜血杆菌抗体效价观察凝集现象并判定结果。
1.3.7.2 疫苗免疫仔猪的攻毒试验 二免2周后对所有免疫组和未免疫组进行腹腔注射攻毒,免疫组按照5头/组随机分为四组,其中三组分别腹腔注射4型SH株(2×1010CFU/头)、5型GD株(5×109CFU/头)和12型JS株(5×109CFU/头),剩下一组为免疫/不攻毒组,腹腔注射等体积的PBS,未免疫/攻毒对照组随机分为三组(每组5头),攻毒后,每日测量体温,并观察感染猪的临床表现及死亡情况,连续观察14 d,对死亡猪进行剖检并观察病理变化。
2 结果
2.1 分离菌株的形态与培养特性 34株分离株在TSA平板上均呈光滑圆润、无色或灰白色的小型菌落,革兰染色后镜检显示为革兰阴性小球杆菌。
34株分离株在含NAD和血清的TSA平板上能正常生长,在含NAD和绵羊鲜血TSA琼脂平板上生长状态最好,而在S、S、麦康凯和不含NAD的TSA琼脂平板上皆不生长。
2.2 分离菌株对BALB/c小鼠的致病性 如表1所示,相同攻毒剂量的不同血清型菌株可导致小鼠不同的致死率,且同一血清型的不同分离株致死率也不尽相同。具体如下,血清4型菌株致病力不同,SH1012株毒力最强,死亡率为5/10;血清5型菌株致病力皆比较强,致死率皆在5/10以上,其中GD1022株毒力最强,死亡率可达9/10;血清12型菌株致病力均较强,小鼠死亡率大于4/10,其中JS1015株毒力最强,可导致7/10小鼠死亡。

表1 不同血清型副猪嗜血杆菌分离株对BALB/c小鼠的致病性
2.3 生化鉴定 对27株已确定血清型的H.parasuis分离株进行生化鉴定,将细菌纯培养物接种于生化微量鉴定管中,37 ℃培养,生化鉴定结果表明,分离株均能发酵葡萄糖、乳糖、半乳糖、蔗糖、果糖和木糖,对尿酶、硫化氢、硝酸盐和吲哚试验反应均呈阴性,均具有NAD依赖性,结果与H.parasuis的生化特性相符。
2.4 血清分型 将34株分离株进行血清分型,其中6株血清4型(17.65%)、9株血清5型(29.41%)、8株血清12型(29.41%)、4株血清13型(11.76%)以及7株未定型菌株(表2),结果表明,我国目前流行的HPS以4型、5型及12型血清型为主。

表2 34株分离株信息
2.5 PCR鉴定 以分离株的DNA作为模板,以16S rRNA为特异性引物进行PCR扩增,凝胶电泳结果显示,从所分离的34株副猪嗜血杆菌均能扩增得到约821 bp大小的特异性条带,与预期一致。
2.6 疫苗免疫仔猪血清抗体检测 取14日龄的健康仔猪15头为免疫组,并设置15头阴性对照组。免疫组颈部肌肉注射2.0 mL上述副猪嗜血杆菌三价灭活疫苗,首免21 d后进行加强免疫,免疫剂量和免疫方式与首免相同,对照组以相同的免疫方式注射2.0 mL PBS。分别在首次免疫后1、2、3、4、5周时对其采血并分离血清,利用微量凝集法测定针对3种血清型副猪嗜血杆菌抗体效价,计算每组的平均效价,结果如图1所示,副猪嗜血杆菌3价灭活疫苗免疫后1周并未检测到针对4型、5型及12型副猪嗜血杆菌抗体效价。从免疫后第2周开始,抗体效价逐渐增长,其中针对4型和12型副猪嗜血杆菌抗体效价分别于对照组相比差异极显著(P<0.001;P<0.01)。自首免后第3周开始,针对3种血清型副猪嗜血杆菌抗体效价显著提高,均与对照组差异极显著(P<0.001)。

图1 仔猪首免后5周血清中各血清型的微量凝集价
2.7 疫苗免疫仔猪对攻毒的保护效果 疫苗免疫保护力结果表明(如表3所示)3价副猪嗜血杆菌灭活疫苗对SH株和JS株可以提供5/5免疫保护,对GD株可以提供4/5免疫保护,而不免疫/攻毒组针对3个H.parasuis分离株分别出现了4头、5头和4头猪只死亡,死亡率分别为4/5、5/5和4/5,免疫/不攻毒组的猪则全部存活。综上,3价灭活疫苗可有效提供针对3株不同血清型毒株免疫保护力。
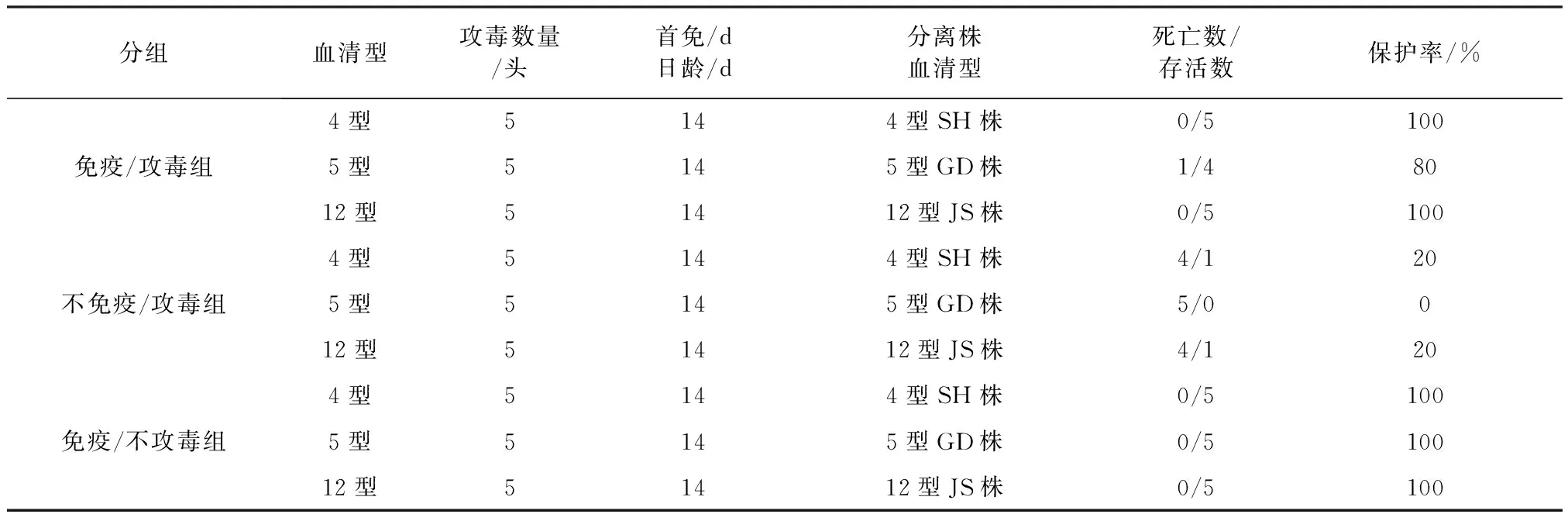
表3 3价副猪嗜血杆菌灭活疫苗免疫效力试验
2.8 仔猪攻毒后临床症状和病理变化 攻毒后80%仔猪呈现明显的临床症状,主要表现为体温升至40.5 ℃以上,咳嗽,呼吸困难,关节肿胀,消瘦,跛行。剖检病理变化主要表现为腹腔积液、胸腔纤维液渗出、心包积液、心包积厚和粘连、腹腔纤维渗出和粘连及关节腔炎性渗出,而未攻毒对照组无异常临床表现。
3 讨论
本试验共分离34株H.parasuis,其中,6株血清4型(17.65%)、10株血清5型(29.41%)、10株血清12型(29.41%)、4株血清13型(11.76%),表明血清4型、5型和12型副猪嗜血杆菌是我国流行的血清型,与之前报道的结果相符[11-13]。
以H.parasuis为病原的格拉泽病引发猪的高发病率和高死亡率,给我国生猪养殖带来了重大的经济损失。当前,有效的商业疫苗还不能对所有血清型的H.parasuis带来交叉保护[13-14]。有报道表明,血清4型和5型副猪嗜血杆菌灭活疫苗可以减少由4型、5型、13型和14型H.parasuis感染所引起的死亡率和临床症状,但其并不能保护我国主要流行的12型HPS感染[7]。因此,制备能够保护4型、5型和12型H.parasuis感染的3价灭活疫苗十分必要。
本研究以筛选出的4型SH1012株、5型GD1022株和12型JS1015株作为制备副猪嗜血杆菌病三价灭活疫苗的候选菌株,并进行仔猪攻毒保护试验,结果显示,仔猪二免3价疫苗后显著提高针对H.parasuis4型、5型、12型的血清效价,且显著降低各血清型H.parasuis强毒攻毒时发病率和死亡率。表明该3价副猪嗜血杆菌灭活疫苗具有较好的免疫原性,可以抵抗对应血清型H.parasuis强毒的攻击,具有较好临床推广前景。

