苦参碱对大鼠乳腺癌细胞荷瘤生长及其炎性因子与免疫功能的影响*
张瑞奎, 汪 超
(武警后勤学院附属医院肿瘤外科, 天津 300162)
乳腺癌位居女性恶性肿瘤发病率、病死率的第一位。据国际癌症研究机构预测,2015~2035年乳腺癌新发病例亦将呈现逐年增加态势,并呈现年轻化趋势。临床上,中药制剂能够显著改善癌症的有效性指标,提高癌症患者的生活质量,降低毒副作用发生率。苦参碱是存在于苦参根部的生物碱,具有抗炎、抗过敏、抗病毒、抗心室重构、抗肿瘤作用[1-2]。肿瘤病人免疫功能低下,炎性因子也影响着肿瘤的发生、发展[3]。荷瘤,指机体有肿瘤,移植瘤是荷瘤的一种,鼠是常用的荷瘤动物。本实验采用乳腺癌细胞荷瘤大鼠模型,研究苦参碱对肿瘤的抑制作用、观察血液中相关炎性因子的变化,探讨苦参碱对细胞免疫和体液免疫的影响,以期为苦参碱的临床应用提供参考。
1 材料与方法
1.1 实验动物及乳腺癌瘤株
SPF级雌性Wistar大鼠,体质量(180-200) g 60只,体质量100 g 3只,购自北京维通利华实验动物中心。乳腺癌(Walker256)瘤株购自中国科学院上海细胞库。
1.2 实验药品
苦参碱由大连美仑生物技术有限公司生产;香菇多糖片由浙江普洛康浴天然药物有限公司生产。
1.3 实验试剂与仪器
大鼠IL-2、IFN-γ、IL-6、IL-10、TGF-β ELISA试剂盒购自上海朗顿生物技术有限公司;电子天平(BSA124S-CW,梅特勒-托利多仪器上海有限公司);酶标仪(BMG FLUOstar Omega, LRBTECH公司)。
1.4 乳腺癌细胞荷瘤大鼠模型[4]的建立
冻存的乳腺癌细胞株Walker256复苏后,以细胞培养用PBS液调整细胞密度至2×107cells/ml,3只100 g大鼠各用无菌注射器腹腔注射细胞悬液1 ml接种。7 d后抽取大鼠腹水,800 r/min离心5 min,用PBS液调整细胞密度为5×107cells/ml,取0.4 ml细胞悬液接种于Wistar大鼠右腋皮下。观察大鼠一般情况,发现接种4 d后大鼠体重明显减轻,摄食量明显减少,活动量明显减少,毛发无光泽等体征,大鼠右腋皮下可触及黄豆大小的肿块,表明大鼠乳腺癌细胞荷瘤模型成功建立。
1.5 分组及给药
60只成年Wistar大鼠,随机分为对照组(n=10)和乳腺癌细胞荷瘤大鼠建模组(n=50)。建模后,50只大鼠再随机分为5组(n=10):模型组,香菇多糖(200 mg/kg)组,苦参碱低(50 mg/kg)、中(100 mg/kg)、高(200 mg/kg)剂量组,按给药剂量及给药体积(10 ml/kg),用蒸馏水将苦参碱和香菇多糖配成悬液。造模当天,香菇多糖组和苦参碱低、中、高剂量组大鼠腹腔注射给药,2次/d,连续14 d;对照组和模型组腹腔注射相应体积的蒸馏水。末次给药前禁食12 h,给药后1 h腹腔注射2%戊巴比妥钠 (60 mg/kg)麻醉。固定大鼠后打开腹腔,经腹主动脉采血6 ml,然后处死大鼠,分离大鼠腋下乳腺癌肿块组织。
1.6 ELISA检测血清炎性因子
分离3 ml腹主动脉采集血液的血清,用于检测血清中IL-2、IFN-γ、IL-6、IL-10及TGF-β水平,实验步骤严格按照试剂盒说明书进行,终止反应后,使用酶标仪测定450 nm处吸光度值。
1.7 细胞免疫、体液免疫指标检测
腹主动脉采集的另3 ml血液使用淋巴细胞分离液分离有核细胞。有核细胞经染色30 min后,弃去上清液,冲洗2次,流式细胞仪检测外周血T细胞亚群CD3+、CD4+、CD8+的水平。采用免疫散射比浊法检测免疫球蛋白IgG、IgM、IgA水平。
1.8 抑瘤率的计算
用电子天平精确称量分离所得的瘤组织质量并计算抑瘤率,抑瘤率=(模型组平均瘤质量-用药组平均瘤质量)/模型组平均瘤质量。
1.9 统计学处理
2 结果
2.1 苦参碱对荷瘤大鼠肿瘤生长的影响
对照组无瘤块。模型组瘤块较大,平均质量为(6.62±1.20) g。与模型组比较,香菇多糖组和苦参碱低、中、高剂量组瘤块平均质量分别为(4.77±0.95) g、(4.99±0.93) g、(4.52±0.92) g、(4.22±1.18) g,均明显减轻,差异具有统计学意义(P<0.05)。与香菇多糖组比较,苦参碱低、中、高剂量组瘤块平均质量均无明显差异(P>0.05);香菇多糖组和苦参碱低、中、高剂量组的抑瘤率分别为27.9%、24.6%、31.7%、36.3%,四组之间无统计学差异,苦参碱低、中、高剂量组呈现出剂量依赖性抑制肿瘤生长的趋势(表1)。


GroupTumor weight(g)Inhibitory rate(%)Vehicle6.62±1.20 -Lentinan4.77±0.95**27.9Matrine (low dose)4.99±0.93**24.6Matrine (middle dose)4.52±0.92**31.7Matrine (high dose)4.22±1.18**36.3
**P<0.01vsvehicle group
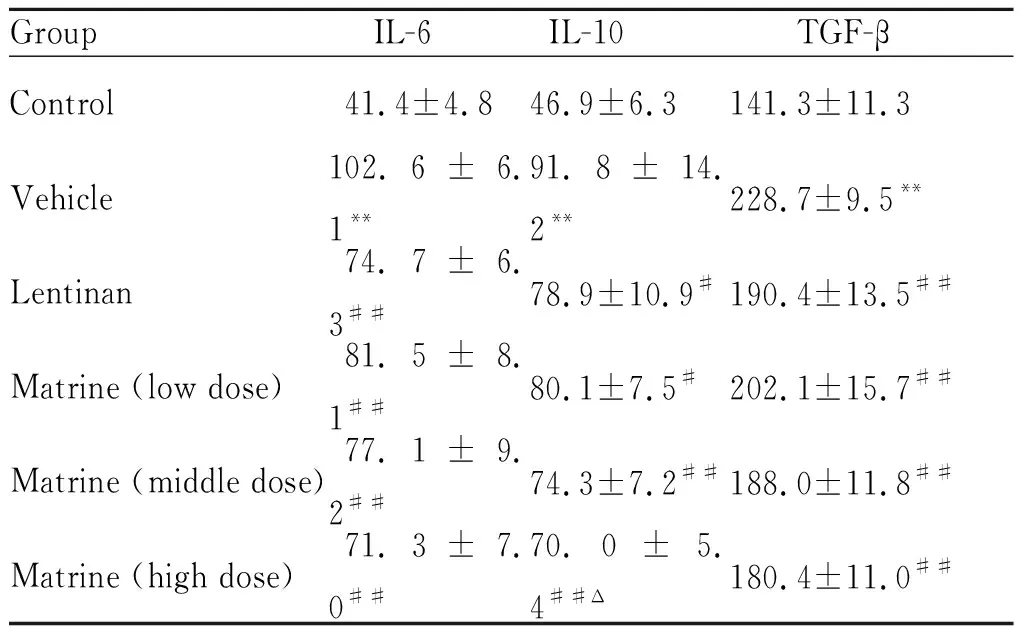
2.2 苦参碱对荷瘤大鼠外周血IL-2、IFN-γ、IL-6、IL-10和TGF-β水平的影响
与对照组比较,模型组大鼠外周血IL-2、IFN-γ水平均明显降低(P<0.01),IL-6、IL-10和TGF-β水平均明显升高(P<0.01)。与模型组比较,香菇多糖组和苦参碱低、中、高剂量组大鼠外周血IL-2、IFN-γ水平明显升高(P<0.01);IL-6、IL-10和TGF-β水平均明显降低(P<0.01,P<0.05);苦参碱低、中、高剂量组呈现出剂量依赖性作用的趋势。与香菇多糖组比较,苦参碱高剂量组大鼠外周血IL-2和IFN-γ水平明显升高(P<0.01),低剂量组IFN-γ水平明显降低(P<0.05);高剂量组IL-10水平明显降低(P<0.05,表2-3)。


GroupIL-2IFN-γControl222.6±10.6271.4±9.7Vehicle145.6±7.5**202.7±17.0**Lentinan174.2±9.9##235.9±13.6##Matrine (low dose)170.2±11.7##224.6±10.0##ΔMatrine (middle dose)182.9±12.7##232.5±8.6##Matrine (high dose)189.8±12.6##ΔΔ253.1±10.7##ΔΔ
IL-2: Interleukin 2; IFN-γ: Interferon -γ
**P<0.01vscontrol group;##P<0.01vsvehicle group;ΔP<0.05,ΔΔP<0.01vslentinan group

Group IL-6 IL-10TGF-βControl41.4±4.846.9±6.3141.3±11.3Vehicle102.6±6.1**91.8±14.2**228.7±9.5**Lentinan74.7±6.3##78.9±10.9#190.4±13.5##Matrine (low dose)81.5±8.1##80.1±7.5#202.1±15.7##Matrine (middle dose)77.1±9.2##74.3±7.2##188.0±11.8##Matrine (high dose)71.3±7.0##70.0±5.4##Δ180.4±11.0##
IL-6: Interleukin-6; IL-10: Interleukin-10; TGF-β: Transforming growth factor-β
**P<0.01vscontrol group;#P<0.05,##P<0.01vsvehicle group;ΔP<0.05vslentinan group
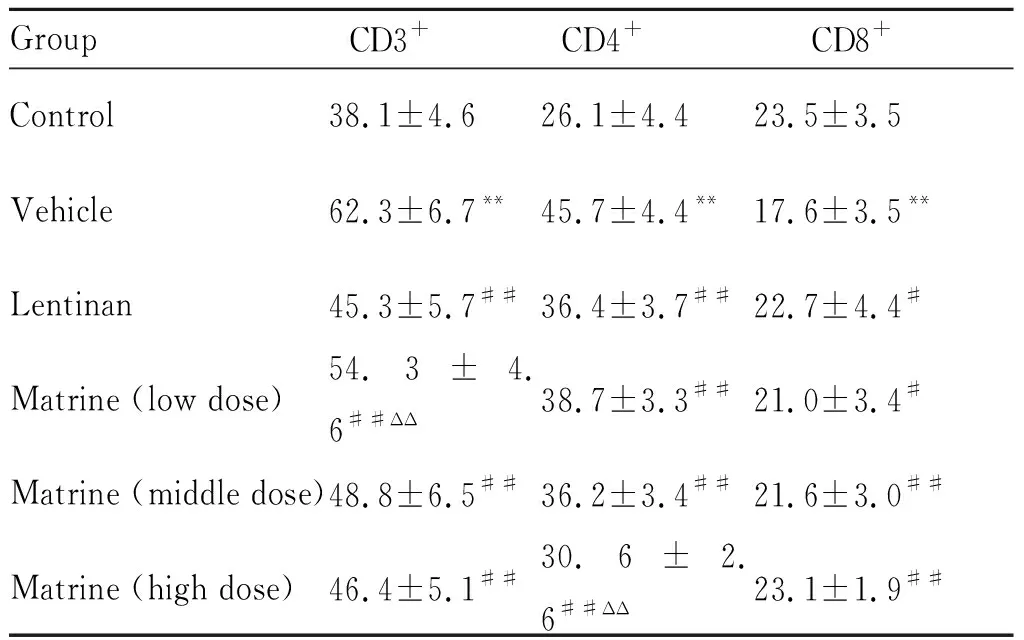
2.3 苦参碱对荷瘤大鼠细胞免疫和体液免疫指标的影响
与对照组比较,模型组大鼠外周血CD3+、CD4+、IgG、IgM、IgA水平均明显升高(P<0.01),CD8+水平明显降低(P<0.01)。与模型组比较,香菇多糖组和苦参碱低、中、高剂量组大鼠外周血CD3+、CD4+、IgG、IgM、IgA水平明显降低(P<0.01,P<0.05);CD8+水平均明显升高(P<0.01,P<0.05),苦参碱低、中、高剂量组呈现出剂量依赖性作用的趋势。与香菇多糖组比较,苦参碱高剂量组大鼠外周血CD4+水平明显降低(P<0.01);低、中剂量组大鼠外周血IgM、IgA和高剂量组IgA水平明显升高(P<0.01,P<0.05,表4-5)。

Group CD3+ CD4+CD8+Control38.1±4.626.1±4.423.5±3.5Vehicle62.3±6.7**45.7±4.4**17.6±3.5**Lentinan45.3±5.7##36.4±3.7##22.7±4.4#Matrine (low dose)54.3±4.6##ΔΔ38.7±3.3##21.0±3.4#Matrine (middle dose)48.8±6.5##36.2±3.4##21.6±3.0##Matrine (high dose)46.4±5.1##30.6±2.6##ΔΔ23.1±1.9##
**P<0.01vscontrol group;#P<0.05,##P<0.01vsvehicle group;ΔΔP<0.01vslentinan group


Group IgG IgMIgAControl10.64±2.921.43±0.171.13±0.14Vehicle15.28±2.51**2.08±0.13**2.63±0.18**Lentinan11.65±2.28##1.64±0.11##1.70±0.33##Matrine (low dose)12.84±1.11#1.93±0.17#ΔΔ2.38±0.22#ΔΔMatrine (middle dose)11.86±2.02##1.75±0.12##Δ2.12±0.15##ΔΔMatrine (high dose)11.74±1.57##1.67±0.10##2.02±0.24##Δ
**P<0.01vscontrol group;#P<0.05,##P<0.01vsvehicle group;ΔP<0.05,ΔΔP<0.01vslentinan group
3 讨论
中药苦参碱具有抑制肿瘤、调节免疫、抗炎镇痛等功能。本实验通过建立乳腺癌细胞荷瘤大鼠模型,观察苦参碱对大鼠乳腺癌细胞荷瘤生长及其炎性因子与免疫功能的影响。
肿瘤免疫分为免疫清除、免疫平衡和免疫逃逸三个阶段[5-6]。在免疫清除期,免疫系统可以抑制肿瘤的生长,起到免疫清除作用,其中IFN-γ、IL-2等起到重要作用。在免疫平衡期,肿瘤细胞获得新的免疫特性,诱导IL-6、IL-10、TGF-β等炎性因子过度产生,在肿瘤细胞周围形成免疫抑制的微环境[7]。在免疫逃逸期,免疫系统反而促进肿瘤的发展[8]。
本实验发现,模型组大鼠外周血IL-2、IFN-γ水平较对照组明显降低,IL-6、IL-10、TGF-β水平较对照组明显升高;苦参碱低、中、高剂量组能明显逆转这种变化,纠正荷瘤大鼠体内炎性因子的紊乱,并且呈现出剂量依赖性作用的趋势。
肿瘤可使机体的细胞免疫和体液免疫发生异常改变。细胞免疫主要表现为T淋巴细胞亚群的改变,包括CD3+、CD4+水平明显升高和CD8+水平明显降低[9]。体液免疫方面表现为由B淋巴细胞分泌的免疫球蛋白IgG、IgM、IgA含量明显升高[10]。经苦参碱低、中、高剂量治疗后,可使血清CD3+、CD4+水平明显降低、CD8+水平明显升高;可使血清免疫球蛋白IgG、IgM、IgA含量明显降低,并且呈现出剂量依赖性作用的趋势。
在实验性乳腺癌细胞荷瘤大鼠模型上,苦参碱在抑制瘤块生长、纠正炎性因子紊乱、调节免疫功能异常方面的疗效与目前广泛应用于临床的香菇多糖没有明显差异性,说明苦参碱具有很大的开发利用价值。

