复合营养液对中华绒螯蟹单体养殖试验效果
黄 坚,陈义培,岳武成,陈晓雯,刘庆华,彭智文,王 军,王成辉
(上海海洋大学农业部淡水水产种质资源重点实验室,水产科学国家级实验教学示范中心,上海水产养殖工程技术研究中心,上海 201306)
中华绒螯蟹(Eriocheirsinensis)俗称河蟹,为杂食性甲壳类,具有好格斗与抢食的生活习性[1-2]。中华绒螯蟹的这种互相间好格斗习性,造成了养殖生产上总产量不高[3]。因而,中华绒螯蟹单体养殖也逐渐引起了人们的重视。杨培根等[4]于1997年开展了中华绒螯蟹的单体笼养试验,发现4个多月内平均蜕壳2.3次,蜕壳后体质量平均增长33.2%。黄姝等[5]在250 L的实验水槽内进行了中华绒螯蟹成蟹阶段的单体蜕壳与生长观察,在200 d的实验期内,河蟹进行了4次蜕壳,每次蜕壳后的体质量平均增长率为48.7%~80.1%。陈娇[6]在室内60 L水槽内对成蟹在一个蜕壳周期内的单体蜕壳与生长进行了连续观察,发现河蟹的肥满度60% 左右时启动下一次蜕壳。但由于受单体养殖设施等条件的制约,国内对中华绒螯蟹单体养殖中添加营养液的试验一直较少。
近年来,一种新型的蟹类养殖设施—“个体养殖系统”开始进入人们的视线[7-8]。个体养殖系统是将一个个小型养殖盒进行立体式组装,宛如一栋“公寓”,每栋“公寓”配备了水处理设备、杀菌设备和控温设备等,以实现蟹类的循环水控温养殖。“个体养殖系统”是将“扁平开放式”转变为“立体封闭式”的蟹类单体养殖,避免了蟹类间的互相格斗,为蟹类的单体养殖创造了条件。此外,“个体养殖系统”采用循环水养殖,节约了水资源,避免了养殖废水的排放污染。然而,目前尚无在“个体养殖系统”中添加营养液进行中华绒螯蟹单体养殖试验的报道。本实验向“个体养殖系统”水体中添加营养液进行了中华绒螯蟹的成蟹单体暂养试验,旨在了解“个体养殖系统”水体中添加营养液对中华绒螯蟹成熟单体养殖后生长指标与营养成分的差异情况。
1 材料和方法
1.1 样品的采集
2016年10月底,取上海福岛水产养殖专业合作社饲养的“江海21”配套选育B系,经亲本筛选后的剩余雄蟹,规格为每只100~130 g,数量150只。
1.2 试验设计
“个体养殖系统”为本实验室与上海泓循环境科技发展有限公司合作开发的自动控温循环水全封闭的河蟹养殖系统。养殖盒规格为40 cm×30 cm×18 cm,每个盒内放养一只蟹。实验蟹在系统内适应一周开始正式试验,将“个体养殖系统”分为A、B两组,水源均为自来水。A组放养63只成蟹,其饲养水体中加入1‰ 的葡萄糖和1‰ 的谷氨酸钠作为营养液,每周日晚换水并重新加入同样的营养液;B组放养56只成蟹,其水体不加营养液;其余31只成蟹直接测量其体质量、壳长、壳宽等生长指标,解剖后取肝胰腺、性腺进行营养成分分析作为暂养前对照组。放养前测量每只河蟹的体质量、壳长、壳宽等生长指标。试验期间的水温设置为20 ℃,每天傍晚6点投喂瓯江彩鲤“龙申1号”鱼肉,采用“饱食投喂法”,第二天早晨9点清除残饵。其中A、B两组水质指标一样。正式试验日期从2016年11月7日—12月7日,共30 d。
1.3 生长参数测定
试验结束时,分别对所有河蟹称重后,取肝胰腺、性腺进行营养成分分析。相关生长参数的计算方法如下:
成活率=试验结束时成活个体数/试验开始时个体数×100%
RBW=(WBn﹣WBn-1)/WBn-1× 100%
F=W/L3×100
式中,RBW为增重率(%),WB为体质量(g),F为肥满度,L为壳长(cm)
1.4 背甲色度值测定
利用色差仪分别对暂养前后试验河蟹在水煮前、后(沸水煮10 min)的背甲5个部位点(左上、左下、中部、右上、右下)的颜色色度值进行测定,然后换算成每只蟹的平均色度值。
1.5 肝胰腺的甜度测定
取试验河蟹的肝胰腺 0.5 g于1.5 mL离心管中并放入锅中煮10 min,对煮熟的肝胰腺进行研磨,利用糖度计对研磨出汁的肝胰腺进行测定。
1.6 营养成分分析
试验河蟹肝胰腺和性腺组织中氨基酸、脂肪酸含量的测定参照刘庆华等[9]的方法。
1.7 数据处理与分析
所有数据采用平均数±标准差(Mean±SD)表示,应用SPSS 17.0统计软件进行数据处理与显著性检验,P<0.05为显著,P<0.01为极显著。
2 结果分析
2.1 暂养前后及暂养方式的相关表型差异分析
通过30 d的“个体养殖系统”暂养, A组和B组的成活率均在70% 以上,A组平均增重3.76%,B组平均增重1.34%,与暂养前相比,体重和肥满度均有极显著增加,且A组的增重率显著高于B组(表1)。从肝胰腺的甜度看, A组在暂养后极显著高于暂养前,而B组在暂养后却极显著低于暂养前,其中A组极显著高于B组。从背甲的颜色色度值看,A组和B组在水煮前(活体)的颜色色度值均比暂养前有极显著提高,且B组极显著高于A组。

表1 暂养前后中华绒螯蟹的相关表型差异比较Tab.1 Relative phenotypic difference of E.sinensis before and after preservation
注:同行不同上标小写字母表示差异显著(P<0.05),不同上标大写字母表示差异极显著(P<0.01)。
2.2 暂养前、后及暂养方式肝胰腺营养成分比较
2.2.1 肝胰腺氨基酸含量
暂养前、后的肝胰腺中均检测出17种氨基酸。从暂养前后来看,暂养后的必需氨基酸总量略高于暂养前,但只有暂养B组的苯丙氨酸(PHE)含量极显著高于暂养前(表2)。从暂养方式来看,B组必需氨基酸总量与氨基酸总量略高于A组,除了B组的苯丙氨酸(PHE)含量极显著高于A组,其它单个氨基酸组分及其鲜味氨基酸总量均不存在显著差异。可见 “个体养殖系统”水体中添加营养液对中华绒螯蟹肝胰腺中的氨基酸含量不存在显著影响。
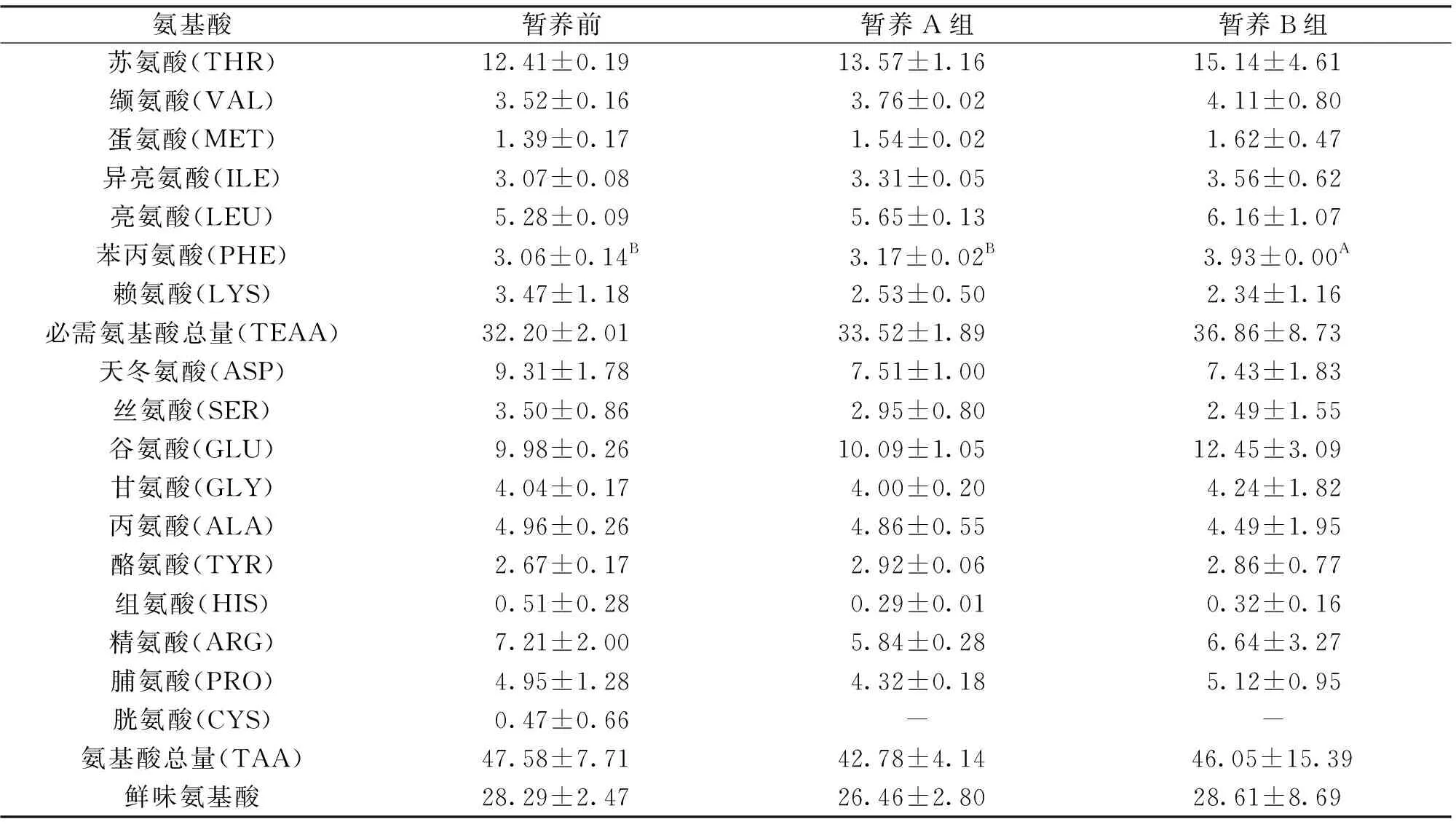
表2 暂养前、后中华绒螯蟹肝胰腺中的氨基酸组成与含量Tab.2 Amino acid composition and content in hepatopancreas of E.sinensis before and after preservation g/kg
注:同行不同上标小写字母表示差异显著(P<0.05),不同上标大写字母表示差异极显著(P<0.01)。
2.2.2 肝胰腺脂肪酸含量
本实验蟹的肝胰腺中共检出28种脂肪酸(表3)。从暂养前后来看,4种饱和脂肪酸(C14∶0、C17∶0、C22∶0、C23∶0)、3种单不饱和脂肪酸(C14∶1、C20∶1N9、C22∶1N9)和3种多不饱和脂肪酸(C18∶2N6C、C18∶3N6、C22∶2N6)在暂养前后存在显著差异。从暂养方式来看,2种饱和脂肪酸(C17∶0、C22∶0)、2种单不饱和脂肪酸(C20∶1N9、C22∶1N9)、3种多不饱和脂肪酸(C18∶2N6C、C18∶3N6、C22∶2N6)在A、B两个暂养组间存在显著差异,其中暂养A组的饱和脂肪酸总量(ΣSFA)显著低于B组。结果表明:“个体养殖系统”水体中添加营养液对中华绒螯蟹肝胰腺中的总体脂肪酸含量没有显著影响。
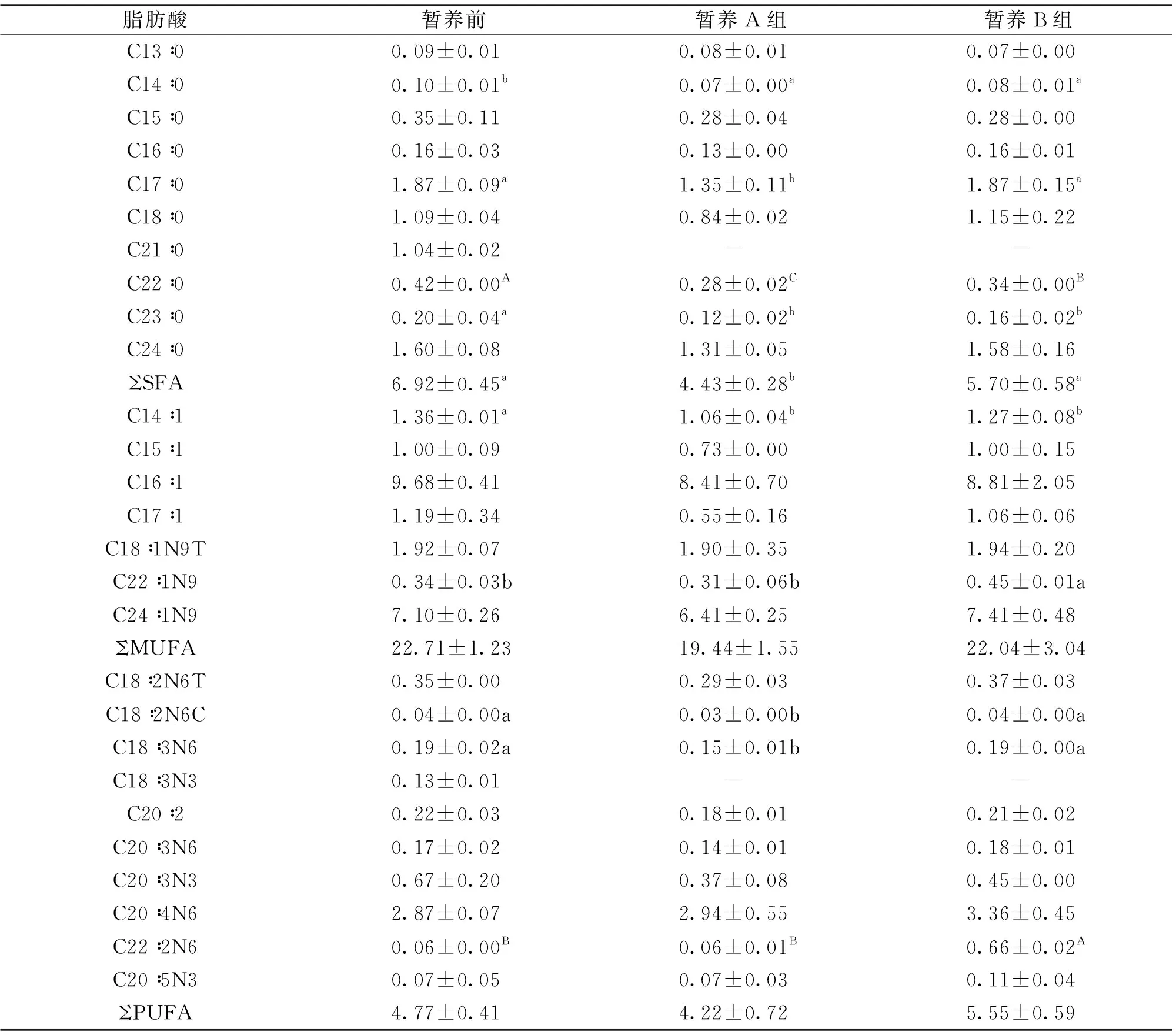
表3 暂养前、后中华绒螯蟹肝胰腺中的脂肪酸组成与含量Tab.3 Composition and content of fatty acids in hepatopancreas of E.sinensis before and after preservation g/100g
注:同行不同上标小写字母表示差异显著(P<0.05),不同大写上标字母表示差异极显著(P<0.01)。
2.3 暂养前、后及暂养方式性腺营养成分比较
2.3.1 性腺氨基酸含量
暂养前、后从实验蟹的性腺中也均检出了17种氨基酸(表4)。从暂养前后来看,A组暂养后的必需氨基酸、鲜味氨基酸和氨基酸总量分别比暂养前提高31.10%、51.75%和50.70%;B组暂养后的必需氨基酸、鲜味氨基酸和氨基酸总量分别比暂养前提高49.11%、89.99%和80.71%,差异显著。从暂养方式来看,B组的必需氨基酸、鲜味氨基酸和氨基酸总量分别比A组高13.74%、22.79%和19.91%。通过“个体养殖系统”暂养中华绒螯蟹性腺中的氨基酸含量有明显提高,但水体中添加营养液对中华绒螯蟹性腺中的总体氨基酸含量没有显著影响。
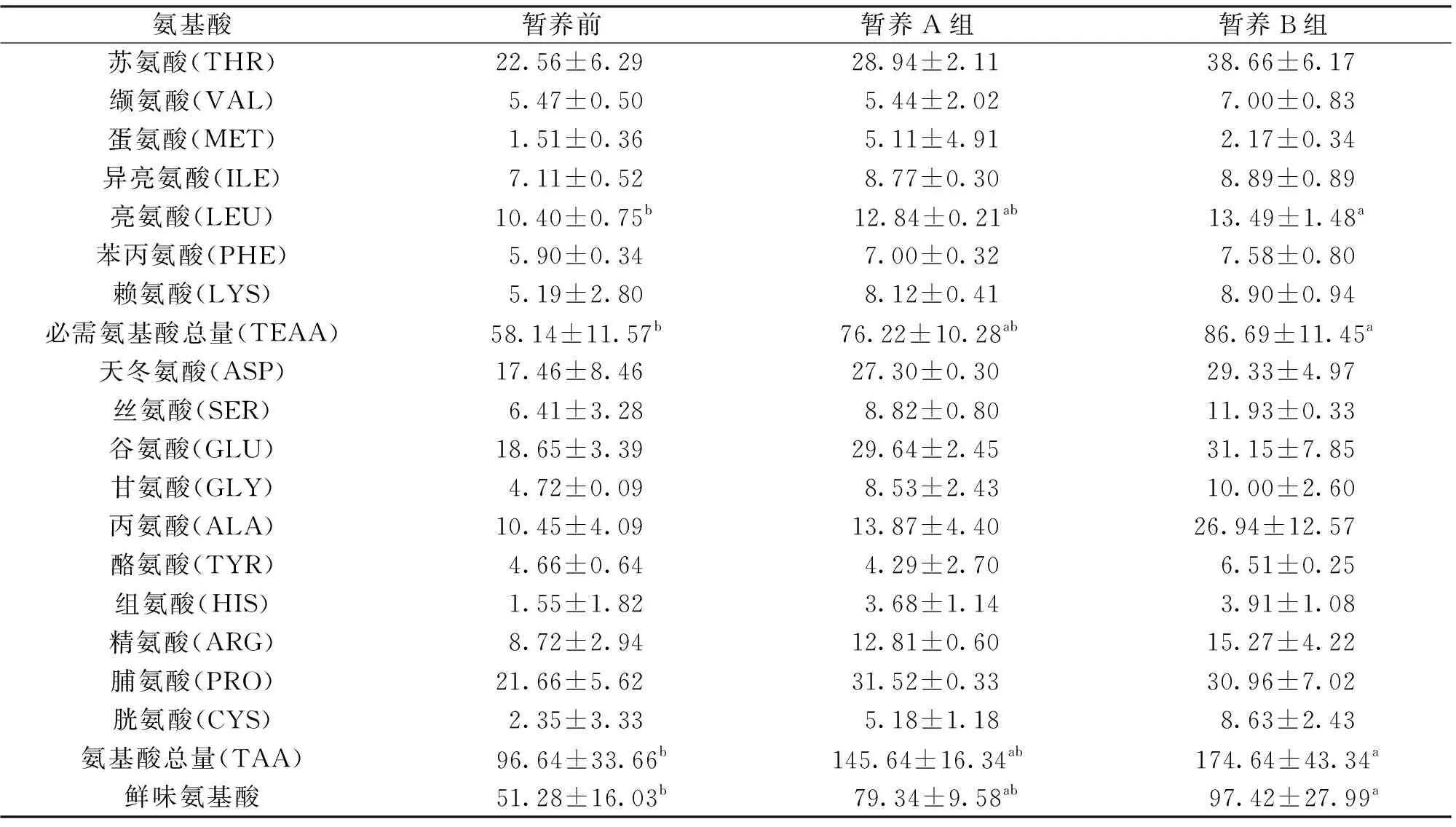
表4 暂养前后中华绒螯蟹性腺中的氨基酸组成与含量Tab.4 Amino acid composition and content in gonads of E.sinensis before and after preservation g/kg
注:同行不同上标小写字母表示差异显著(P<0.05),不同上标大写字母表示差异极显著(P<0.01).
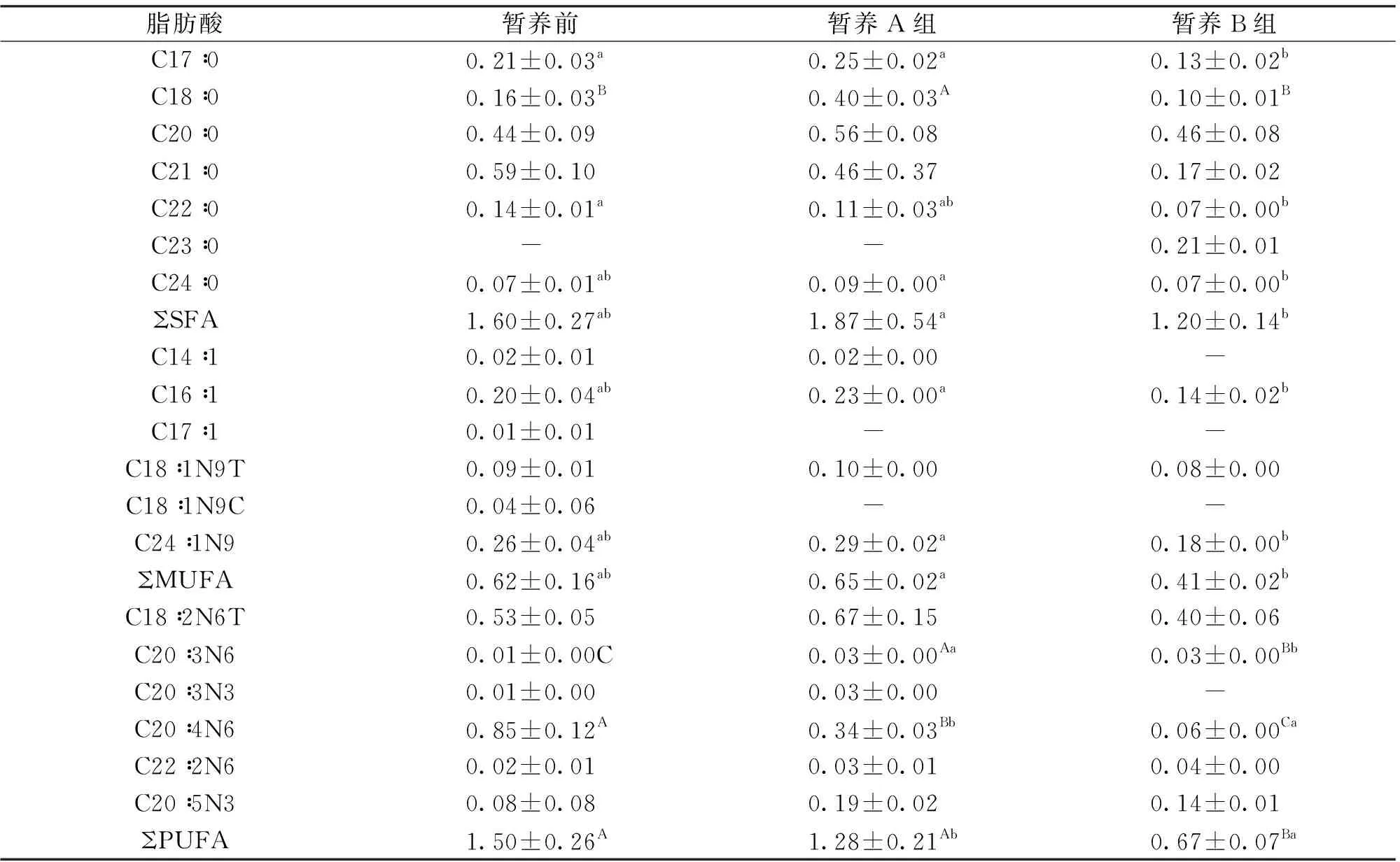
表5 暂养前、后中华绒螯蟹性腺中的脂肪酸组成与含量Tab.5 Composition and content of fatty acids in gonads of E.sinensis before and after preservation g/100g
注:同行不同上标小写字母表示差异显著(P<0.05),不同上标大写字母表示差异极显著(P<0.01).
2.3.2 性腺脂肪酸含量
本次实验蟹的性腺中只检出19种脂肪酸(表5)。从暂养前后来看,4种饱和脂肪酸(C17∶0、C18∶0、C22∶0、C24∶0)、2种单不饱和脂肪酸(C16∶1、C24∶1N9)和2种多不饱和脂肪酸(C20∶3N6、C20∶4N6)在暂养前后存在显著差异。从暂养方式来看,3种饱和脂肪酸(C17∶0、C18∶0、C24∶0)、2种单不饱和脂肪酸(C16∶1、C24∶1N9)和2种多不饱和脂肪酸(C20∶3N6、C20∶4N6)在A、B两个暂养组间存在显著差异,其它脂肪酸在A、B两个暂养组间均不存在显著差异。A组的性腺饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸均显著高于B组。结果表明:“个体养殖系统”暂养后,对中华绒螯蟹性腺中的总体脂肪酸含量没有显著影响,但向水体中添加营养液中华绒螯蟹性腺中的总体脂肪酸会明显提高。
3 讨论
不同的养殖水体环境[10-11]和水体营养[12]对中华绒螯蟹的生长具有明显的影响。本研究发现,通过“个体养殖系统”对中华绒螯蟹的单体暂养,成活率在70% 以上。A组的增重率显著高于B组。表明“个体养殖系统”对中华绒螯蟹的成熟单体暂养确实有育肥作用,在“个体养殖系统”水体中添加葡萄糖、谷氨酸钠对中华绒螯蟹的成熟单体暂养的育肥更为明显,这可能是中华绒螯蟹吸收了营养液中的谷氨酸钠后增大了食欲,加快生长。对于肝胰腺的甜度,A组极显著高于B组,表明在“个体养殖系统”水体中添加葡萄糖、谷氨酸钠能够改善中华绒螯蟹的肝胰腺甜味,这可能是中华绒螯蟹在吸收了营养液中的葡萄糖后积累到肝胰腺,使其变甜。
中华绒螯蟹蟹壳体色对其价格有直接的影响[13],孔丽[14]的研究结果表明不同的体色,主要由于体内含有不同的色素细胞,影响中华绒螯蟹体色的色素细胞大部分来自于胡萝卜群的色素[15]。龚志等[13]的研究结果表明蟹壳内含有类胡萝卜素,伴随着中华绒螯蟹的生长,其体内产生的胡萝卜素也就越多。本研究发现,A组水煮前(活体)的背甲颜色色度值显著低于B组,这可能是葡萄糖消耗了部分类胡萝卜素。因为,葡萄糖氧化后会产生热量[16],而丘生译[15]研究发现胡萝卜素在低温情况下不容易分解,在高温情况下会加快分解。
中华绒螯蟹的口感风味与鲜味氨基酸的含量有关,刘庆华等[9]研究结果表明中华绒螯蟹鲜味氨基酸主要有丙氨酸(ALA)、谷氨酸(GLU)、甘氨酸(GLY)、天冬氨酸(ASP)4种氨基酸。本研究还发现,B组肝胰腺必需氨基酸总量、鲜味氨基酸、氨基酸总量分别比A组高9.96%、8.13%、7.64%,B组性腺必需氨基酸总量、鲜味氨基酸、氨基酸总量分别比A组高13.74%、22.79%和19.91%。这可能是营养液中的葡萄糖消耗了部分氨基酸。因为葡萄糖与甘氨酸(GLY)、苏氨酸(THR)、丙氨酸(ALA)、谷氨酸(GLU)、天冬氨酸(ASP)等会发生取代反应[17-22],生成葡萄糖氨基酸糖胺,消耗了氨基酸的含量。
中华绒螯蟹的口感风味还与不饱和脂肪酸的含量有关,刘庆华等[9]研究结果表明不饱和脂肪酸含量越高,中华绒螯蟹的口感风味也就越好。本研究还发现,A组肝胰腺的单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)与B组均不存在显著差异,而A组性腺的饱和脂肪酸总量(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)均显著高于B组,这可能是水体中添加营养液增加了脂肪酸的含量。因为葡萄糖可以转化成脂肪酸[23-24],从而增加了脂肪酸的含量。
综上所述,本研究揭示了在“个体养殖系统”暂养前、后及暂养方式中华绒螯蟹的体重肥满度、甜度、背甲颜色值、营养成分的变化特征,表明在“个体养殖系统”水体中添加营养液对中华绒螯蟹成熟单体的体重、甜度、性腺的脂肪酸营养成分是有显著提高的。

