罗氏沼虾蜕皮周期的划分及蜕皮频率对生长的影响
卢徐斌,姜 群,闵 悦,姜 熙,杨章平,孙龙生,张晓君
(扬州大学动物科学与技术学院, 江苏扬州 225009)
甲壳动物在生长发育的过程中会周期性地生成新的外骨骼、蜕掉旧的外骨骼,这种现象称为蜕皮,蜕皮贯穿个体发育的始终,使甲壳动物出现阶梯式生长[1]。掌握甲壳动物的蜕皮规律,对开展蜕皮的调控和生长相关研究具有重要意义,而探究蜕皮周期的划分是开展其他研究的基础和前提。目前甲壳动物蜕皮周期划分有两种方法,分别是形态特征观察法和显微结构观察法。形态特征观察法简洁实用,适用于所有十足目甲壳动物,但不够精细准确。显微结构观察法较为精准,但耗时长且较繁琐,不适宜现场采样和样品数量较大时采用[2],因此开发出一种快速且准确的周期划分方法尤为重要。甲壳动物蜕皮周期的划分一般分为蜕皮后期、蜕皮间期、蜕皮前期和蜕皮期,其中蜕皮前期又可分为不同的亚期,划分依据在不同物种中有所差异,例如:王战芳[3]依据步足末端刚毛、羽小枝及内部圆锥的变化,将中华锯齿米虾(Neocaridinadenticulatasinensis)的蜕皮前期细分为 D0-1亚期和D2-4亚期2个亚期;Tian等[4]依据第三颚足外肢末端结构特征及刚毛的形态特征将中华绒螯蟹(Eriocheirsinensis)的蜕皮前期细分为D0、D1和D2-4期,因此应针对具体物种确定其特有的划分依据。
罗氏沼虾(Macrobrachiumrosenbergii) 又称马来西亚大虾或泰国虾,其食性广、生长快、肉质鲜嫩,是目前世界上养殖产量最高的三大虾种之一[5-6],也是我国重要淡水经济虾类,2016年全国罗氏沼虾养殖产量达13.27万吨[7]。1977年,John等[8]根据外骨骼色素回缩和显微观察等方法对罗氏沼虾蜕皮周期进行划分,但是罗氏沼虾活体中难以区分外骨骼与新表皮之间的色素,使得色素回缩的特征难以辨认。而且,John文章中的显微观察的图片分辨率较低,且缺少不同亚期的图片,因此罗氏沼虾蜕皮周期划分的标准有待更新。本研究采用形态特征和显微观察相结合的方法,建立了一种快速准确划分罗氏沼虾蜕皮周期的方法,为蜕皮相关研究提供基础。另外,近年来,罗氏沼虾养殖过程中发现,部分个体生长缓慢,上市季节难以达到商品规格,严重影响养殖的产量与效益[9]。针对这一现象,本研究通过分析不同生长速度群体的蜕皮周期和蜕皮频率,探索蜕皮对罗氏沼虾生长的影响,以期为罗氏沼虾的科学研究和生产实践提供基础资料。
1 材料和方法
1.1 罗氏沼虾蜕皮周期划分方法的建立
实验采用6尾稚虾(2.08±0.01)g和6尾成虾(6.94±0.42) g为材料,进行蜕皮周期的观察,所有实验样品饲养于相同水体不同隔间内,每日观察其形态特征,剪游泳足末端置于OLYMPUS CX21FS显微镜下进行显微观察并拍照,日投饵2次,投喂量约为体重的4%,日换水1/3体积,连续充氧,饲养周期40 d。
1.2 蜕皮频率对罗氏沼虾生长速度的影响
本研究采用1个生长缓慢群体(E1组)作为实验组,2个正常生长群体(C1和C2组)作为对照组,每组设三个重复(表1)。E1和C1组取自同一虾塘,约140日龄,取18尾小规格虾(1.97±0.24) g作为E1组,18尾大规格虾(6.28±0.47) g作为C1组;C2组样品来自另一虾塘,约80日龄,规格与E1相仿(1.95±0.19) g。每6尾虾置于一个水族箱内饲养,饲养条件同上,每天记录蜕皮次数,饲养周期为44 d。蜕皮频率的计算公式为:蜕皮频率=蜕皮总次数/(饲养天数×每箱虾尾数),每组虾的蜕皮频率结果以平均数±标准误表示,并用 SAS 9.2进行单因素方差分析(ANOVA),通过Duncan检测方法进行组间差异显著性分析,P<0.05时差异显著。

表1 实验样品分组信息Tab.1 Basic information about samples in this study
2 结果
2.1 罗氏沼虾蜕皮周期的划分
结合形态特征和显微观察法,将罗氏沼虾的蜕皮周期划分为蜕皮后期(A期和B期)、蜕皮间期(C期)、蜕皮前期(D期)和蜕皮期(E期)四个周期,其中蜕皮后期可细分为A期和B期,蜕皮前期可细分为D0期、D1期、D2期和D3期四个亚期,2种不同规格的罗氏沼虾的蜕皮周期如表2所示,其中体重约为2 g的稚虾蜕皮周期约为15 d,体重约为7 g的成虾蜕皮周期约为19 d。
2.1.1 蜕皮后期(A-B期)
罗氏沼虾蜕皮后,体内水分含量较高,体积较蜕皮前有所增加[10],头胸甲和身体十分柔软,此周期为蜕皮后期。蜕皮后期又可细分为A期和B期:A期的罗氏沼虾额剑柔软可弯曲,个体离开水面后第二步足不能正常抬起(图1)。之后,罗氏沼虾进入蜕皮后期的B期,此时头胸甲和外表皮依旧柔软,略硬于A期,额剑变硬不能自由弯曲,虾体离开水面后第二步足可以正常抬起,剪游泳足末端置于显微镜下观察,刚毛腔充满半透明纤维状基质,羽小枝排列均匀且清晰可见,刚毛内锥正在发育,尚未完全形成(图2)。

表2 罗氏沼虾稚虾和成虾的蜕皮周期Tab.2 Molt cycle of juvenile and adult Macrobrachium rosenbergii
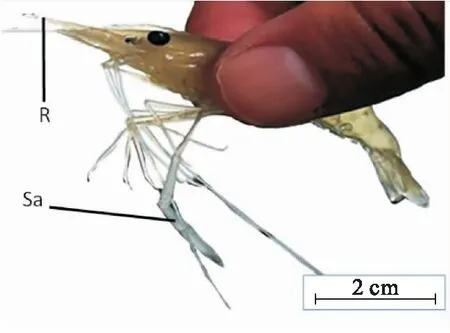
图1 罗氏沼虾的蜕皮后期(A期)Fig.1 Postmolt stage (A) of M.rosenbergiiduring the molt cycle

图2 罗氏沼虾的蜕皮后期(B期)Fig.2 Postmolt stage (B) of M.rosenbergiiduring the molt cycle
2.1.2 蜕皮间期(C期)
罗氏沼虾在蜕皮间期表皮逐渐钙化,外骨骼逐渐变硬,此阶段游泳足末端刚毛内锥形成(图3)。蜕皮间期,罗氏沼虾大量摄食,营养物质开始逐渐积累,为下一次的蜕皮进行物质准备,这一阶段持续时间较长。
2.1.3 蜕皮前期(D期)
蜕皮前期主要为蜕皮作形态上、生理上准备,该阶段变化较大,可分为四个亚期。取游泳足末端置于显微镜下观察可发现,D0期表现为表皮松散,出现新刚毛,新刚毛形状短小,略弯曲,上皮组织与外骨骼之间发生分离且上皮组织外缘形状不规则(图4);D1期,上皮组织与外骨骼之间分离更加明显,两者之间形成回缩区,且上皮组织呈扇形,新刚毛逐渐生长,慢慢进入到旧刚毛内部(图5);罗氏沼虾进入到蜕皮前期的D2期,新刚毛拥有清晰的轮廓,新生表皮明显内折且表面沿着新生刚毛反方向形成一种管状结构,排列有序,John[8]称这种结构为“刚毛器官”,在中华锯齿米虾中称之为管形套结构[3];D2期“刚毛器官”不明显,形状较细,颜色较浅(图6);D3期“刚毛器官”结构极其明显,宽度增加,颜色也变深(图7)。

图3 罗氏沼虾的蜕皮间期(C期)Fig.3 Intermolt stage (C) of M.rosenbergii during the molt cycle

图4 罗氏沼虾的蜕皮前期(D0期)Fig.4 Premolt stage (D0) of M.rosenbergii during the molt cycle

图5 罗氏沼虾的蜕皮前期(D1期)Fig.5 Premolt stage (D1) of M.rosenbergii during the molt cycle

图6 罗氏沼虾的蜕皮前期(D2期)Fig.6 Premolt stage (D2) of M.rosenbergii during the molt cycle

图7 罗氏沼虾的蜕皮前期(D3期)Fig.7 Premolt stage (D3) of M.rosenbergii during the molt cycle
2.1.4 蜕皮期 (E期)
罗氏沼虾的蜕皮过程大多在夜间进行[11]。虾从蜕皮前期(D期)摄食量开始减少,罗氏沼虾在蜕皮时一般处于静止状态,有时会前后左右晃动。蜕皮时,头胸甲和腹部结合处裂开,新生的头胸甲从裂缝中脱出,然后通过有力的跳动将头部从旧壳蜕出。罗氏沼虾的整个蜕皮过程一般在数分钟内结束。蜕皮后,罗氏沼虾的新生虾体柔软,大概十几个小时不能正常游泳和爬行,仅可以弹跳,此时非常容易受到同类或其它敌害的伤害(图8)。

图8 罗氏沼虾蜕皮期(E期)蜕下的外骨骼Fig.8 The exoskeleton of M.rosenbergii during the molt stage (E)
2.2 蜕皮频率对罗氏沼虾生长速度的影响
罗氏沼虾不同生长速度群体的蜕皮频率见表3。140日龄生长缓慢组(E1)、140日龄正常生长组(C1)和80日龄正常生长组(C2)的蜕皮频率分别为0.089 2,0.074 2和0.123 7,其中不同日龄、不同规格的两个正常生长组(C1和C2)之间差异显著(P<0.05),其他组间差异不显著。C1组和C2组的比较表明,随着生长时间的增加和样品规格的增大,罗氏沼虾蜕皮频率显著降低,即蜕皮周期延长,说明罗氏沼虾的蜕皮周期受个体年龄和规格的影响;E1和C2组的比较表明,规格相同,生长时间和生长速度不同的群体中,生长速度较慢的群体的蜕皮频率较小(蜕皮周期较长),两者之间的差异可能受年龄的影响;E1和C1组的比较表明,生长时间相同,生长速度不同的群体间的蜕皮频率相差不大,生长缓慢组的蜕皮频率虽略高于正常生长群体,这可能与个体规格差异有关。综上,罗氏沼虾的蜕皮频率(蜕皮周期)受年龄和个体规格因素的影响,蜕皮频率对罗氏沼虾生长的影响不显著,蜕皮频率可能并不是导致罗氏沼虾生长缓慢的主要原因。
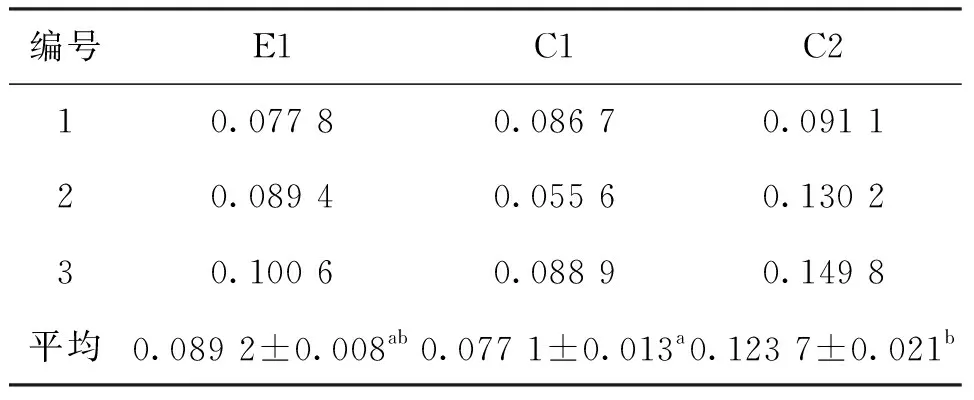
表3 生长缓慢的罗氏沼虾与正常生长的罗氏沼虾蜕皮频率的比较Tab.3 The comparison of molting frequency between slow-growth and the normal-growth M.rosenbergii
注:E1:140日龄生长缓慢组;C1:140日龄正常生长组;C2:80日龄正常生长组;a/b:显著性检验(字母不同表示差异显著(P<0.05)).
3 讨论
3.1 罗氏沼虾蜕皮周期的划分
甲壳类蜕皮周期的准确划分是研究蜕皮调节机制和开展生产实践的基础。不同物种中,蜕皮周期的划分依据有相似点,也有物种特有的结构特征。例如Turnbull[12]依据刚毛发育情况、表皮收缩和内陷程度将锦绣龙虾(Panulirusornatus)蜕皮周期分成 A、B、C、D0、D1′、D1″和D2等7 个时期;Moriyasu等[13]依据小颚内肢基部表皮回缩和新生刚毛进入管鞘程度将雪蟹(Chionoecetesopilio)蜕皮周期分为蜕皮后期、蜕皮间期和蜕皮前期,其中蜕皮前期又细分为D0、D1和D3-4三个亚期;沈洁等[2]依据游泳足趾节末端新旧表皮基线间距/旧表皮厚度的比值(R值),将三疣梭子蟹(Portunustrituberculatus)的蜕皮前期细分为D0期(0 蜕皮是甲壳动物生长的基础,伴随着蜕皮,甲壳动物的体重在较短时间内实现一次跨越式增长[14],而在蜕皮之后至下一次蜕皮前,体重几乎很少增加[15-16],因此探索蜕皮频率对生长速度的影响,对于生产实践具有重要意义,然而,影响甲壳动物蜕皮的因素很多,如个体的年龄[17]、规格以及各种外源因子[18-19]、光照、盐度、钙离子[20]、饵料与污染物等都会影响蜕皮频率,因此本研究分别选取了与实验组相同规格和相同年龄的罗氏沼虾群体作为对照组,并将所有实验样品饲养于相同的环境中,尽量避免了外源因子的干扰,确保了实验的准确性。本研究的结果表明,蜕皮频率并没有显著影响罗氏沼虾的生长,推测蜕皮频率可能并不是导致罗氏沼虾生长缓慢的主要原因,这一结果与刘志冲等人的研究结果一致,刘志冲等人发现,饵料中加入β-蜕皮激素只能促进罗氏沼虾的蜕皮,对生长没有显著的促进作用[21]。然而,黄凯等[22]的研究发现较低的蜕皮率会限制罗氏沼虾的生长速度。陈树桥等[23]在克氏原螯虾(Procambarusclarkii)的研究中发现,饲料中添加适量蜕皮激素提高克氏原螯虾(P.clarkii)幼虾的蜕皮频率,并对其体长和体重增加起到显著促进作用(P<0.05);罗日祥等[24]在中国对虾(Penaeusorientals)的研究中也发现,饵料中添加β-蜕皮激素和水龙骨素B的混合物有助于对虾的蜕皮和生长。不同的研究结果表明,蜕皮频率对甲壳动物生长速度的影响需要后期更为深入的研究。 除蜕皮频率外,甲壳动物的生长与每次蜕皮时体长与体重的增加程度有关。黄国强[15]在中国对虾稚虾的研究中发现,在较低的摄食水平下,中国对虾可以正常蜕皮,但每次蜕皮体重增长极低甚至出现负增长,说明蜕皮只为对虾的身体生长提供机会,充足的饵料供应和优良营养条件等其他因素对生长速度影响重大。本研究实验组中的罗氏沼虾来源于同一池塘,其饵料供应及外界条件相似,但却出现了较大的生长差异,说明除饵料和营养条件外,还有其他的因素影响罗氏沼虾生长。罗氏沼虾生长缓慢的现象已严重影响经济效益,然而引起该现象的原因尚未查明,目前仅有少数学者对其进行探究:董学洪等[9]对生长缓慢的罗氏沼虾进行研究,认为饵料营养不足、水质条件较差以及苗种质量等原因可导致罗氏沼虾生长缓慢;安振华等[25]则认为幼体营养不足和养殖过程滥用抗生素可能是导致罗氏沼虾生长缓慢的因素;本研究以蜕皮频率为切入点进行分析,为揭示罗氏沼虾生长缓慢现象提供了新的视角。然而,罗氏沼虾生长缓慢现象产生原因较为复杂,探索该现象发生的原因并寻求相应的解决方法将有利于罗氏沼虾产业的健康持续发展。3.2 罗氏沼虾蜕皮对生长的影响分析

