不同基因型草鱼呼肠孤病毒通用RT-PCR检测方法的建立及应用
范玉顶,马 杰,周 勇,江 南,刘文枝,曾令兵
(1.中国水产科学研究院长江水产研究所,武汉 430223;2.爱达荷大学水产研究所鱼类与野生动物科学系,莫斯科 83844-1136,美国)
草鱼呼肠孤病毒(grass carp reovirus,GCRV)属于呼肠孤病毒科(Reoviridae)水生呼肠孤病毒属(Aquareovirus)成员,是我国分离的第一株鱼类病毒[1]。目前我国已报道的GCRV分离株有30多个[2-9],根据基因序列差异可分为3个基因型:GCRV I、Ⅱ和Ⅲ型,其代表株分别为GCRV-873、GCRV-HZ08和HGDRV(原名GCRV104)[10,11]。
鉴于草鱼出血病对我国草鱼养殖业的巨大危害以及不同基因型GCRV分离株序列间的较大差异,国内外学者已建立了多种针对不同基因型GCRV的检测方法[12-25]。但这些检测方法大都针对特定基因型GCRV的某个节段设计特异性引物,所以一次反应只能检测一种基因型的GCRV。要想覆盖目前三种基因型的GCRV,需要设计多对引物或多个反应才能完成,使得检测时间延长,检测成本增加。Zeng等[12]于2013年建立了GCRV的三重PCR检测法,该方法针对三种基因型GCRV分别设计了三对特异性引物,一次PCR反应就可以检测三种基因型GCRV,大大提高了检测效率。但近几年陆续又有在多地鉴定到GCRV不同分离株的报道,而且有些新分离株在基因序列上与现有分离株存在着较大差异,所以综合分析现有的GCRV分离株序列,建立一种简单快速、可适用不同基因型GCRV的通用RT-PCR检测方法就显得尤为必要。
草鱼呼肠孤病毒S2节段编码的VP2蛋白是一种RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase,RdRp),被认为是呼肠孤病毒科所有病毒蛋白中最保守的蛋白,也是该病毒科不同病毒属在分子进化水平上进行划分的标准蛋白;同一属的呼肠孤病毒在该蛋白上的相似性>30%,水生呼肠孤病毒属中同种病毒该蛋白的相似性一般>95%[26]。在前期研究中也发现,草鱼呼肠孤病毒I~Ⅲ型毒株编码的所有蛋白中,VP2蛋白的相似性最高,在44%~46%之间[4]。鉴于VP2蛋白在不同基因型草鱼呼肠孤病毒间高度保守性,本研究根据GenBank登录的草鱼呼肠孤病毒S2节段,通过多序列比对分析,在保守区设计一对简并引物,以期建立一种利用一对引物、一次PCR反应就能同时检测三种基因型GCRV的通用RT-PCR 检测新方法,并对该方法的反应条件进行优化,测试方法的特异性、灵敏性以及在临床样品检测中的可靠性,为草鱼出血病的快速诊断及流行病学调查提供技术支撑。
1 材料和方法
1.1 实验用病毒
GCRV-GZ1208(I型)由中国水产科学研究院珠江水产研究所惠赠,GCRV106(Ⅱ型)、GCRV918(Ⅱ型)、GCRV-HeNan988(Ⅱ型)、HGDRV(Ⅲ型)、斑点叉尾鮰呼肠孤病毒(CCRV)、大鲵虹彩病毒(GSIV)、锦鲤疱疹病毒(KHV)、鲤疱疹病毒Ⅱ型(CyHV-2)、鲤春病毒血症病毒(SVCV)和传染性脾肾坏死病毒(ISKNV)均由本实验室分离并保存。
1.2 核酸提取
采用实验室已建立的方法进行病毒核酸的提取[20],即收集病毒感染的细胞,在-80 ℃和室温条件下反复冻融3次,4 000 r/min 离心30 min(Sigma,3K-15),将上清转移至35 mL 超速离心管中,20 000 r/min 离心2 h(Optima L-80XP,Beckman-Coulter),悬浮病毒沉淀备用。RNA病毒和DNA病毒核酸分别用Invitrogen公司的Trizol和DNAzol试剂进行提取,具体操作按试剂说明书进行。提取的病毒RNA和DNA分别保存在-80 ℃和-20 ℃冰箱备用。对于采集的草鱼出血病疑似样品核酸提取,参考实验室已建立的样品处理方法[27],即收集病鱼的肝、脾、肾等内脏组织于无菌培养皿中,用无菌眼科剪剪碎,加入10倍体积(V/W)的DPBS(Sigma)转入玻璃均化器内并在冰浴下研磨成组织匀浆液,其他步骤同上。
1.3 引物设计
GenBank中含有S2节段全长的GCRV毒株共13株,其中Ⅰ型2株、Ⅱ型10株、Ⅲ型1株。具体毒株及S2节段Genbank序列号如下:GCRV-873(I型,AF284502.1)、GCRV- GZ1208(Ⅰ型,KU240075.1)、GCRV-HZ08(Ⅱ型,GQ896335.1)、GCRV-GD108(Ⅱ型,HQ231199.1)、GCRV106(Ⅱ型,KC201167.1)、GCRV918(Ⅱ型,KC201178.1)、GCRV-JX02(Ⅱ型,KM880066.1)、GCRV-HuNan794(Ⅱ型,KC238677.1)、GCRV- Huan1307(Ⅱ型,KU254567.1)、GCRV-AH528(Ⅱ型,KR180369.1)、GCRV-HeNan988(Ⅱ型,KC847321.1)、GCReV109(Ⅱ型,KF712476.1)、GCRV104(Ⅲ型,JN967630.1)。用CLUSTAL W进行S2节段多序列比较分析,在保守区设计一对简并引物GCRV-F/GCRV-R;同时针对本实验中用到的3株I~Ⅲ型GCRV分离株,在相同的S2节段保守区分别设计3对特异性引物(表1)。引物由武汉天一辉远生物科技有限公司合成,引物信息见表1。
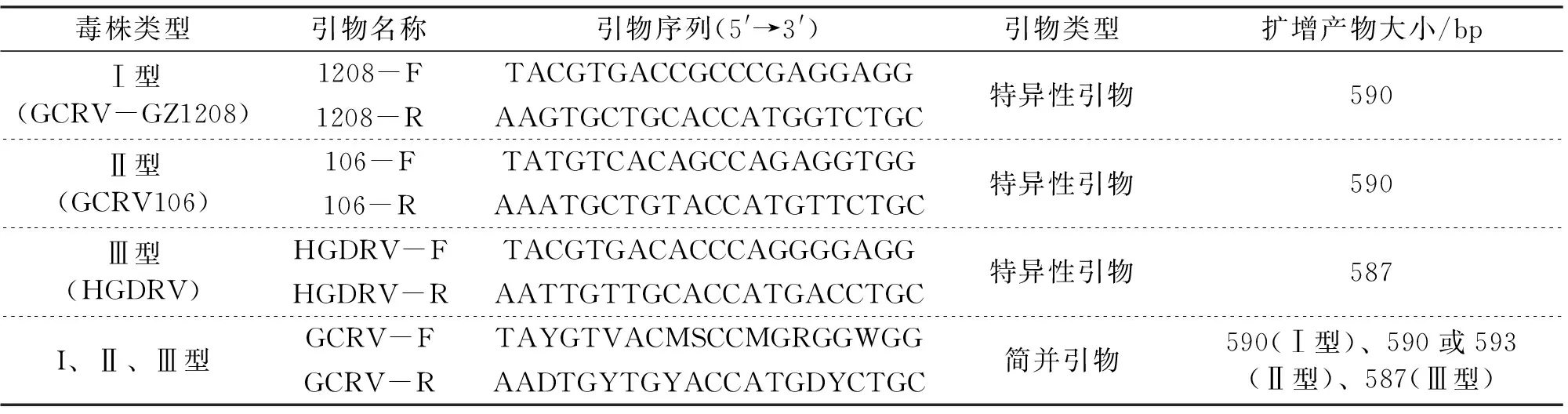
表1 本研究所用引物信息
注:R= A/G;S=C/G;Y=C/T;D=A/G/T;M=A/C;W=A/T;V=A/G/C.
1.4 通用RT-PCR 扩增条件优化
使用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit 反转录试剂盒(TaKaRa,大连)合成cDNA模板,反转录引物为 Random 6 mers (50 μmol/L) 1μL,病毒RNA 8 μL,总体系20 μL,具体操作按说明书进行。PCR反应相关试剂均来自大连TaKaRa公司,其中使用的DNA聚合酶为TaKaRa Ex Taq®,总体系50 μL,包括:5 μL反转录产物,5 μL 10×Ex Taq Buffer (Mg2+Plus) (20 mmol/L),4 μL dNTP Mixture (各2.5 mmol/L),上、下游简并引物各1 μL,0.25 μL TaKaRa Ex Taq (5 U/μL),用超纯水补齐至50 μL。其中上、下游简并引物分别稀释至10、20、30、40、50和60 μmol/L等6个工作浓度(对应的50 μL PCR反应体系中,上、下游引物终浓度分别为0.2、0.4、0.6、0.8、1和1.2 μmol/L)以试验最佳引物浓度。PCR反应参数按常规程序设置,共35个循环,使用梯度PCR仪(Biometra TProfessional standard gradient thermocycler,Germany)设置51、53.2、55.6、58和60 ℃等5个温度梯度以试验最佳退火温度。反应结束后,取5 μL PCR产物用1%琼脂糖凝胶电泳检测,确定最佳PCR条件。
1.5 灵敏度试验
分别以GCRV-GZ1208(Ⅰ型)、GCRV106(Ⅱ型)和HGDRV(Ⅲ型)的cDNA为模板,利用表1中VP2基因的特异性引物进行PCR,扩增产物经胶回收纯化后与pGEM-T easy克隆载体连接,构建三种基因型VP2的重组质粒。对重组质粒用EcoRI进行酶切鉴定,并送天一辉远生物科技有限公司测序。用分光光度计测定三种重组质粒的浓度,参考文献[20]的方法计算出质粒拷贝数:
质粒拷贝数(个/mL)=DNA质量浓度/DNA相对分子质量
其中:DNA质量浓度=260 nm吸光度×稀释倍数×6.02×1023;
DNA相对分子质量=DNA碱基数×324.5。
用超纯水将重组质粒进行10倍梯度连续稀释,使其浓度依次为109~101拷贝/μL。以梯度稀释的质粒做模板,结合前面研究获得的最佳RT-PCR 条件,使用简并引物进行PCR扩增,探讨该方法的最低检测限。
1.6 特异性试验
使用本方法检测GSIV、KHV、CyHV-2、SVCV、ISKNV和CCRV等其他鱼类常见病毒,以及本实验室保存的草鱼呼肠孤病毒GCRV-GZ1208、GCRV106、GCRV918、GCRV-HeNan988和HGDRV,分析本方法检测的特异性。其中GSIV、KHV、CyHV-2等DNA病毒核酸不需要反转录,直接用于PCR扩增;而SVCV、ISKNV、CCRV和GCRV等RNA病毒核酸要先进行反转录,然后以cDNA为模板进行PCR扩增。
1.7 临床样品检测及鉴定
利用建立的通用RT-PCR检测方法,对本实验室于2015—2017年从湖北、江苏、浙江、广东等草鱼主养区采集并保存的49份草鱼出血病疑似样品进行检测,对于检测结果为阳性的样品通过TA克隆,每个样品挑选8~10个阳性克隆测序,通过测序结果比对分析做进一步的毒株基因型鉴定,以此来判断样品的感染类型(单独感染、混合感染)。
2 结果
2.1 GCRV S2节段保守区序列比对及简并引物设计
通过13株GCRV分离株S2全长节段的多序列比对分析,发现一段长约590 bp序列在三种基因型GCRV中相对保守,尤其是在Ⅱ型的10株GCRV中这段序列保守性最高,只存在个别碱基的差异(图1)。选取这段序列两端最保守的位置设计一对简并引物,从图中可以看出,这对引物在I、Ⅲ型GCRV中扩增片段的预计长度分别为590 bp和587 bp,而在Ⅱ型GCRV中,除了GCRV-HZ08中扩增长度为593 bp外,其余均为590 bp(图1)。

图1 不同基因型草鱼呼肠孤病毒S2节段保守区序列比对分析Fig.1 Multiple alignment of conserved nucleotide sequences of segment 2 from different genotype strains of GCRV“·”表示相同的核苷酸位点,“-”表示此位点为空格,方框部分为设计的简并引物位置
2.2 GCRV S2保守区序列PCR扩增及重组质粒构建
分别以GCRV-GZ1208(Ⅰ型)、GCRV106(Ⅱ型)和HGDRV(Ⅲ型)的cDNA为模板,简并引物和特异性引物PCR扩增结果完全一致,均得到了约590 bp的特异性条带(图2)。将简并引物扩增得到的PCR产物克隆进pGEM-T easy载体,得到三种基因型GCRV的重组质粒(pGEM-1208、pGEM-106和pGEM-HGDRV)并用EcoRⅠ单酶切鉴定,酶切结果显示均得到了大小约590 bp的插入片段,与预期大小一致,表明目的基因片段已正确插入到pGEM-T easy载体中(图3)。重组质粒测序结果进一步证实,扩增得到的目的基因片段与GenBank公布的相应毒株参考序列的相似性达99%。
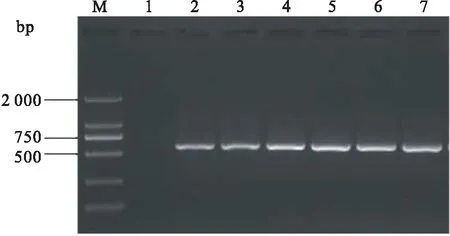
图2 GCRV 的RT-PCR扩增电泳图Fig.2 Amplification results of GCRV by RT-PCR assayM:DL2 000 bp marker;1:未加模板的阴性对照;2和5:GCRV-GZ1208(Ⅰ型);3和6:GCRV106(Ⅱ型);4和7:HGDRV(Ⅲ型);1~4:简并引物扩增结果;5~6:特异性引物扩增结果
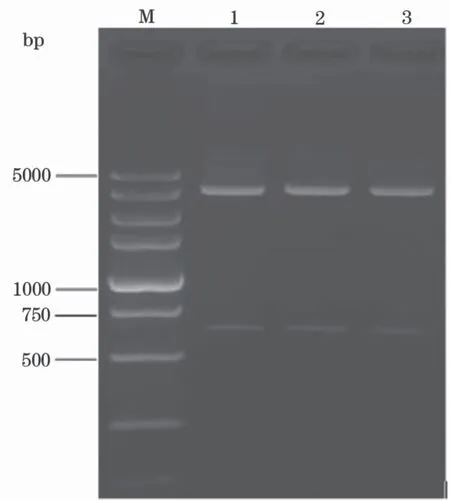
图3 GCRV重组质粒的EcoR Ⅰ酶切鉴定Fig.3 Restriction analysis of GCRV plasmids afterEcoR Ⅰ digestionM:DL5 000 bp marker;1:pGEM-1208质粒;2:pGEM-106质粒;3:pGEM-HGDRV质粒
2.3 通用RT-PCR 扩增条件优化
试验的5个退火温度(51、53.2、55.6、58和60 ℃)在三种基因型GCRV cDNA模板中的扩增效果基本一致,选取最高的60 ℃作为后续试验的退火温度。分光光度计测得重组质粒pGEM-1208、pGEM-106和pGEM-HGDRV浓度分别为150、100和150 ng/μL,计算出质粒拷贝数依次为3.8×1010、2.5×1010和3.8×1010拷贝/μL。选取109、107、105、103拷贝/μL等 4个10倍梯度稀释的质粒为模板,试验6个简并引物浓度(10、20、30、40、50和60 μmol/L)的扩增效果。结果显示(以pGEM-106质粒为例):当质粒浓度较高时(如109
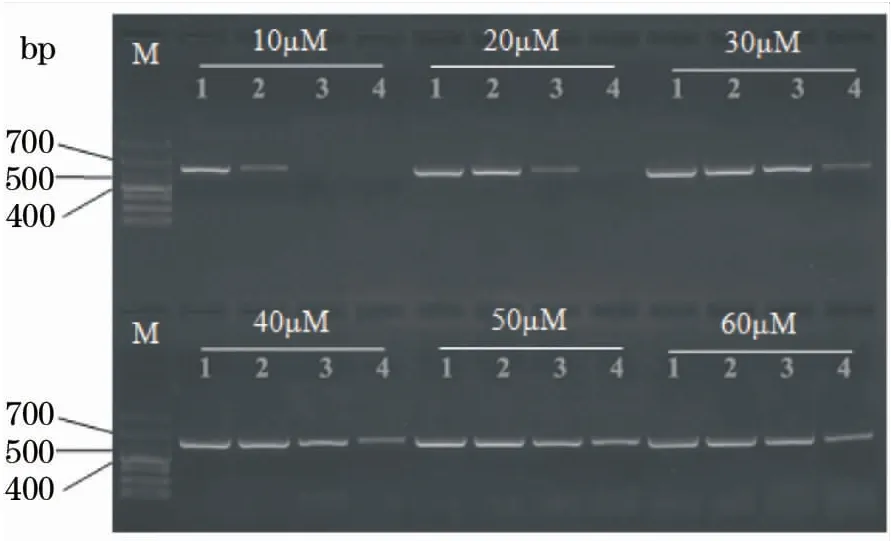
图4 不同简并引物浓度的RT-PCR在GCRV106中扩增电泳图Fig.4 Amplification results of GCRV106 by RT-PCR assay with different concentration of degenerate primersM:DL1 000 bp marker;1:模板浓度为2.5×109拷贝/μL;2:模板浓度为2.5×107拷贝/μL;3:模板浓度为2.5×105拷贝/μL;4:模板浓度为2.5×103拷贝/μL
拷贝/μL),不同浓度引物扩增均可得到较亮的目的条带;而当质粒浓度较低时(如103拷贝/μL),低浓度引物扩增没有条带或条带很弱;引物浓度越高,在低浓度质粒中的扩增效果越好(图4)。当简并引物浓度为50 μmol/L和60 μmol/L时在四种浓度质粒中的扩增效果基本一致,故选取50 μmol/L作为PCR反应的最佳引物浓度(图4)。其他两种质粒的扩增结果与pGEM-106结果一致。
2.4 通用RT-PCR灵敏度和特异性试验结果
根据以上最佳PCR扩增条件优化结果,使用95 ℃ 5 min 预变性,94 ℃ 30 s,60 ℃ 40 s,72 ℃ 40 s,35个循环,72 ℃延伸10 min的PCR 条件;当质粒稀释到102拷贝/μL时,在三种基因型GCRV模板中仍可扩增出相对较弱的特异性目的条带(图5)。即本方法对Ⅰ型、Ⅱ型、Ⅲ型GCRV核酸的最低检测限分别为380、250和380个拷贝数。以三种基因型草鱼呼肠孤病毒以及斑点叉尾鮰呼肠孤病毒(CCRV)的cDNA为模板均可以扩增得到预期大小的目的条带,而以GSIV、KHV、CyHV-2、SVCV和ISKNV等其他鱼类常见病毒核酸或反转录产物为模板均不能扩增出任何条带(图6)。

图5 RT-PCR灵敏度试验Fig.5 Sensitivity assay of the RT-PCR M:DL1 000 bp marker;1~9:质粒拷贝数分别为109~101 copies/μL;10:未加模板的阴性对照
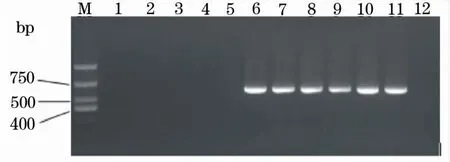
图6 RT-PCR特异性试验Fig.6 Specificity assay of the RT-PCR M:DL1 000 bp marker;1~5:分别以GSIV、KHV、CyHV-2、SVCV和ISKNV的核酸或反转录产物为模板;6~11:分别以GCRV-GZ1208、GCRV106、GCRV918、GCRV-HeNan988、HGDRV和CCRV的反转录产物cDNA为模板;12:未加模板的阴性对照
2.5 临床样品检测及鉴定结果
初步应用建立的通用RT-PCR检测方法,对2015—2017年从湖北、江苏、浙江、广东等草鱼主养区采集的49份草鱼出血病疑似样品进行检测。PCR产物电泳结果显示,49份样品全部为阳性(图7为部分样品的检测结果),进一步测序结果显示,Ⅰ型阳性样品有4份,阳性率为8.2%;Ⅱ型阳性样品有42份,阳性率为85.7%;Ⅲ型阳性样品有1份,阳性率为2%;I、Ⅱ型混合感染阳性样品有2份,阳性率为4.1%;其他类型的混合感染未检测到。Blast结果表明,与GenBank已有毒株的序列相似性在98%以上。
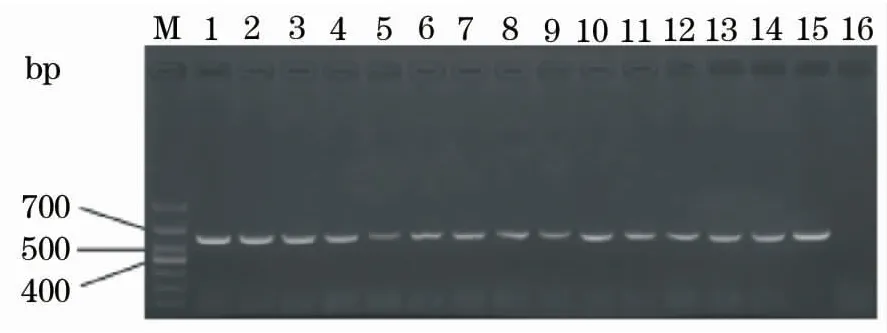
图7 部分临床样品RT-PCR检测结果Fig.7 Results of detection by RT-PCR for partial suspected grass carp hemorrhagic samplesM:DL1 000 bp marker;1~15:分别以从湖北、江苏、浙江、广东等地采集的15份草鱼出血病疑似样品RNA反转录产物cDNA为模板;16:未加模板的阴性对照
3 讨论
由草鱼呼肠孤病毒(GCRV)引起的草鱼出血病是一种严重的病毒性疾病,每年都会给我国草鱼养殖业造成巨大损失,严重影响水产行业的健康发展[10]。简单有效的GCRV检测方法对于该病的有效防控具有重要意义。目前,研究学者已建立了多种GCRV的检测方法,如传统的细胞培养、电镜观察、SDS-PAGE等经典的检测方法,但这些方法比较费时费力。随着生物技术的快速发展,近年来很多学者建立了新的GCRV检测方法,如real-time PCR[17-20]、RT-LAMP[21]、dsRNA测序法[22]、单克隆抗体检测[23]、Western blot[24]以及曾伟伟等最近报道的NASBA-ELISA法[25],这些方法具有灵敏度高、特异性强等优点,但大都存在操作复杂、周期长、依赖昂贵仪器设备以及成本较高的缺点。RT-PCR由于具有灵敏、特异、简单、高效等优点在GCRV检测中得到了广泛应用[12-16],但这些RT-PCR检测方法中所用引物都是针对某种基因型GCRV的某个节段所设计的基因特异性引物,在不同基因型GCRV中不具有通用性。Seng等根据多种呼肠孤病毒S6节段设计了一对简并引物可同时检测多种水生呼肠孤病毒[16],但通过我们前期研究发现,这对引物仅适用于Ⅰ型GCRV检测,在Ⅱ型、Ⅲ型GCRV中扩增不出预期条带。因此,我们尝试设计一对通用的引物,通过一次RT-PCR反应就可以同时检测三种基因型草鱼呼肠孤病毒,从而达到简化试验操作、提高检测效率和降低检测成本的目的。
由于S2节段编码的VP2蛋白是目前不同基因型草鱼呼肠孤病毒中最保守的蛋白[4],所以我们根据GenBank中可查询到的13株GCRV毒株S2节段的多序列比对分析,对于所用引物中的非保守核苷酸位点采用了简并碱基表示,在其保守区设计一对简并引物,建立一种可同时检测三种基因型GCRV的通用RT-PCR检测方法。在前期预实验中,我们共设计了4对简并引物,综合考虑引物的简并性、特异性和扩增效果等因素,最终筛选到本试验所用的这对最佳引物组合。退火温度是影响PCR扩增特异性的一个重要因素,本试验中的5个退火温度扩增效果基本一致,由于较高的退火温度可以减少非特异性带的产生[12],故选取其中最高的60 ℃作为通用RT-PCR的最佳退火温度。引物浓度是影响扩增效率的重要因素;本研究发现,当模板浓度较低时,较低的引物浓度扩增条带很弱甚至没有条带,而随着引物浓度升高,扩增条带越来越亮(图4);本试验选定的最佳引物浓度是50 μmol/L(对应的PCR反应中引物终浓度为1 μmol/L),略高于曾伟伟等[12]和郝贵杰等[13]所建立的检测方法中引物浓度。因此,通过条件优化,本研究建立的通用RT-PCR的最佳退火温度和引物浓度分别是60 ℃和50 μmol/L。
本研究建立的检测方法对Ⅰ型、Ⅱ型、Ⅲ型GCRV核酸的最低检测限分别为380、250和380个拷贝数,这一结果与曾伟伟等[12]三重PCR检测方法中260、190和230个拷贝数的检测限基本一致;王晓丰等[14]针对Ⅱ型GCRV建立的检测方法其最低检测限为180个拷贝数,也与本研究结果基本一致。采集的草鱼出血病临床样品病毒含量一般都在500拷贝/μL以上[12],表明该方法的灵敏度可以满足临床样品检测的要求。在已建立的GCRV荧光定量PCR检测方法中,殷亮等[18]建立的Ⅰ型GCRV-JX0901 TaqMan Real-TimePCR检测方法可检测到4拷贝/μL;刘宝芹等[19]建立的Ⅱ型GCRV-HZ08的 FQ-PCR 检测方法可检测到6拷贝/μL;曾伟伟等[17]针对Ⅰ型、Ⅱ型GCRV以及周勇等[20]针对Ⅲ型GCRV建立的Real-Time PCR检测方法的最低检测限均为10拷贝/μL。与荧光定量PCR相比,本研究建立的RT-PCR检测方法灵敏度要显著低于前者,尽管质粒模板稀释到102拷贝/μL时仍可以检测到三种基因型GCRV,但扩增的条带相对较弱(图5)。对于病毒含量较低的临床样品,可能会出现检测的假阴性或漏检的情况,为此本试验在样品核酸提取步骤中,采取了超速离心浓缩病毒核酸的处理方式,通过提高病毒含量来尽可能减少假阴性的产生。此外,下一步考虑结合灵敏度更高的荧光定量PCR进行进一步的确认,或在现有简并引物的内部设计一条或两条简并内引物,通过巢式或半巢式PCR进一步提高该方法检测的灵敏度。
我们前期从患病的斑点叉尾鮰中分离鉴定出了斑点叉尾鮰呼肠孤病毒(CCRV),该病毒基因组SDS-PAGE带型分布特征与Ⅰ型 GCRV873株高度一致,且二者S4节段的相似性高达99%[27]。在特异性试验中,本方法除了能够扩增GCRV-GZ1208(Ⅰ型)、GCRV106(Ⅱ型)、GCRV918(Ⅱ型)、GCRV-HeNan988(Ⅱ型)和HGDRV(Ⅲ型)等不同基因型草鱼呼肠孤病毒外,在CCRV中也扩增出了同样大小的预期特异性条带(图6),这与前期研究中CCRV与GCRV873高度同源的结论是一致的;但不能扩增GSIV、KHV、CyHV-2、SVCV和ISKNV等其他鱼类常见病毒,表明该方法具有良好的特异性。此外,应用本方法仅对本研究室保存的GCRV毒株进行了特异性验证,该方法在其他GCRV分离株中的适用性还有待于进一步验证。
利用建立的通用RT-PCR对采集自全国草鱼主养区的49份草鱼出血病疑似样品进行检测,结合阳性克隆的测序鉴定,结果显示全部为GCRV 阳性,而且Ⅱ型所占比例高达85.7%,Ⅰ型和Ⅲ型的比例分别为8.2%和2%,这与前人研究中Ⅱ型草鱼呼肠孤病毒是目前主要流行株的结论是一致的[2,5,10,12]。曾伟伟等[12]通过86 份草鱼出血病样品流行病学分析,发现I、Ⅱ型和Ⅱ、Ⅲ型混合感染的阳性率分别为5.8%和2.3%,本研究仅检出了I、Ⅱ型混合感染样品,阳性率为4.1%,没有检测出其他类型混合感染样品,这可能是由于所检测样品本身的差异或不同检测方法的灵敏度差异造成的,也可能与本试验中检测的临床样品数量偏少、测序的阳性克隆数不多等因素有关。
总之,本研究基于简并引物建立了一种新的草鱼呼肠孤病毒 RT-PCR检测方法,该方法只需一对引物、一次PCR反应就可以同时检测三种基因型GCRV,具有通用性好、省时高效的显著特点;同时还兼具较高的灵敏度和特异性。需要指出的是,由于该方法在三种基因型GCRV中扩增的条带大小基本一致(587 bp、590 bp和593 bp),所以无法通过琼脂糖凝胶电泳区分GCRV基因型,只适合草鱼出血病样品的定性分析。GCRV基因型的确定需要通过后续的PCR产物克隆测序分析或结合曾伟伟等[12]建立的三重PCR法进行判定。因此本研究建立的通用RT-PCR检测方法是对现有GCRV检测方法的一个有益补充,可在草鱼出血病临床样品的快速诊断及流行病学调查中发挥重要作用。
——一道江苏高考题的奥秘解读和拓展

