日本医蛭水肿病病原分离鉴定及敏感性试验
董 靖,刘永涛,胥 宁,宋 怿,鄢志红,杨秋红,杨移斌,艾晓辉
(1.中国水产科学研究院长江水产研究所,武汉430223;2.中国水产科学研究院,北京100039;3.荆州市天佳饲料有限公司,荆州434100)
水蛭(WhitmaniapigraWhitman)是传统中药,具有广泛的药理学活性,除了抗凝、抗血栓活性以外,近来年研究发现,水蛭还具有抗炎、抗肿瘤和抗纤维化等作用,在预防和治疗多种疾病过程中均发挥了重要作用[1]。近年来水蛭作为药材在国内外医药领域的需求量较大,但由于过度捕捞和环境污染等原因导致野生水蛭资源锐减,因此水蛭养殖成为近年来的新兴养殖品种,具有广阔的市场前景[2]。日本医蛭是我国药典收录的水蛭品种,具有极强的抗凝血活性,是目前较为常见的养殖品种之一。随着近年来水蛭养殖规模和养殖密度的不断扩大,其病害也时有发生,一旦发病给养殖户造成严重的经济损失。但目前国内外对水蛭病害研究和防治鲜有报道,仅有部分国内研究人员报道过菲牛蛭和宽体金钱蛭病原分离及中西药物筛选,而日本医蛭病原及其防治方法研究目前未见报道[3-5]。
维氏气单胞菌(Aeromonasveronii)是一种常见的条件性致病菌,也是一种新的人兽鱼共患病原菌,能够引起陆生动物、鱼和人的多种不同程度的感染[6],人在接触该菌感染的病鱼后较易引起感染,对人类的健康和水产品质量安全有潜在的危害。近年来随着水产养殖业集约化程度的提高,维氏气单胞菌感染养殖鱼类的报道也逐渐增多,包括团头鲂(Megalobramaamblycephala)、台湾泥鳅(Paramisgurnussp.)、鳜(Sinipercachuatsi)、斑点叉尾鮰(IetalurusPunetaus)等常见养殖品种,一旦感染会造成鱼类的大量死亡,极大地威胁了水产养殖业的健康发展[7-10]。
2015年6月湖北省荆州市某水蛭养殖场的日本医蛭发生死亡,患病水蛭主要表现为为胸腹部肌肉肿胀和结节,反应迟缓,进食停止等症状,经检查无寄生虫感染,死亡率较高。本试验以患病日本医蛭病原菌为研究对象,经细菌分离、回归感染、生理生化鉴定和分子生物学鉴定确定该病原为维氏气单胞菌。进一步检测了该菌株对常见抗菌药物的敏感性以及恩诺沙星与天然化合物的协同用药研究,为水蛭养殖过程中维氏气单胞菌感染的科学治疗提供依据。
1 材料与方法
1.1 试验材料与试剂
患病日本医蛭采自湖北省荆州市某养殖场;回归试验用的日本医蛭来自周边未发病的养殖场;药敏纸片购自杭州微生物试剂有限公司;脑心浸液培养基购自青岛海博生物公司;细菌基因组提取试剂盒、PCR Master Mix购自北京天根生化公司;恩诺沙星、天然化合物标准品购自中国食品药品检定研究院,恩诺沙星和天然化合物分别溶于稀醋酸和DMSO制备成储存液。
1.2 细菌分离与培养
取患病水蛭在无菌条件下用无菌生理盐水冲洗表面3~5次,在肿胀、结节部位剖取肌肉,用无菌玻璃匀浆器匀浆后用接种环接种至脑心浸液肉汤(BHI)培养基,在30 ℃培养16~18 h。挑取疑似菌落纯化3次,将纯化的细菌标记为JZ15062301在BHI培养18 h后加入30%的无菌甘油,-80 ℃冰箱中保存备用。
1.3 回归感染试验
在无菌工作台中挑取JZ15062301单菌落至BHI液体培养基中培养过夜以复苏菌种,然后在无菌条件下按照麦氏比浊法用无菌生理盐水将菌液稀释为1.5×108、1.5×107、1.5×106、1.5×105CFU/mL四个不同的浓度梯度。每个试验组20条健康日本医蛭,背部注射不同浓度菌液,阴性对照组注射无菌生理盐水[4]。试验用日本医蛭养殖在50 L玻璃水族箱中,水温保持在23~25 ℃;气石充气,溶解氧保持在5.5~7.5 mg/L;每天更换50%(体积)的水,不投喂饲料。观察并记录水蛭的死亡情况,移除死亡水蛭,计算其半数致死浓度(LC50)。对出现同天然发病类似症状的水蛭按照1.2的方法进行细菌分离。
1.4 致病菌株生理生化鉴定
取纯化的JZ15062301单菌落接种于BHI液体培养基中,30 ℃恒温培养18~24 h后观察菌落形态特征并进行革兰氏染色,用光学显微镜观察细菌的形态特征。将单菌落接种于BHI液体培养基培养至对数生长期,10 000g离心取菌体用无菌生理盐水稀释后接种于生化鉴定管,参照《常见细菌系统鉴定手册》的方法进行生化鉴定[11]。
1.5 致病菌株的分子生物学鉴定
按照细菌基因组提取试剂盒的操作说明来提取菌株JZ15062301的全基因组,使用16s rRNA通用引物扩增目的基因,PCR产物经琼脂糖凝胶电泳鉴定后送至上海生工生物公司进行序列测定并用BLAST软件对测序结果进行同源性比对。采用MEGA5.1软件以Neighbor-Joining法构建进化树,校正模型为Kimura 2-parameter,Bootstraps法检测1 000次。
1.6 药物敏感性试验
1.6.1 K-B法测定致病菌对常用抗菌药物的敏感性
在无菌条件下挑取单菌落接种至BHI液体培养基中,在30 ℃条件下振荡培养6~8 h。培养好的菌液离心(5 000g,4 ℃)5 min,将上清弃去后用无菌生理盐水将菌体重悬并用麦氏比浊管将菌液浓度调整至1.5×108CFU/mL。将菌液均匀地涂布在MH固体培养基上,30 ℃继续培养18~24 h后测定抑菌圈直径。敏感性参照杭州微生物试剂有限公司提供的标准进行判定。
1.6.2 肉汤微量稀释法测定恩诺沙星和天然化合物的最小抑菌浓度
采用CLSI推荐肉汤微量稀释法测定了抗菌药物和天然化合物的最小抑菌浓度(MICs)[12]。将受试药物在无菌96孔细胞培养板中倍比稀释,使每孔中药物的体积为100 μL。菌液用麦氏比浊管调整至0.5麦氏单位后稀释150倍,加入100 μL菌悬液使其在每孔中的终浓度为5×105CFU/mL。设置阳性(加菌不加药)对照和阴性(不加菌不加药)对照,每种药物做三个重复试验,在30 ℃培养箱中继续培养18~24 h,以没有细菌生长的最低药物浓度判定为该药物的最低抑菌浓度。
1.6.3 棋盘式微量稀释试验测定恩诺沙星和天然化合物的联合抑菌试验
采用CLSI公布的方法测定天然化合物与抗菌药物组合对JZ15062301菌株的联合抑菌作用[13]。将受试药物分别在1.5 mL无菌离心管中倍比稀释,在无菌条件下分别取50 μL药物加入96孔细胞培养板中。使抗菌药物共加入9孔(2~10行)并且浓度从左到右依次降低,天然化合物共加入7孔(B-H列)并且从上到下浓度依次降低。A2~A10和1B-1H孔中补加50 μL的培养基补足体系。菌液用麦氏比浊管调整至0.5麦氏单位后稀释150倍,取100 μL菌液加入体系使其在体系的终浓度为5×105CFU/mL,设置阳性(加菌不加药)对照和阴性(不加菌不加药)对照,每种药物做三个重复试验,在30 ℃培养箱中继续培养18~24 h后观察结果,记录药物单独使用和联合以后的MIC值。通过抑菌浓度指数FICI (fractional inhibitory concentration index)评价药物联合使用的效果,计算公式如下:
FICI= MICA药联合/MICA药单独+MICB药联合/
MICB药单独
当FICI≤ 0.5两种药物为协同作用 (Synergism,SYN);当0.5< FICI≤ 4时为无关作用 (indifference,IND);当FICI> 4时为拮抗作用(antagonism,ANT)[14]。
2 结果
2.1 病原菌的培养特性
从患病日本医蛭的肿胀和结节部位取组织进行细菌分离,结果分离到的菌株在培养基上经过培养后形成圆形光滑、颜色灰白、边缘整齐且隆起的不透明菌落,经革兰氏染色和镜检发现该分离株为革兰氏阴性短杆菌。
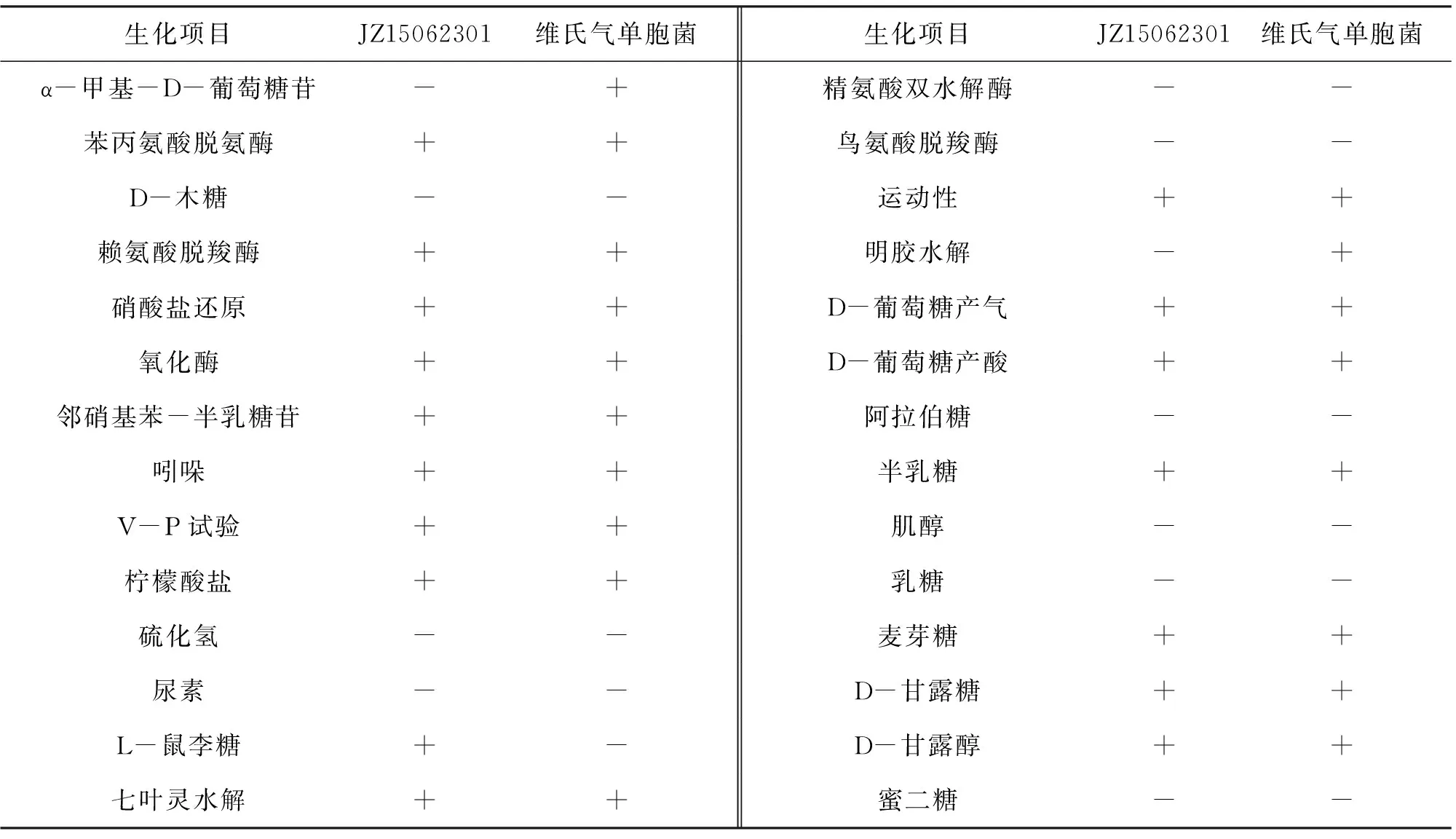
表1 JZ15062301菌株的生化特性Tab.1 Biochemical characterization of JZ15062301 isolate
注+,≥90%的菌株为阳性;-,≥90%的菌株为阴性。
2.2 回归感染结果
健康日本医蛭在感染后24 h后开始出现死亡,1.5×108CFU/mL浓度组出现死亡的时间较早,感染后24 h即开始出现死亡,于感染后的4 d全部死亡。感染后未死亡的日本医蛭在7 d后开始出现症状,主要表现为感染部位的皮肤和肌肉肿胀,至感染后12 d低浓度组部分患病日本医蛭出现肌肉结节甚至溃烂症状,阴性对照组在整个试验过程中未出现发病和死亡情况。经Bliss法计算JZ15062301菌株对健康日本医蛭的半数致死浓度(LC50)为7.75×105CFU/mL。取死亡和症状明显的患病日本医蛭进行剖检和细菌分离得到了与攻毒菌株JZ15062301理化性状一致的细菌。
2.3 致病菌株的生化鉴定
分离菌株的生理生化鉴定结果如表1所示,结合该菌株的菌落形态和革兰氏染色结果,根据《常见细菌系统鉴定手册》的判定标准初步鉴定该菌株为维氏气单胞菌。
2.4 致病菌株的分子生物学鉴定
使用16S rRNA通用引物扩增后可以得到长度约为1.5 kb的基因序列。基因测序结果表明,该菌株16S rRNA基因序列长度为1 453 bp。运行BLAST程序将该序列与NCBI数据库中的基因序列进行同源性比对,将同源性较高的序列用MEGA5.1软件构建系统发育树。结果发现JZ15062301菌株与维氏气单胞菌(KU163442.1,KU554699.1,KR070960.1和KU543613.1)亲缘关系最近(图1),同源性为99%。综合分析该分离株的菌落形态、染色特征、生理生化鉴定结果和系统发育结果可以将该病原菌鉴定为维氏气单胞菌。
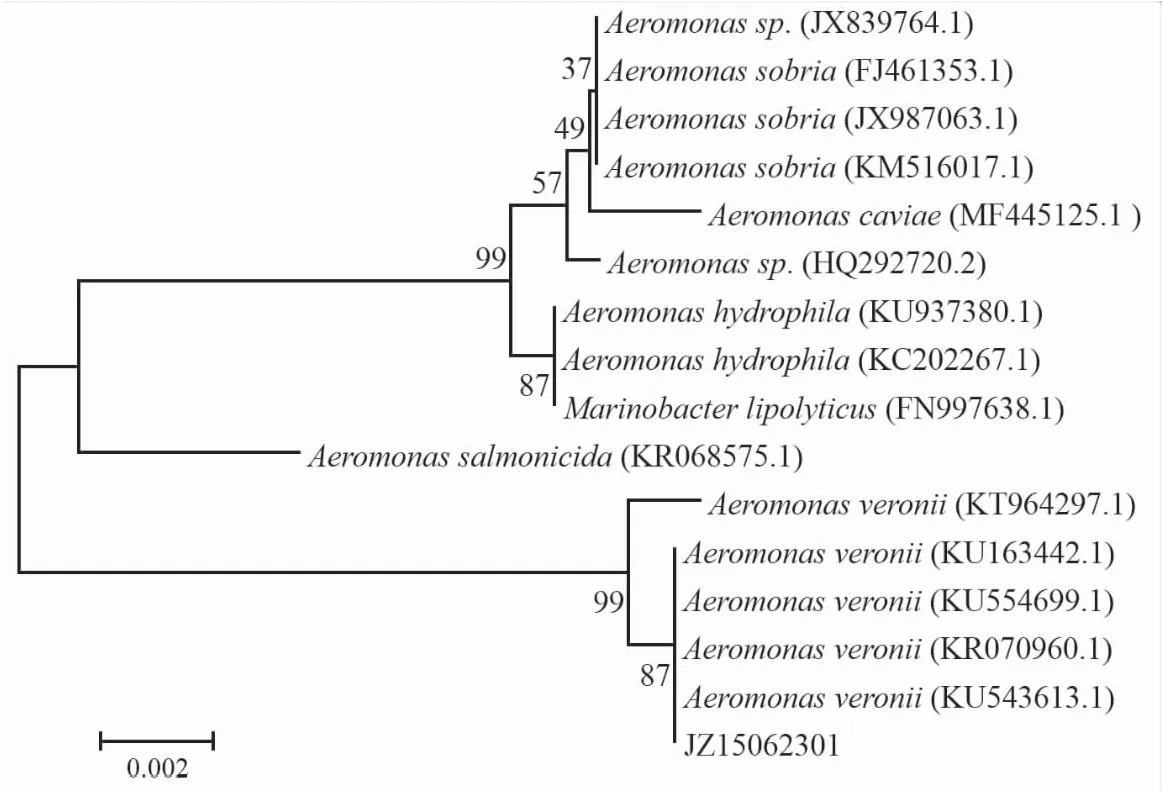
图1 JZ15062301菌株的系统发育树Fig.1 Constructed 16S rRNA phylogenetic tree of JZ15062301 by MEGA 5.1
2.5 药物敏感性试验结果
2.5.1 常用抗菌药物的敏感性
本试验采用K-B法测定了分离株JZ15062301对20种抗菌药物的敏感性,结果如表2所示。该分离株对妥布霉素、氟苯尼考等4种药物敏感,对阿米卡星、大观霉素、环丙沙星和磺胺异噁唑4种药物中度敏感,对青霉素、头孢拉定、阿莫西林、恩诺沙星等12种药物耐药。
2.5.2 恩诺沙星与天然化合物的最小抑菌浓度
结果如表3所示,恩诺沙星的MIC值为32 μg/mL,天然化合物的MIC在32~512 μg/mL之间。其中白藜芦醇、二氢杨梅素的抑菌活性最强,其MIC值均为32 μg/mL,而咖啡酸抑菌活性最差,其MIC值为512 μg/mL。
2.5.3 体外联合抑菌试验
如表3所示,异土木香内酯与恩诺沙星联合使用后其MIC显著下降,FICI指数为0.25 (FICI<0.5)。因此根据1.8中提到的判定方法判定异土木香内酯与恩诺沙星联合使用在体外具有协同抗菌作用。
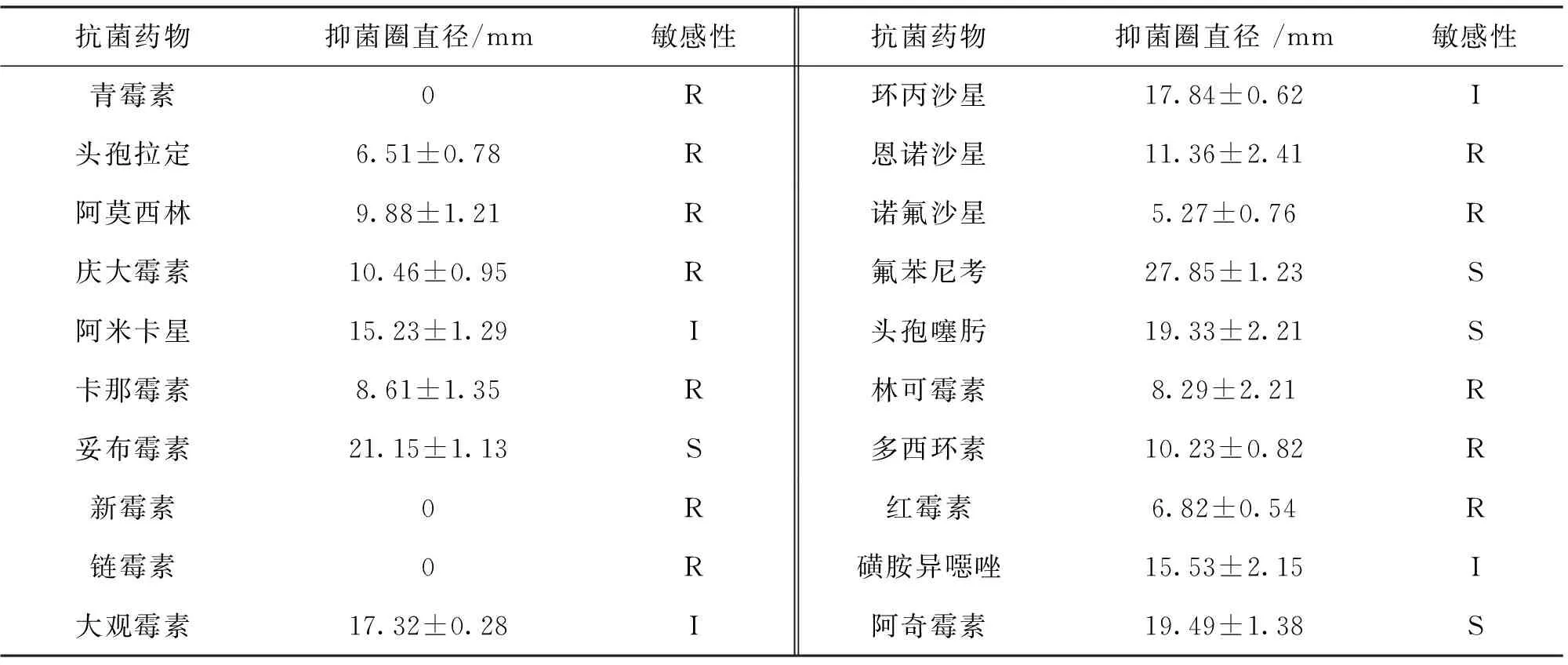
表2 JZ15062301对20种抗菌药物的敏感性Tab.2 Sensitivity of JZ15062301 strain to 20 kinds of antibiotics
注:S,敏感;I,中度敏感;R,耐药
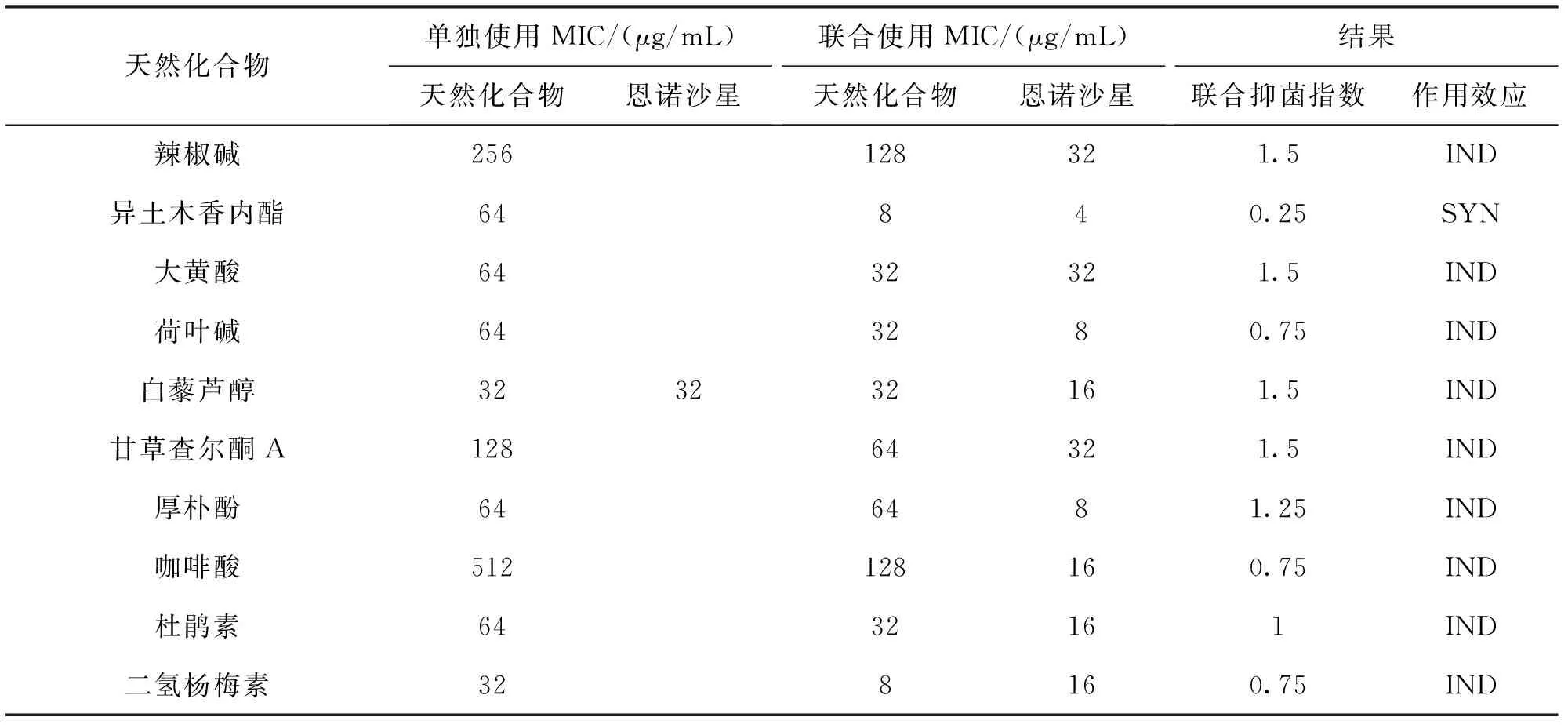
表3 天然化合物与恩诺沙星(单独或联合)对JZ15062301菌株的MICTab.3 The MIC values of natural compounds and enrofloxacin (alone or combined)against JZ15062301 strain
注:SYN:协同作用;IND,无关作用。
3 讨论
维氏气单胞菌是一种常见的条件性致病菌,广泛分布于水环境中。大量研究表明,当水质恶化、养殖动物外伤及免疫力低下时极易感染该菌,水产养殖动物一旦感染该菌后会出现皮肤溃烂、脏器出血和腹水等症状,死亡率较高,对水产养殖业的健康发展构成了严重威胁[15]。胡秀彩等[16]从患病蝶尾金鱼中分离到一株致病性维氏气单胞菌,是造成蝶尾金鱼脱鳞和出血的病原菌,人工感染24 h后可造成100%的死亡率。陆梦莹等[17]从患病怀头鲶肝脏等组织中分离到一株致病性维氏气单胞菌,人工感染后可导致体表出血、腹水等症状,且感染鱼在72 h内死亡率达100%。常燕等[18]从暗纹东方鲀体内分离到维氏气单胞菌,其对暗纹东方鲀和小鼠均有较强的致病力,能导致暗纹东方鲀体表充血和出血等症状。此外,郑世雄等[19]发现维氏气单胞菌可以引起池塘养殖的中华绒螯蟹死亡,人工感染发现该菌可在24 h内导致感染中华绒螯蟹全部死亡,且其症状与自然发病相同。本试验从有结节症状的日本医蛭中分离到了一株病原菌,经过对其生理生化特征分析、16S rRNA保守序列测序和构建进化树发现该菌株与维氏气单胞菌的同源性高达99%,结合生理生化特性将该菌株鉴定为维氏气单胞菌。菌株经回归感染试验发现可以导致健康日本医蛭出现结节甚至皮肤溃烂等症状,从回归感染的患病水蛭分离的病原菌的生理生化特性和16S rRNA保守序列与分离株JZ15062301一致,因此确认分离株JZ15062301为导致日本医蛭产生结节和水肿症状的病原菌。
抗菌药物内服是目前水产养殖业治疗维氏气单胞菌感染的主要方法,但由于药物的滥用导致维氏气单胞菌耐药性严重[20]。耿昕颖等[21]研究了不同鱼类来源的维氏气单胞菌的耐药情况发现所试验菌株耐药性严重且呈多重耐药性,对多西环素、磺胺间甲氧嘧啶和阿米卡星等5种常用药物的耐药率超过70%,对恩诺沙星的耐药率为57.69%,所有试验菌株对氟苯尼考均较为敏感。周光等[22]研究了56株团头鲂养殖池维氏气单胞菌的致病性和耐药性发现,维氏气单胞菌对大部分受试抗菌药物耐药,平均耐药率达73%,而且其发现能够导致鱼发病的菌株多为耐药谱较广的菌株。本试验中所鉴定的病原菌对妥布霉素、氟苯尼考、头孢噻肟和阿奇霉素四种受试抗菌药物较为敏感,耐药率较高;但不同来源的维氏气单胞菌由于养殖环境、用药习惯等不同导致该分离株的耐药特点与以往报道有差异。因此提示我们在养殖过程中如发生细菌性病害应及时进行病原分离和药敏试验以筛选出敏感药物有针对性地进行治疗。
尽管目前临床分离的致病性维氏气单胞菌仍有有效的抗生素进行治疗,但抗生素所带来的生态风险和耐药性风险已经引起人们的高度重视,因此逐渐将抗菌药物的研究转向了中药替代抗生素的研究。王德强等[23]采用棋盘交叉法研究了14种中草药联合复方对罗非鱼无乳链球菌的作用,结果发现有6种中草药复方具有协同作用。吴亮等[24]通过琼脂培养法测定了氟苯尼考与4种中药复方协同抑菌作用,结果筛选到34种复方对15株鳗鲡病原菌有协同和相加作用。卢静等[25]研究了抗生素与中药单体的协同抑菌作用,发现没食子酸与恩诺沙星联合应用对温和气单胞菌具有协同抑菌作用。以上研究结论表明中药与抗生素协同用药策略可以降低抗生素和中药的MIC,从而降低治疗后药物在水产品中的残留,在抑制水产养殖动物病原菌感染上有较好的前景。本试验采用天然化合物标准品作为试验对象,有效避免了因中药提取工艺和条件不同对试验结果造成的影响。通过最小抑菌浓度测定试验发现天然化合物对JZ15062301菌株的MIC值分布在32~512 μg/mL之间,其中白藜芦醇和二氢杨梅素的MIC值最低,均为32 μg/mL。进一步通过对受试药物的棋盘式微量稀释试验研究发现,异土木香内酯与恩诺沙星联合使用后两种药物对JZ15062301菌株的MIC值均下降了87.5%,其FICI指数为0.25,具有协同抑菌作用,其他药物与恩诺沙星联合使用后尽管MIC值均有不同程度的下降,但其FICI指数均大于0.5,因此不具有协同抑菌作用。本试验结果表明,异土木香内酯与恩诺沙星联合使用可以降低两种药物的浓度,提高药物敏感性,对于延长恩诺沙星的使用寿命和降低临床使用剂量有重要意义。

