低剂量三苯基锡暴露对鲤GH/IGF-I轴的毒性效应
刘 伟,钟利桥,解华晓,吴路银,姚 凡,倪朝辉
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院长江水产研究所,农业部长江中上游渔业生态环境监测中心,武汉 430223;3.中国水产科学研究院淡水渔业研究中心,江苏无锡 214081;4.华中农业大学水产学院,武汉 430070)
三苯基锡(triphenyltin,TPT)是一类重要的环境污染物,它具有较强的防腐、杀菌和杀藻能力,被作为船舶防污漆、木材防腐剂、PVC稳定剂和农作物杀菌剂等[1]广泛应用于农业、工业和生物医学方面,其使用量呈现逐年递增趋势。全世界平均每年有300t左右含有大量有机锡防污涂料进入到海洋环境中,对海洋环境造成巨大污染。例如,韩国沿岸的表层海水中TPT的浓度为5.9 ng/L(以锡计)[2],青岛石老人海水浴场的TPT浓度更是高达53.2 ng/L[3]。
水环境中TPT主要通过食物链的方式进入生物体内,对水生生物产生一定的毒性影响。目前,国内外有许多关于三苯基锡化合物对水生生物的毒性效应的研究。Santos等[4]报道指出TPT可导致疣荔枝螺(Thaisclavigera)的雄性个体雌性化,中国台湾的福寿螺(Pomaceacanaliculata)也存在此现象[5]。同时,TPT对鱼类也具有多种毒性效应。Hu等[6]提出TPT可能通过改变肌肉组织结构的方式影响鱼体正常发育,甚至致畸,减缓或抑制鱼体生长的猜想,来解释我国野生中华鲟畸形和数量锐减的现象。宋志慧等[7]报道指出TPT可降低斑马鱼(Zebrafish)体内的过氧化物酶活性。
除此之外,有关环境污染物对鱼类生长及GH/IGF-I轴的毒性影响的研究也有很多。例如,Fruchtman等[8]使用久效磷处理斑马鱼发现,久效磷暴露至21 dph和30 dph时,GH表达量显著性增加且GHR基因的表达受到抑制;暴露42 dph时,GH基因的表达水平降低。GH 还可促进鲤、大麻哈鱼和罗非鱼等鱼体的IGF-I基因的表达,而IGF-I以“负反馈”的形式调控GH的合成与分泌[9]。Haruhisa等[10]通过硬骨鱼类体内的IGF-I对GH调节的研究表明,IGF-I可降低虹鳟鱼体内及体外的GH分泌。
目前,有关TPT影响对鱼类GH/IGF-I轴毒性影响的研究较少。因此,本研究以鲤为研究对象,以典型的TPT化合物三苯基氯化锡(TPTCl)为唯一目标毒物进行暴露实验,从GH/IGF-I轴的角度探讨TPT影响鱼类生长的作用机理,为研究环境污染物对鱼类生长影响的研究提供有力的数据支持。
1 材料与方法
1.1 实验仪器和试剂
实验试剂:96% TPTCl(aladdin 公司);ELISA 试剂盒(MSK公司);SYBR Green Realtime PCR Master Mix (TOYOBO);逆转录试剂盒购自Fermentas 公司;TRIZOL Reagent(Invitrogen)。
实验仪器:电动研磨器(10D-79219,Janke & Kunkel-Str);低温冷冻离心机(centrifuge 5415R,Eppendorf 公司)、酶标仪(SYNERGY/2,bioTek 公司);ProFlex PCR仪及荧光定量PCR仪7500(均购自Applied Biosystems公司);电泳仪(DYY-12,bioTek公司)。
1.2 实验用鱼
实验用鱼为鲤,购买自长江水产研究所荆州基地。严格按照鲤养殖标准操作(水温(25±1)℃),光照周期12 h∶12 h(光∶暗),24 h连续通气,养殖水中溶氧充足,每d投喂商业饲料两次(8:00;14:00),换水一次,驯养14 d后进行正式实验。
1.3 实验设计
将实验鲤平均放在12个养殖箱内(每组3个重复),每个养殖箱放鱼18条,实验养殖水体积为100 L。依据预实验所得TPT 96 h半致死浓度和环境浓度将实验设定为0.024、0.24、2.4 μg/L三个TPT暴露组和一个对照组进行暴露实验。连续暴露7、21和48 d后分别取样,取样的前一天禁食。取样时,随机从每个实验组取6尾鱼,麻醉后抽血,低温离心(4 ℃,3 000 r/min,30 min)制备血浆,-80 ℃保存备用。取血后,取鲤肝脏、脑垂体分别置于Trizol中用于基因表达检测,均置于-80 ℃冰箱中备用;以上操作均在冰浴条件下进行。
1.4 各项指标测定及计算方法
1.4.1 血浆中GH和IGF-I 含量的测定
血浆中GH和IGF-I 含量检测按照ELISA试剂盒说明书进行。
1.4.2 肝脏GHR、IGF-I基因和脑垂体GH基因表达量的测定
鲤肝脏和脑垂体总RNA 的提取严格按照试剂盒说明书进行。然后荧光定量PCR仪进行q-PCR反应,反应体系(25 μL)为1μL 的cDNA、12.5 μL的 SYBR Green Mix、1 μL 的5μmol/L sense primer、1 μL 的5μmol/L anti-sense primer和9.5 μL 的ddH2O,95 ℃预变性2 min后进行35个循环,循环参数为:95 ℃ 变性15 s,60 ℃退火15 s,60 ℃延伸 1 min,然后95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃15 s后进行溶解曲线分析检测扩增产物的特异性。以β-actin为内参基因,用2-ΔΔCt的方法测定各基因相对表达量。各检测基因及β-actin的引物序列如表1。

表1 荧光定量PCR引物序列Tab.1 Nucleotide sequences of primers for q-PCR
1.5 数据处理方法
实验用One-Way ANOVA方差分析对数据进行统计学分析(SPSS for Win 13.0 软件),差异显著性以P<0.05为显著性标准,以P<0.01为极显著性标准。
2 结果
2.1 TPT暴露对鲤血浆GH水平的影响
当暴露至7 d时,与对照组相比,0.24 和2.4 μg/L 暴露组血浆中GH水平随TPT暴露浓度的增加而升高且差异性极显著,0.024 μg/L暴露组无显著性变化;暴露至21和48 d时,0.24和2.4 μg/L暴露组GH含量较对照组显著降低且差异性显著,0.024 μg/L暴露组无显著差异(图1)。
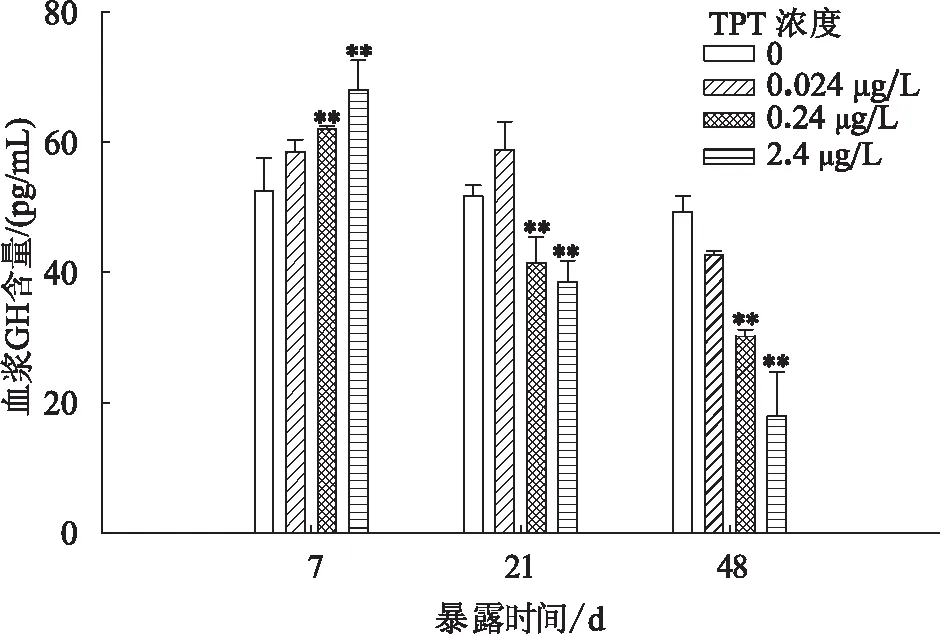
图1 三苯基锡暴露对鲤血浆GH水平的影响Fig.1 Effects of plasma GH concentration on C.Carpioafter TPT exposure 数据表示为平均值±标准差(n=6)。*P<0.05,**P<0.01,图2-5同。
2.2 TPT暴露对鲤垂体GH基因表达量的影响
TPT暴露至7 d时,鲤垂体GH mRNA水平较对照组无显著性变化;暴露至21 d时,与对照组相比,2.4 μg/L暴露组垂体GH mRNA的表达被抑制且差异性极显著,其他暴露组无显著性变化;暴露至48 d时,0.024、0.24和2.4 μg/L暴露组垂体GH mRNA水平极显著性降低且呈剂量效应关系(图2)。
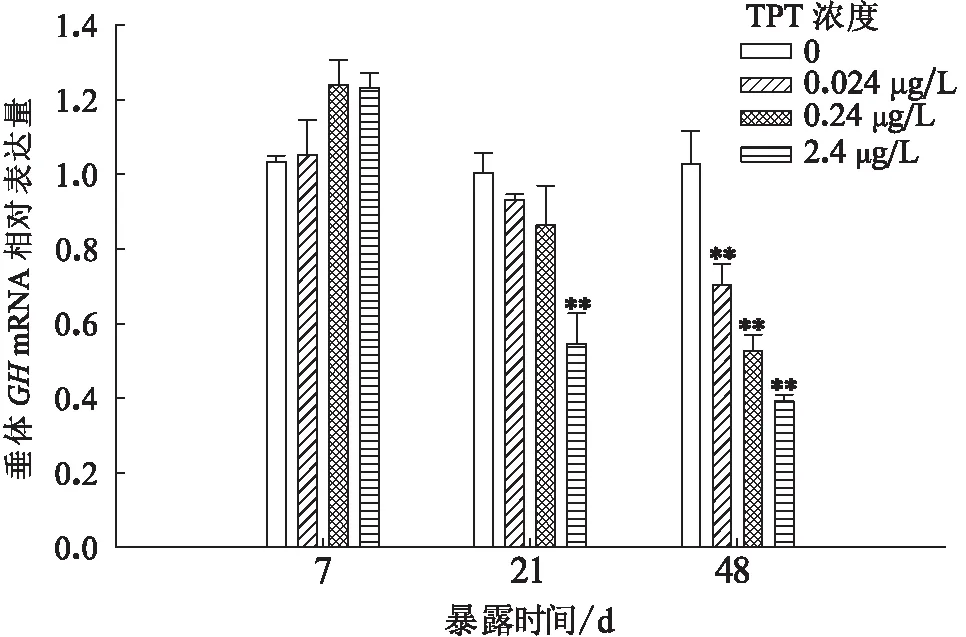
图2 三苯基锡暴露对鲤垂体GH基因表达量的影响Fig.2 Effects of the relative abundance on hepatic GH mRNA of C.Carpio after TPT exposure
2.3 TPT暴露对鲤血浆IGF-I 水平的影响
TPT暴露至7和21 d时,与对照组相比,0.24 μg/L暴露组鲤血浆IGF-I含量显著性降低,2.4 μg/L暴露组下降极显著,0.024 μg/L暴露组无显著性变化;暴露至48 d时,0.24 μg/L暴露组下降极显著(图3)。
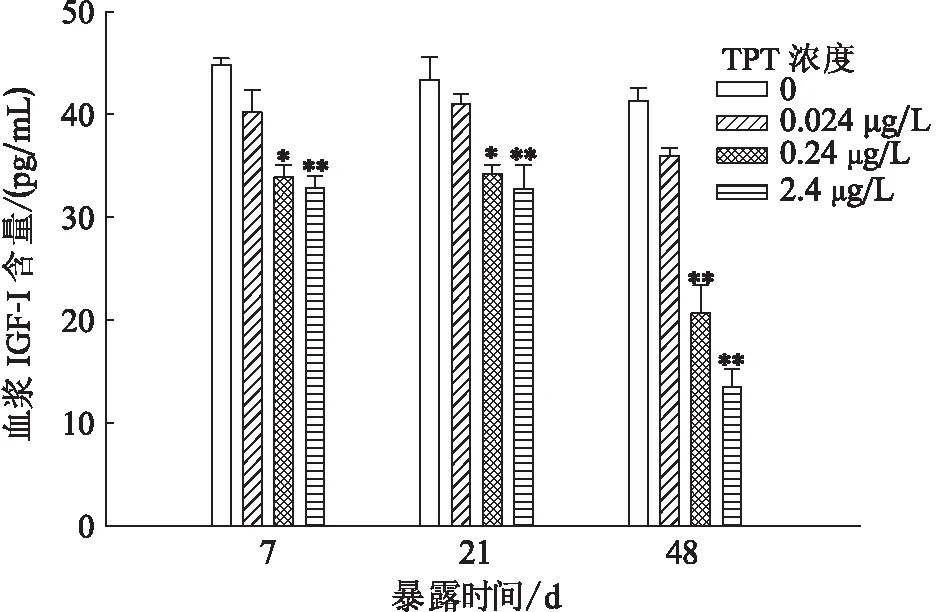
图3 三苯基锡暴露对鲤血浆中IGF-I水平的影响Fig.3 Effects of plasma IGF-I concentration on C.Carpioafter TPT exposure
2.4 TPT暴露对鲤肝脏IGF-I基因表达量的影响
TPT暴露至7、21和48 d时,3个暴露组鲤肝脏IGF-I mRNA表达量随浓度的增加和时间的延长而减少,0.24 和2.4 μg/L均较对照组存在极显著差异;而0.024 μg/L暴露组仅在48 d时较对照组存在显著差异(图4)。
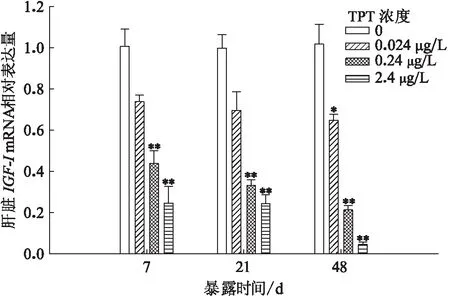
图4 三苯基锡暴露对鲤肝脏IGF-I mRNA表达水平的影响Fig.4 Effects of the relative abundance of hepatic IGF-I mRNA on C.Carpio after TPT exposure
2.5 TPT暴露对鲤肝脏GHR基因表达量的影响
TPT暴露鲤至7 d时,鲤肝脏GHRmRNA水平较对照组无显著差异。暴露至21 d时,与对照组相比,0.024 μg/L暴露组显著性下降,0.24 和2.4 μg/L暴露组下降极显著;暴露至48 d时,0.024 μg/L暴露组较对照组无显著差异,0.24 和2.4 μg/L暴露组下降极显著(图5)。
3 讨论
GH/IGF-I轴是硬骨鱼类生长调控的主要轴线,它可通过影响鱼体的生长、繁殖、代谢等方面调控鱼体生长[11]。GH/IGF-I轴由GH、IGF-I、GH等多种调控因子组成,其中,GH和IGF-I又是GH/IGF-I轴参与鱼类生长调控的主要调控因子[12]。正常情况下,鱼类的生长与GH含量之间存在一种正相关关系[13]。但是在环境内分泌物等外界不良因素的胁迫下,鱼体血浆GH含量和垂体GH mRNA表达量呈现先促进后抑制的趋势。郑燕[14]发现久效磷暴露罗非鱼21 d时,血浆GH含量和垂体GH mRNA表达量均有显著性增加,42 d时均显著性低于对照组。Davis等[15]对罗非鱼进行七氯暴露发现,暴露至7 d时,血浆GH含量升高,14 d后GH含量随暴露时间的增加而降低。本实验血浆GH含量测定结果与上述报道的其他内分泌物暴露对鱼类血浆GH含量及垂体GH mRNA 表达水平的结果相似。这可能是由鲤鱼肝脏中IGF-I因子对GH的合成和分泌的负反馈机制所导致。在暴露至21 d时,IGF-I对GH的负反馈作用促进了GH的分泌;但是暴露至48 d时,由于暴露时间的延长,这种负反馈调节由于逐渐适应了该种环境而减弱。
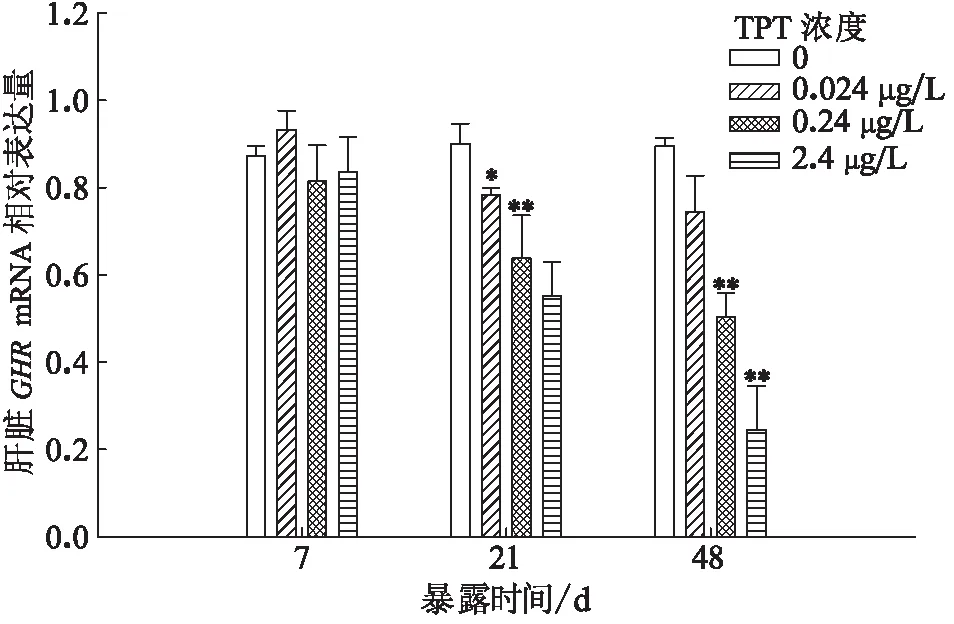
图5 三苯基锡暴露对鲤肝脏GHR mRNA表达量的影响Fig.5 Effects of the relative abundance of hepatic GHRmRNA on C.Carpio after TPT exposure
IGF-I是GH最主要也是最重要的调节基因,也是GH/IGF-I轴的核心因子[16],它在机体的含量和鱼体的生长具有一定的相关性。研究表明,血浆中IGF-I含量及肝脏中IGF-I mRNA的表达量与鱼类的营养和生长状况具有较强的正相关性[17]。Uchida等[18]研究发现,随着罗非鱼IGF-I水平的下降,其体重和特定生长率降低。在对罗非鱼、鲑、乌颊鱼等硬骨鱼类的的研究中也得出了相同的结论[19-21]。同时,肝脏IGF-I mRNA的表达还受到垂体GH的调控[16]。研究表明,GH可以促进金鱼、鲤、罗非鱼等鱼体中IGF-I mRNA的表达[22-24],提高血浆中IGF-I含量[25]。此外,IGF-I还以“负反馈”的形式调控GH的合成与分泌[26]。Fruchtman等[27]研究显示IGF-I能够降低虹鳟垂体GH mRNA的表达。上述研究结果与本实验结果一致,这表明TPT对肝脏中IGF-I mRNA的翻译、分泌直至运输到血浆的途径无显著影响,而可能是通过影响IGF-I基因的转录来影响IGF-I的合成,从而抑制鲤生长。其中,IGF-I对GH的“负反馈”的反馈作用也更好的解释了TPT暴露至7 d时,肝脏中IGF-I基因表达量和血浆中IGF-I水平显著性下降,而垂体中GH基因表达量和血浆中GH却显著升高这一实验结果。
GHR主要分布在肝脏,其他组织(如肾脏、鳃、肠等)也有分布但是含量很少[28]。GH主要是通过与细胞表面GH受体(GHR)结合,并促进IGF-I 的合成与分泌,由IGF-I参与调控相关蛋白与脂质的合成,进而发挥促生长作用[29]。Fukada等[30]饥饿处理鲑后发现,GH和GH mRNA水平升高的同时GHRmRNA和IGF-I mRNA 水平下降,导致鲑生长减缓。本实验中也得到类似结果,猜测可能是GHRmRNA 表达量的减少抑制了IGF-I的合成与分泌。
4 结论
(1)较高浓度的TPT(0.24 μg/L、2.4 μg/L)长期暴露时,鲤垂体 GH分泌和GH mRNA的表达均受到抑制,尤其是当TPT浓度为2.4 μg/L时,抑制效果极显著。
(2)较高浓度的TPT(0.24 μg/L、2.4 μg/L)短期暴露即可抑制IGF-I的分泌和IGF-I mRNA 的正常表达,并且随暴露时间的延长和暴露浓度的增加抑制效果越显著。
(3)短期TPT暴露对鲤GHRmRNA 的表达无显著性抑制作用,当长期暴露时,较高浓度的TPT(0.24 μg/L、2.4 μg/L)暴露均可抑制其正常表达。
以上结论显示,血浆中GH及IGF-I和肝脏中GH 基因及IGF-I 基因均可以作为环境污染物对鱼类生长影响的指示因子。

