OTX2基因表达下调对MC3T3-E1细胞增殖分化和自噬的影响
田玉楼,于默,史娅婕,张薇
(中国医科大学口腔医学院正畸教研室,沈阳 110002)
骨性反牙合是临床中常见的错牙合畸形,下颌骨发育过度是其主要发病机制,目前虽尚未有明确的易感基因,但口腔颌面发育相关基因表达水平的变化会影响其发生。OTX2属于邻位齿状同源盒 (orthodentielehomeo-box,OTX) 基因家族的一员,在颅面和脑前结构的生长发育中起关键作用,参与第一鳃弓和第二鳃弓的形成。OTX基因家族是骨性反牙合的候选基因,参与调控下颌骨的生长发育[1]。OTX2基因的缺失可能引起口腔、下颌骨、脊椎等的发育缺陷,引发眼-耳-脊椎综合征[2]。
自噬是一种广泛存在于真核细胞中的高度保守的过程,是骨形成和发育过程中不可缺少的调节因子[3-4]。自噬可增强颅颌面骨骨髓间充质干细胞的增殖和抗凋亡能力,调控其向成骨细胞分化[5-6],还可以帮助处于应激条件下的成骨细胞抵御环境变化,维持其增殖和正常生理功能[7]。通过抑制成骨细胞自噬水平可以抑制该细胞增殖[8],提示自噬与成骨细胞的形成和细胞增殖有密切关系,降低成骨细胞的自噬水平可以引起成骨细胞的增殖减少。
本研究应用小干扰RNA (small inteference RNA,siRNA)技术下调小鼠成骨细胞系MC3T3-E1中OTX2的表达水平,检测其对成骨细胞增殖、分化的影响,观察自噬水平的改变,为阐明骨性反牙合的分子遗传机制奠定实验基础。
1 材料与方法
1.1 主要试剂
α MEM培养基 (美国Hyclone公司) ,胎牛血清 (美国CLARK公司) ,抗OTX2抗体 (英国Abcam公司) ,siRNA-mate转染试剂和化学合成的OTX2-siRNA (苏州吉玛公司) ,SABC试剂盒及DAB显色试剂 (武汉博士德公司) ,碱性磷酸酶 (alkaline phosphatase,ALP) 测试盒 (南京建成生物工程研究所) ,MTT细胞增殖及细胞毒性检测试剂盒、细胞周期检测试剂盒、AnnexinV-FITC/PI细胞凋亡检测试剂盒、自噬染色检测试剂盒 (MDC法) 均购自江苏凯基生物技术股份有限公司。
1.2 方法
1.2.1 细胞培养和转染:小鼠成骨细胞系MC3T3-E1购自中科院细胞库,在含10%胎牛血清、1%双抗 的α MEM中 于37 ℃、5%CO2培 养 箱 中 培 养。3~4 d传代1 次,当细胞生长为对数期时进行实验。设计3对靶向的OTX2-siRNA序列,用于转染MC3T3-E1细胞系。OTX2-siRNA合成序列如下,OTX2-mus-868,5’-GCAGUGCUCCAGUGUCUAU TT-3’,5’-AUAGACACUGGAGCACUGCTT-3’;OTX2-mus-1027,5’-GCAUGGACUGUGGAUCUUAT T-3’,5’-UAAGAUCCACAGUCCAUGCTT-3’;OTX2-mus-1225,5’-CCUCUUGGAAGCUUAACUUTT-3’,5’-AAGUUAAGCUUCCAAGAGGTT-3’;阴 性 对 照siRNA,5’-UUCUCCGAACGUGUCACGUTT-3’,5’-ACGUGACACGUUCGGAGAATT-3’。 将MC3T3-E1细胞随机分为OTX2-mus-868组、OTX2-mus-1027组、OTX2-mus-1225组、阴性对照组及空白对照组。将MC3T3-E1接种在无菌6孔板中(2×105/孔),待细胞融合达80%左右,参照siRNA-mate说明书进行转染,48 h收集细胞。
1.2.2 免疫细胞化学法检测各组细胞OTX2蛋白表达:消化MC3T3-E1,并调整细胞浓度至1×106/mL,分别取100 μ L单细胞悬液滴加在预先放置无菌盖玻片的6孔板内,细胞培养24 h后转染。转染48 h后,取出细胞爬片,冷丙酮固定30 min,用30%过氧化氢+纯甲醇混合液浸泡35 min,PBS冲洗,再用5%BSA封闭30 min,滴加1∶400稀释的一抗,4 ℃反应16 h,PBS冲洗,再滴加二抗37 ℃孵育20 min,PBS冲洗,SABC试剂继续孵育20 min,最后用加入含0.015%Tween20的PBS洗涤切片,DAB显色3 min,封片,观察。20倍物镜下,随机选取5个视野,计数100个细胞中的阳性细胞数,计算各组阳性细胞所占百分比,并进行统计分析。选取免疫细胞化学检测后干扰效果最好的一组OTX2-siRNA进行后续实验。
1.2.3 MTT法检测细胞增殖:消化转染后细胞,以2×104/mL浓度接种于96孔板,每孔200 μ L混匀。设立不含细胞的空白组,共4组,每组设4个平行孔。转染48 h后,每孔中加入1×MTT 50 μ L,置培养箱中继续培养4 h,吸出上清液,加入DMSO150 μ L,平板摇床摇匀5 min,使其充分溶解,利用酶标仪在550 nm处读取光密度 (optical density,OD) 值。计算比较各组细胞抑制率[细胞抑制率(%) =1- (OD实验组-OD空白组) /(OD对照组-OD空白组) ×100]。
1.2.4 流式细胞术检测细胞周期:无EDTA的胰酶消化转染后48 h细胞,取1 mL单细胞悬液 (浓度为1×106/mL) ,离心去上清,70%冷乙醇4 ℃过夜,冲洗离心后加入100 μ L RNase A,37 ℃水浴30 min,加入400 μ L 碘化丙啶 (propidium iodide,PI) 避光染色,4 ℃静置30 min,上机检测,激发波长488 nm处红色荧光,计算各组细胞S期细胞比例和增殖指数。
1.2.5 AnnexinV-EGFP/PI双标记法检测细胞凋亡:转染48 h细胞消化后,2 000 r/min离心5 min收集,用预冷PBS洗涤细胞2次,离心收集细胞,加入500 μ L Binding Buffer重新悬浮细胞,再依次加入5 μ L AnnexinV-EGFP混匀,5 μ L PI混匀,室温避光反应15 min,流式细胞仪检测。
1.2.6 化学比色法检测ALP合成情况:吸取转染后48 h的细胞培养液,2 500 r/min离心10 min,取上清液进行测定。按照ALP检测试剂盒说明配制反应液,分别设空白孔、标准孔和测定孔,充分混匀并置于37 ℃水浴15 min,轻轻振摇孔板混匀,于波长520 nm,酶标仪检测各孔OD值。培养液中ALP活力(金氏单位/100 mL) =[ (测定OD值-空白OD值) / (标准OD值-空白OD值) ]×酚标准品浓度 (0.1 mg/mL) ×100 mL×样品测定前稀释倍数。
1.2.7 MDC检测细胞自噬水平:细胞爬片转染48 h后,弃掉原培养基,加入300 μ L 1×wash buffer洗涤,每孔加入100 μ L配置好的MDC染色工作液,室温避光染色20 min。300 μ L 1×wash buffer清洗3次,滴加100 μ L collection buffer,加盖玻片。荧光显微镜下用紫外光激发,观察、拍照。高倍镜 (×40) 下计数100个细胞,计算绿色荧光细胞占细胞总数的百分比。
1.3 统计学分析
实验数据用表示,采用SPSS 21.0统计软件对多组间参数进行单因素方差分析,P< 0.05为差异有统计学意义。
2 结果
2.1 各组转染细胞OTX2蛋白表达情况
与阴性对照组和空白对照组相比,3个OTX2-siRNA转染组细胞染色明显变浅,OTX2蛋白表达水平下调。阳性细胞百分率计数结果显示,OTX2-mus-868组为(37.0±2.0) %、 OTX2-mus-1027组为(49.2±1.9) %、OTX2-mus-1225组为(45.0±1.6) %,阴性对照组为(96.4±2.0) %、空白对照组为(96.6±1.1) %,3个OTX2转染组与阴性对照组之间阳性细胞百分比的差异有统计学意义 (P< 0.05) ,其中OTX2-mus-868组表达水平最低,故后续实验选用OTX2-mus-868转染细胞作为实验组;阴性对照组与空白对照组之间差异无统计学意义 (P> 0.05) ,见图1~2。
2.2 OTX2抑制对MC3T3-E1细胞增殖活性的影响
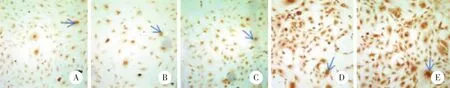
图1 转染48 h后各组细胞OTX2免疫细胞化学染色结果 ×200Fig.1 Immunocytochemical staining results of OTX2 in each group after 48 h of transfection ×200
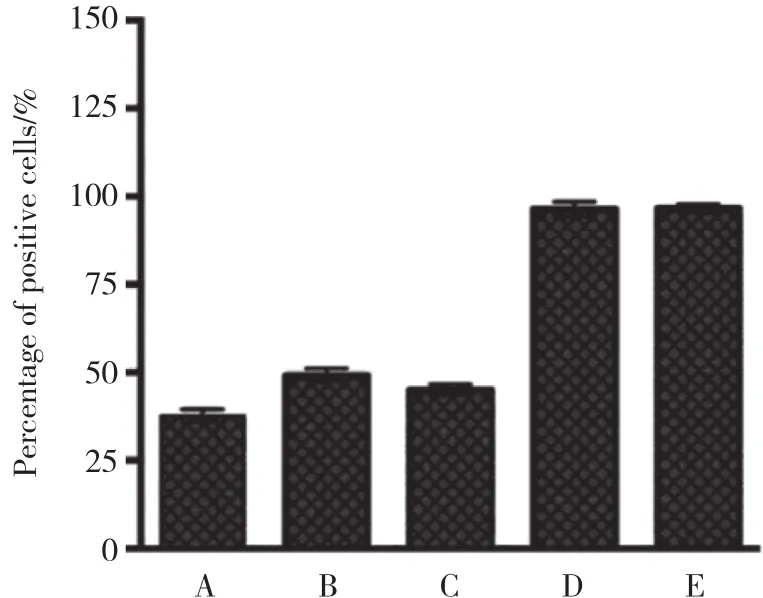
图2 转染48 h后各组细胞OTX2阳性细胞百分率Fig.2 Percentage of OTX2 positive cells in each group after 48 h of transfection
MTT结果显示,实验组、阴性对照组、空白对照组OD值分别为0.28±0.02,0.34±0.04,0.34±0.03。实验组细胞增殖抑制率为 (47.04±7.02) %,与阴性对照组比较差异有统计学意义 (P< 0.05) ,而阴性对照组与空白对照组比较差异无统计学意义 (P> 0.05) ,见表1。
2.3 OTX2抑制对MC3T3-E1细胞周期的影响
流式细胞术分析结果显示,转染OTX2-siRNA后S期细胞比率和增殖指数明显减小,与阴性对照组相比,差异有统计学意义 (P< 0.05) ,而阴性对照组和空白对照组比较差异无统计学意义 (P> 0.05) 。见表2。
2.4 流式细胞术检测细胞凋亡结果
转染48 h后,AnnexinV-FITC/PI双标记法检测细胞凋亡,实验组、阴性对照组和空白对照组总凋亡率差异比较无统计学意义 (P> 0.05) ,见图3、表3。
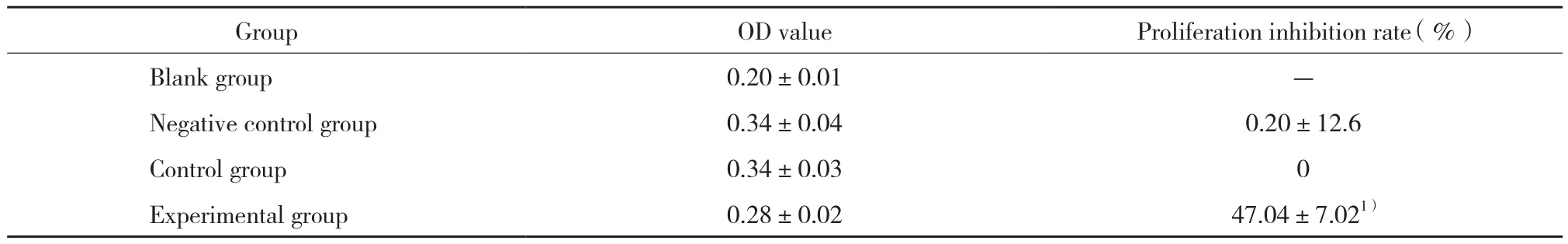
表1 转染后各组细胞OD值和增殖抑制率Tab.1 OD value and proliferation inhibition rate of each group after transfection

表2 转染后各组细胞S期比例及增殖指数Tab.2 S phase ratio and proliferation index of cells in each group after transfection
图3 转染48 h后MC3T3-E1细胞凋亡情况Fig.3 Apoptosis of MC3T3-E1 cells transfected for 48 h
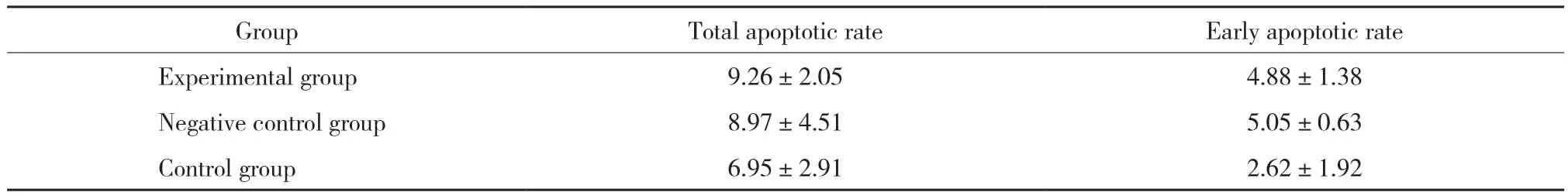
表3 转染后各组细胞的总凋亡率和早期凋亡率 (%)Tab.3 Total apoptotic rate and early apoptotic rate of cells in each group after transfection (%)
2.5 OTX2抑制对细胞ALP合成的影响
与空白对照组及阴性对照组比较,实验组细胞ALP活性明显下降 (P< 0.05) ;而空白对照组和阴性对照组相比,则无明显变化 (P> 0.05) ,表明OTX2表达下调后MC3T3-E1细胞的分化能力明显减弱。见表4、图4。
2.6 转染后成骨细胞自噬水平改变
MDC荧光染色可以观察细胞的自噬水平。如图5所示,实验组MDC染色荧光强度低,点状结构少,阴性对照组和空白对照组染色强度高,点状结构多。实验组荧光细胞百分比为(3.11±0.07) %,阴性对照组为(9.36±1.25) %,空白对照组为(10.54±2.89) %。实验组荧光细胞比例低于阴性对照组,差异有统计学意义 (P< 0.05) 。
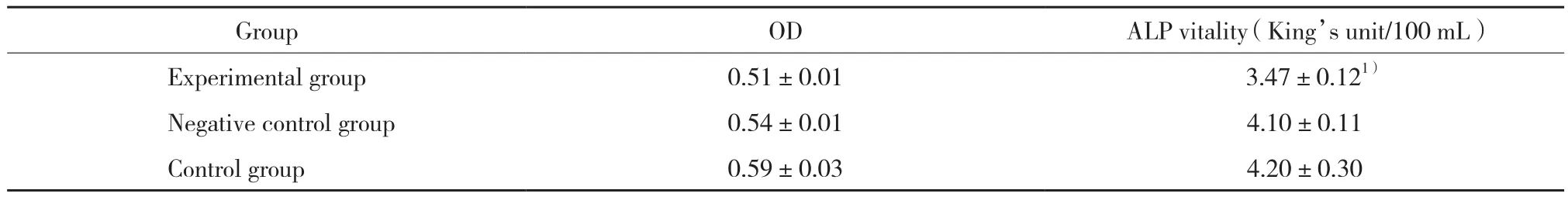
表4 转染后各组细胞上清液OD值及ALP活力值Tab.4 OD value and ALP activity value of supernatant in each group after transfection
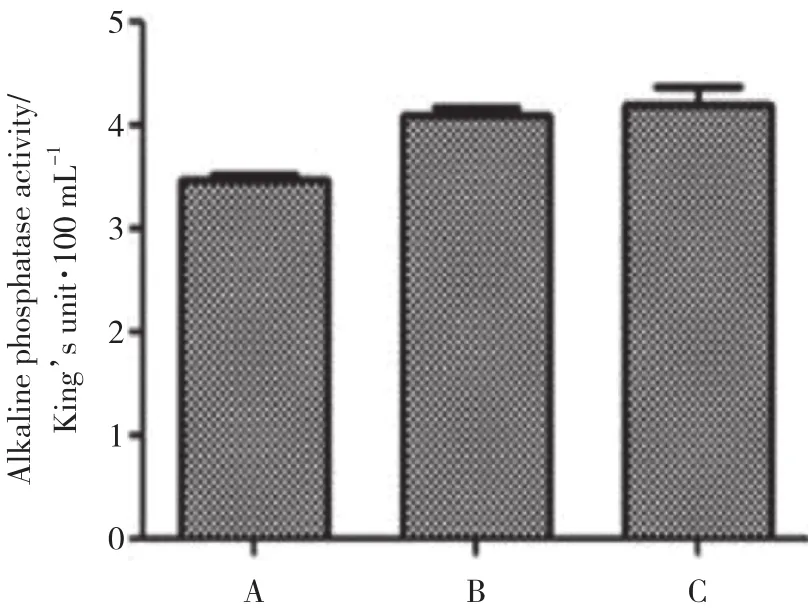
图4 转染48 h后MC3T3-E1细胞ALP合成情况Fig.4 ALP synthesis of MC3T3-E1 cells after transfection for 48 h
3 讨论
自噬是一种溶酶体介导的降解途径,在基础条件和压力条件下降解细胞内的长寿蛋白质或受损伤细胞器,使其成为细胞所需的三磷酸腺苷和营养物质,用来维持细胞内的稳态[9-10]。目前,研究证实自噬对于骨细胞、成骨细胞、破骨细胞的形成和分化起着不可缺少的调节作用。在氟或铅的应激环境下,可以引起小鼠成骨细胞MC3T3-E1的凋亡增加,增殖减少,并诱导其发生自噬,而发生自噬后的成骨细胞,增殖能力反而增强[11-12],表明自噬可作为一种保护机制,减轻外界环境对成骨细胞的损伤,减少成骨细胞凋亡。
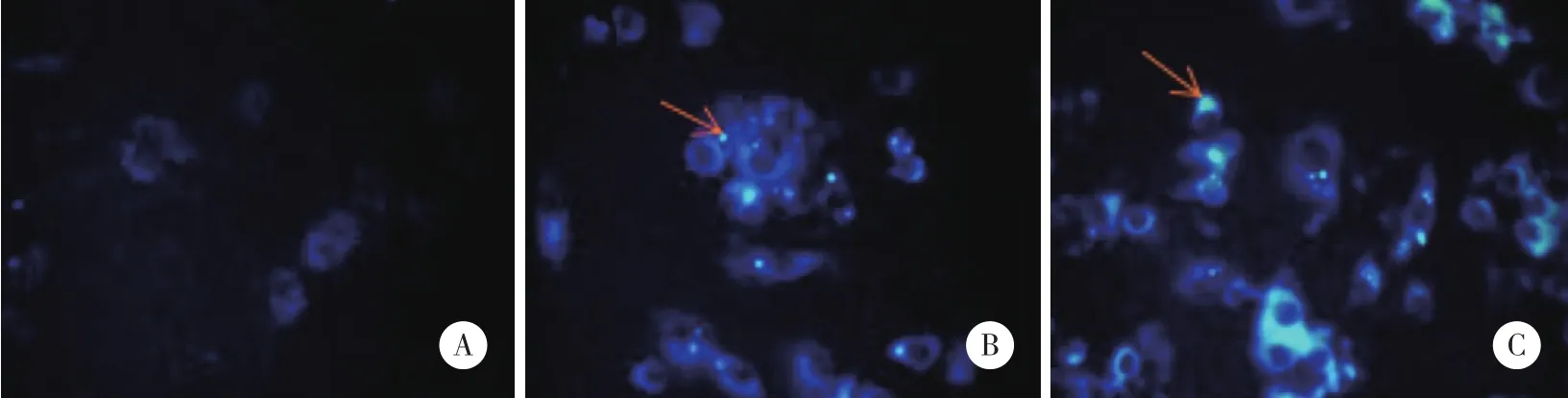
图5 MDC荧光染色转染后的MC3T3-E1细胞 ×400Fig.5 MDC fluorescent staining of MC3T3-E1 cells after transfection ×400
OTX2基因最早出现在胚胎形成初期的内胚层和外胚层,在间脑、中脑等区域中有表达,对于眼、颌骨及神经系统的发育具有重要作用[13]。敲除OTX2基因的纯合子小鼠胚胎致死率明显升高且出现无下颌畸形,小鼠的第三菱脑结构不能正常发育,说明OTX2在颅脑前部的发育中具有重要作用[14-15],而中脑和菱脑的形成与颅颌面骨的发育密切相关。OTX2在下颌骨远中区域和下颌骨前部发育的中脑神经嵴细胞中有表达[16-17],提示OTX2对于颌骨的发育可能起重要作用。本研究通过下调MC3T3-E1中OTX2基因的表达,研究其对成骨细胞的增殖以及自噬的影响,为研究下颌骨过度发育的机制奠定基础。
本研究结果表明,OTX2-siRNA能下调MC3T3-E1细胞中OTX2基因的表达,抑制MC3T3-E1增殖,而对其凋亡水平无明显影响。ALP是骨形成的特异性酶,具有促进骨矿化的能力,常常通过其活性高低来表示成骨细胞的分化水平[18]。本研究结果显示,转染后成骨细胞上清液OD值明显减小,ALP活力单位降低,表明OTX2基因表达下调可以明显降低MC3T3-E1细胞的分化水平。MDC是一种嗜酸性染液,可以选择性地结合到细胞内自噬小体的囊泡膜上,是一种用来检测自噬水平的荧光染色剂。本研究中,MDC染色结果显示,转染后的MC3T3-E1细胞染色强度弱,点状结构少,提示OTX2基因表达下调后,MC3T3-E1自噬水平降低。本研究组将进一步通过体外实验建立OTX2差异表达的成骨细胞模型,通过诱导和抑制细胞自噬水平来观察其对细胞增殖、分化、凋亡等生物学性征的影响,探讨可能存在的信号调控通路。

