登革1型和2型病毒混合感染样本的一步法实时荧光定量PCR检测方法的建立*
孙爱娟 林立丰 兰策介 刘钦梅 高 剑 周 洁 李春晓石清明 邢 丹 张恒端 董言德 郭晓霞** 赵彤言**
(1.安徽医科大学,安徽合肥 230032; 2.军事科学院军事医学研究院微生物流行病研究所,病原微生物生物安全国家重点实验室,媒介生物危害和自然疫源性疾病北京市重点实验室,北京 100071; 3. 广东省疾病预防控制中心, 广东广州 511430)
登革热(Dengue fever, DF)/重症登革热(Severe dengue, SD)是由登革病毒(Dengue virus, DENV)引起的重要的蚊媒传染病。埃及伊蚊Aedesaegypti和白纹伊蚊Ae.albopictus是主要的传播媒介,主要流行于热带和亚热带地区(WHO,2009)。登革病毒属于黄病毒科黄病毒属,根据表面抗原的不同分为4个血清型(DENV-1~DENV-4)(Kautneretal.,1997)。近年来,气候变化、城市化及旅游业的快速发展等为登革热的传播和扩散提供了更快捷、便利的条件,使登革热的流行区域不断扩大(Naishetal.,2014;Thisyakornetal.,2015),新的血清型登革病毒株输入到已有登革热流行的区域,使得同一个地区存在多个血清型登革病毒的混合流行(Saldaetal.,2005;Sharpetal.,2014;Reddyetal.,2017),致使多个血清型登革病毒混合感染患者数量逐年增加并伴随着重症登革热患者人数的增加。特别是2014年我国广东省暴发了有史以来最为严重的登革1型和2型病毒混合传播流行(Zhaoetal.,2016),引起了人们的广泛关注。本研究旨在建立检测登革1型和2型病毒混合样本的一步法荧光定量PCR方法,为登革热的诊断和预测提供技术支撑。
1 材料与方法
1.1 毒株、细胞
登革1型和2型病毒均由广东省疾病预防控制中心提供,在本实验室经乳鼠脑传代,保存于-80 ℃冰箱。登革3型、4型病毒、黄热病毒和甲型H3N2流感病毒的病毒核酸由美莱博公司提供。白纹伊蚊C6/36细胞:含8%胎牛血清的RPMI Medium 1640培养液传代培养,28 ℃,5% CO2条件下培养。BHK-21细胞:含8%胎牛血清的DMEM(Dulbeecco’s Modified Eagle Medium)培养液传代培养,37 ℃,5% CO2条件下培养。
1.2 主要仪器与试剂
Roche LightCycler®480II 实时荧光定量PCR系统(德国Roche公司)、QIAamp 病毒RNA提取试剂盒(凯杰生物工程股份有限公司)、登革1型病毒C基因和登革2型病毒C基因重组质粒由北京天一辉远公司合成、RPMI Medium 1640 basic培养基(Gibco 公司)、胎牛血清、Gibco DMEM basic培养基(Gibco 公司)、低熔点琼脂(美国 sigma公司)、CO2培养箱(Nuaire公司)Premix Ex TaqTM(Probe qPCR), Bulk由Takara公司生产(货号:RR390 L)、RNaseOUTTMRecombinant Ribonuclease Inhibitor由thermo fisher公司生产(货号:10777019)、MuLV Reverse Transcriptase由 thermo fisher生产(货号:N8080018)。
1.3 引物和探针的设计与合成
分别针对登革1型病毒C基因和登革2型病毒C基因保守区,使用Primer Premier 5.0自行设计引物和探针(表1),由上海生工生物工程公司合成。登革1型和2型病毒的探针5′端标记的荧光基团分别为FAM和HEX。
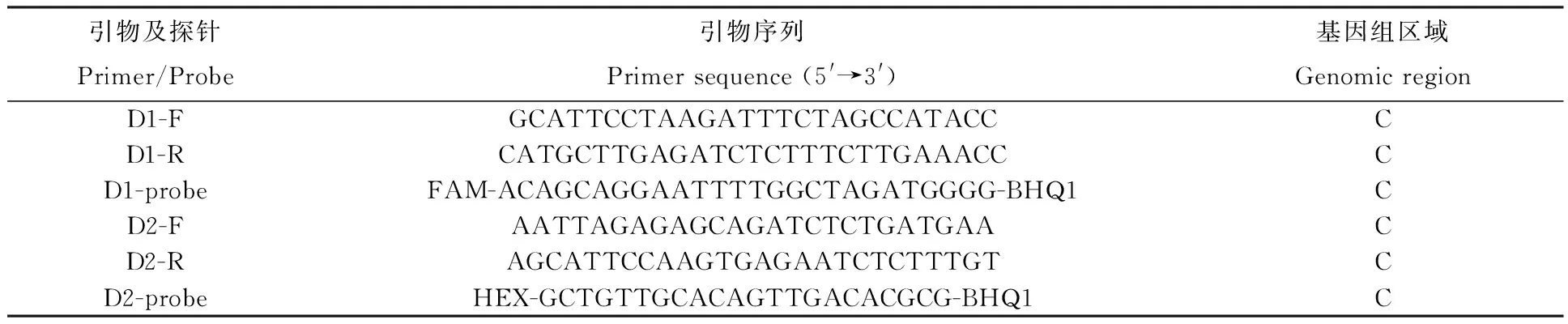
表1 登革1型和2型病毒的引物及探针序列
1.4 阳性模板核酸的制备
取1×108copies/μL 含目的基因扩增序列的登革1型和2型病毒基因重组质粒,按10倍倍比稀释,分别获得1×108~1×101copies/μL的检测样品。
1.5 一步法实时荧光定量PCR反应
反应体系:PremixExTaqTM(Probe qPCR),Bulk 15 μL、RNaseOUTTMRecombinant Ribonuclease Inhibitor 0.3 μL、MuLV Reverse Transcriptase 0.3 μL、登革1型和2型病毒的上、下游引物(50 μmol/L)各0.2 μL、登革1型和2型病毒的探针(50 μmol/L)各0.2 μL、ddH2O 3.2 μL、模板核酸10 μL。反应条件是:50 ℃ 30 min;95 ℃ 15 min,95 ℃ 15 s,60 ℃ 45 s,共40 个循环,分别根据FAM和HEX 荧光信号判定结果。
1.6 一步法实时荧光定量PCR方法的特异性和敏感性测试
用上述建立的一步法实时荧光定量PCR方法检测登革1~4型病毒、黄热病毒及甲型H3N2流感病毒的RNA,用于检验特异性;检测登革1型和2型病毒浓度为1×108~1×101copies/μL基因重组质粒,确定该方法的最低检测拷贝数;基因重组质粒按1×108~1×102copies/μL稀释,实验重复3次,计算3次之间的平均CT值及各梯度浓度的变异系数,检验稳定性。
1.7 混合感染登革1型和2型病毒样本的制备及检测
BHK-21细胞接种到12 孔板中培养至单层,将制备好的登革1型和2型病毒悬液分别按10 倍梯度等比稀释,按0.2 mL/孔接种到12孔板中,15 min/次进行摇匀,37 ℃孵育1.5 h,加入1 mL 2%低熔点琼脂与2×DMEM培养基混合物(1∶1)覆盖,待凝固后置培养箱继续培养,6 d后用结晶紫染色后计算空斑数。
C6/36细胞按2.5×105/孔转移到6孔板中,28 ℃ 5 % CO2培养24 h后接种病毒,实验分为3组:登革1型病毒感染组、登革2型病毒感染组、登革1型和2型病毒混合感染组。每组按感染复数MOI=1(2.5×105PFU/孔)接种病毒,37℃ 5%CO2,培养箱内孵育1.5 h后吸出病毒悬液上清,RPIM 1640培养液清洗两次,然后加入2 mL 2%FBS的RPIM 1640培养液培养36、48、60、72、84、96、120 h后吸取100 μL病毒上清, -80 ℃保存备用, 取样后加入100 μL的维持液于各培养孔内补齐至2 mL,实验重复3次。按照RNA提取试剂盒说明书提取收集的病毒上清RNA,用上述建立的一步法实时荧光定量PCR方法检测C6/36混合感染登革1型和2型病毒后不同时间的病毒拷贝数。
1.8 统计分析
应用SPSS 19.0软件,采用配对t检验,分别分析登革1型和2型病毒单独感染和混合感染时不同时间点样本的拷贝数之间有无差异。
2 结果
2.1 一步法实时荧光定量PCR方法的特异性
用上述建立的一步法实时荧光定量PCR法检测登革1~4型病毒、黄热病毒及甲型H3N2流感病毒的RNA,结果只有登革1型和2型病毒出现典型的S型扩增曲线,黄热病毒及甲型H3N2流感病毒未出现扩增曲线,特异性较好(图1)。
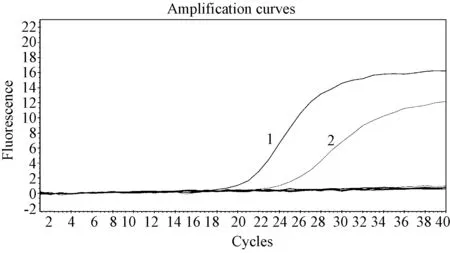
图1 登革1型和2型病毒的扩增曲线Fig.1 Amplification curves of DENV-1(FAM) and DENV-2(HEX) 1. DENV-1; 2. DENV-2.
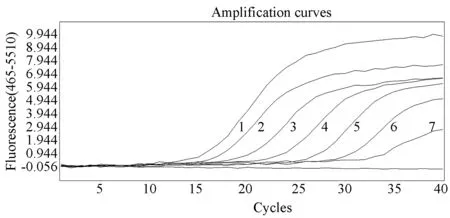
图2 不同稀释度登革1型病毒阳性模板核酸的扩增曲线Fig.2 Amplification curves of DENV-1 RNA positive standards at different dilution rates 1∶1×108;2∶1×107;3∶1×106;4∶1×105;5∶1×104;6∶1×103;7∶1×102.
2.2 一步法实时荧光定量PCR方法的灵敏度和重复性
用上述建立的一步法实时荧光定量PCR检测登革1型和2型病毒基因重组质粒,拷贝数分别为1×108~1×101copies/μL,结果显示登革1型和2型病毒的最低检测限度均为1×102copies/μL(图2, 3)。登革1型病毒标准曲线(图4)的斜率为-3.41,相关系数0.993,登革2型病毒标准曲线(图5)的斜率为-3.280,相关系数0.995,均具有良好的线性关系。上述1×108~1×102copies/μL浓度梯度的基因重组质粒不同时间重复检测3次,登革1型病毒的变异系数在0.22%~1.45%之间(表2),登革2型病毒的变异系数在0.21%~0.70%之间(表3),该方法检测的重复性较好。
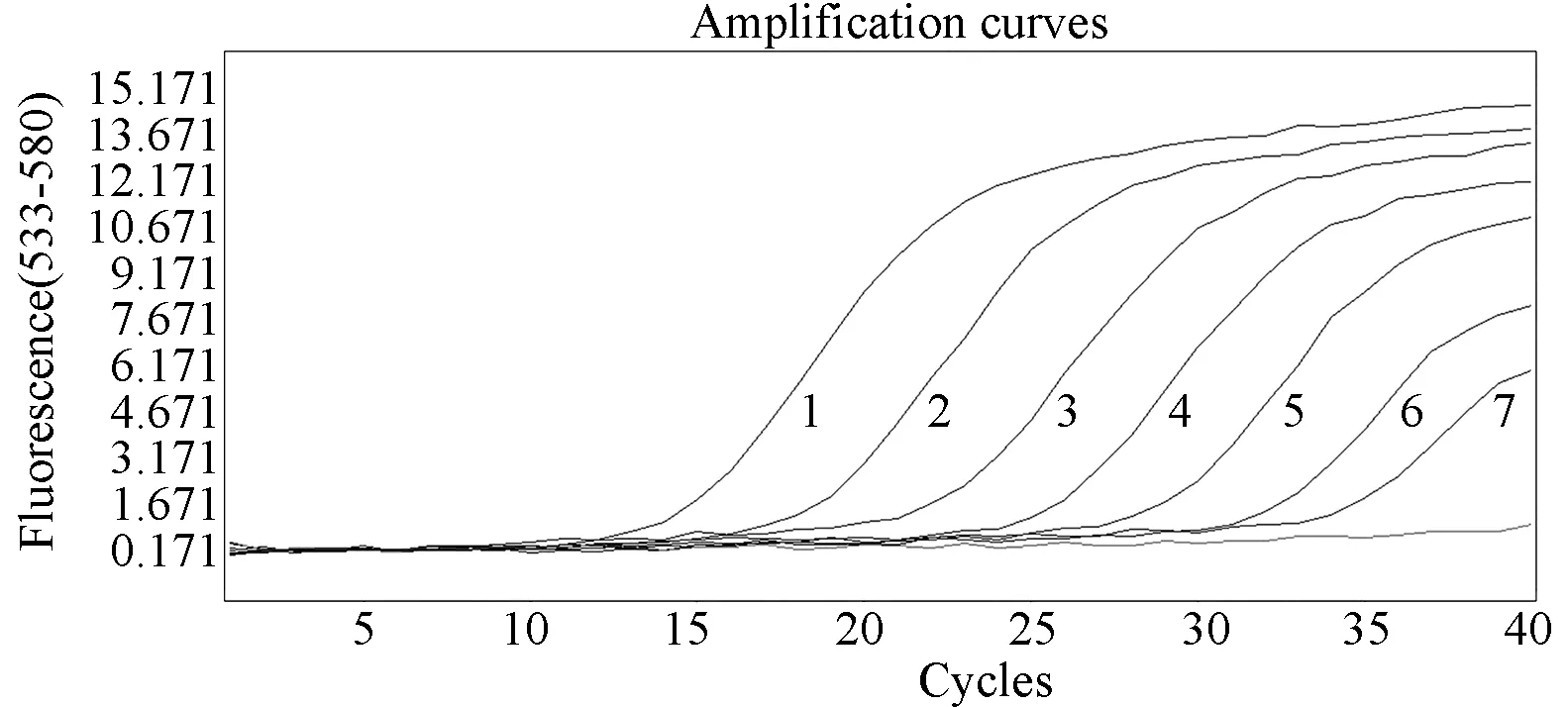
图3 不同稀释度登革2型病毒阳性模板核酸的扩增曲线Fig.3 Amplification curves of DENV-2 RNA positive standards at different dilution rates1∶1×108;2∶1×107;3∶1×106;4∶1×105;5∶1×104;6∶1×103;7∶1×102.
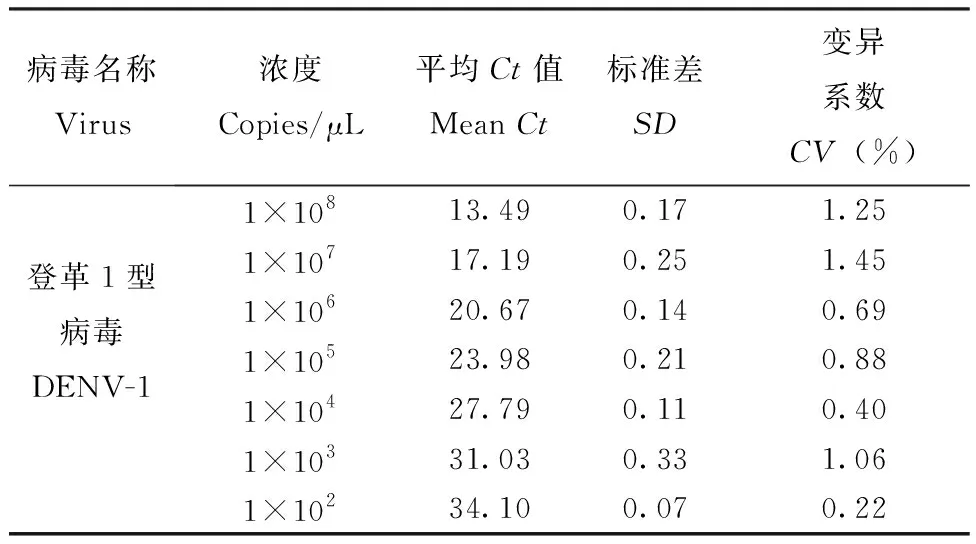
表2 登革1型病毒检测时各梯度浓度的Ct 值及变异系数Tab.2 Ct value and coefficient of variation of each concentration of DENV-1
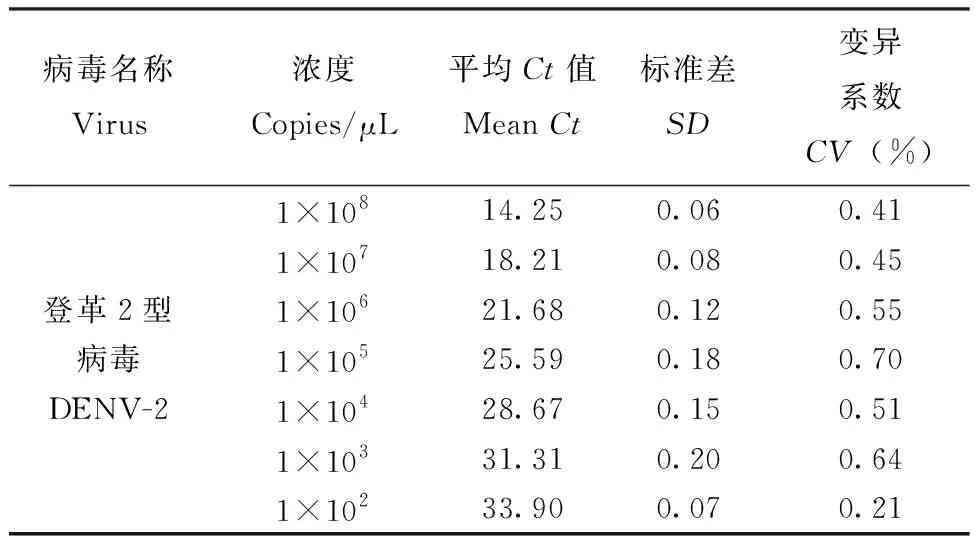
表3 登革2型病毒检测时梯度浓度的Ct值及变异系数
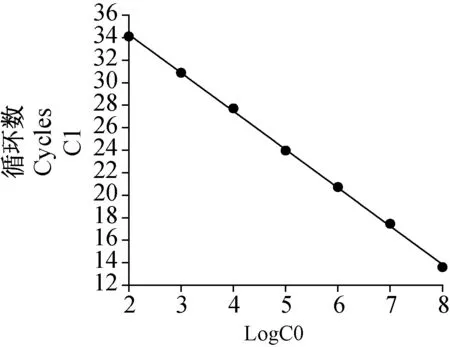
图4 不同稀释度登革1型病毒阳性模板核酸的标准曲线Fig.4 The standard quantitative curve of DENV-1 RNA positive standards at different dilution rates
2.3 C6/36混合感染登革1型和2型病毒后病毒复制动态检测
根据上述建立的方法,检测两个不同血清型登革病毒混合感染C6/36细胞后不同时间点病毒拷贝数的变化(图6)。三次重复的变异系数最大值为14.68%(<15%),可认为具有较好的重复性,结果可行。使用配对t检验:登革1型和2型病毒混合感染C6/36细胞后,登革1型病毒的拷贝数与单独感染的拷贝数相比,无显著差异,使用配对t检验,在36~60 h时,登革1型和2型病毒混合感染C6/36细胞后,登革2型病毒的拷贝数与单独感染C6/36细胞的拷贝数相比无显著差异,在72 h时,混合感染时登革2型病毒的拷贝数与单独感染时相比显著下降(t=5.161,P=0.036),同样的,在84~120 h时混合感染时登革2型病毒的拷贝数与单独感染时相比显著下降。
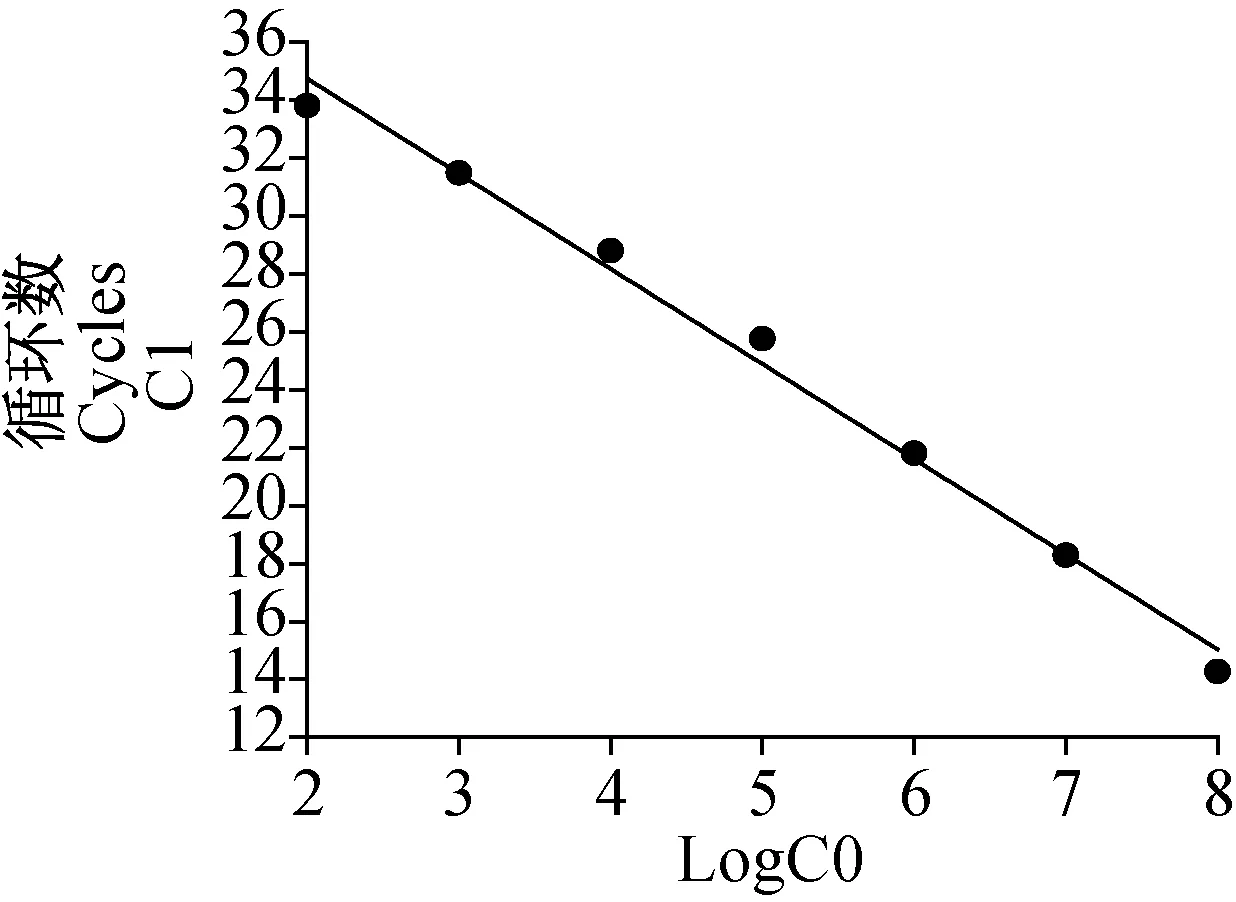
图5 不同稀释度登革2型病毒阳性模板核酸的标准曲线Fig.5 The standard quantitative curve of DENV-2 RNA positive standards at different dilution rates
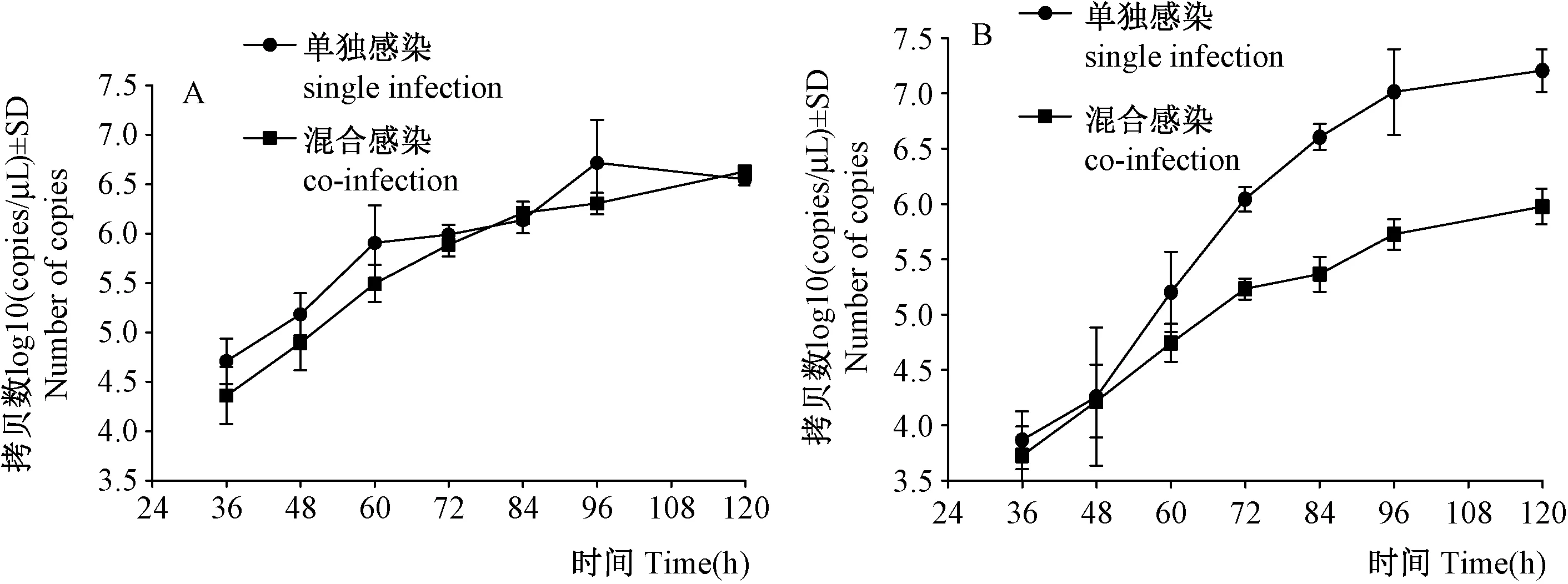
图6 登革1型和2型病毒单独与混合感染C6/36细胞的复制动态Fig.6 The replication capicity of DENV-1 and DENV-2 when infected C6/36 cells singly and simultaneouslyA. 登革1型病毒单独与混合感染C6/36细胞时的复制动态;B.登革2型病毒单独与混合感染C6/36细胞时的复制动态。A. Replication capacity of DENV-1 in C6/36 cells when infected with DENV-1 singly and DENV-1, DENV-2 simultaneously; B. The replication capacity of DENV-2 inC6/36 cells when infected DENV-1 singly and DENV-1, DENV-2 simultaneously.
3 讨论
近年来,随着登革热流行范围的扩大,不同血清型登革病毒输入到已有登革热流行的区域,导致同时存在多个血清型登革病毒流行的地区增多,致使多个血清型登革病毒混合感染患者逐年增长并伴随着重症登革热患者人数的增加,使得多个血清型病毒混合感染病例的诊断和预防面临挑战(Anoopetal.,2010)。因此,建立快速、准确的实验室诊断方法对登革热患者的诊断和疫情控制具有重大意义。实时荧光定量PCR技术因灵敏性与特异性高且可定量等优势而被广泛应用于各种病原体检测(侯美如等,2013),其中多重荧光定量PCR因能够分型且减少操作带来的污染等特点,在许多领域得到了应用。
本研究分别针对登革1型和2型病毒C基因的保守区设计合成引物和探针,建立了一步法实时荧光定量PCR检测方法。该检测方法是特异的,可检测出登革1型和2型病毒,且和登革3型、4型病毒以及黄热病毒、流感病毒均无交叉反应,可用于登革病毒的检测及分型,对登革1型和2型病毒的最低限度均为102copies/μL,灵敏度较高,重复性好。该方法,可用于登革热患者的早期诊断。与ELISA(Waggoneretal.,2013)等其他方法相比,操作简便,耗时较少。同时,该方法可一次性检测混合感染登革1型和2型病毒的样本,并可对病毒拷贝进行定量,为登革热的诊断和预测提供技术支撑。

