埃及伊蚊表皮结构基因AaCPR100A序列特征和表达特性分析*
陈 静 张 磊 卢浩然 从军灏 商子昂 廖承红 韩 谦
(海南大学热带农林学院,海南海口 570228)
昆虫表皮由蜡质层和几丁质层组成,具有抵御病原体入侵和不利环境伤害,支持和维持身体活动的重要作用。研究表皮合成机制,寻找干扰昆虫表皮合成的方法,可用于控制害虫 (Charles, 2010)。迄今为止,表皮蛋白(cuticular protein, CP)被分为13个不同的蛋白家族(Willis, 2010; Ioannidouetal., 2014; Liaoetal., 2017)。最大的家族是CPR家族,包含RR氨基酸序列,CPR家族可分成3个亚族,RR-1、RR-2和RR-3(Andersen, 1998, 2000; Karouzouetal., 2007)。普遍把RR-1型的CPR归类于柔性表皮。但也有例外,发现RR-1基序在昆虫表皮中参与成虫蜕变时刚性表皮的分化(Soaresetal., 2007)。RR-2基序蛋白主要分布在硬表皮(Vanninietal., 2017),RR-3比较少见,目前还没有精确的定义(Andersen, 2000; Futahashietal., 2008; Willis, 2010)。埃及伊蚊Aedesaegypti是一种广泛分布于全球热带地区的重要媒介蚊虫,传播登革热和城市型黄热病等疾病,是国际公认最危险的蚊虫之一。对埃及伊蚊表皮蛋白的研究,不仅可揭示其表皮发育和形成机制,还能为传染病防治提供理论指导。
本研究拟对埃及伊蚊表皮发育过程差异基因AaCPR100A(AAEL003049)进行生物信息学分析和表达模式分析,旨在为深入研究该基因在表皮形成过程中的功能及作用机制奠定基础。
1 材料与方法
1.1 供试蚊虫
埃及伊蚊Ae.aegypti(利物浦株系)由军事医学研究院微生物流行病研究所提供,饲养条件为: 室温 26 ℃±1 ℃、相对湿度 60%±5%、光周期为14 L∶ 10 D (光照: 黑暗)。幼虫以老鼠饲料饲养,成虫以8% 糖水饲养。
1.2 生物信息学分析
利用BLAST对AaCPR100A氨基酸序列进行序列分析,构建该蛋白与其他昆虫的系统发育关系,并分析其同源性(http://www.ncbi.nlm.nih.gov)。在线分析AaCPR100A的分子量、氨基酸组成(ExPASy,http://us.expasy.org)和信号肽位点(SignalP4.0,http://www.cbs.dtu.dk)(Bendtsenetal., 2004)。运用ScanProsite(http://prosite.expasy.org)(de Castroetal., 2006)分析该蛋白基序。在埃及伊蚊基因组上进行blast(http://www.vectorbase.org)分析,确定该基因的内含子和外显子。采用ClustalX(vesion 1.83)(Thompsonetal., 2002)软件与冈比亚按蚊Anophelesgambiae、白纹伊蚊Ae.albopictus、致倦库蚊Culexquinquefasciatus和果蝇Drosophilamelanogaster的基因序列进行比对,MAGA6.0软件(Tamuraetal., 2013)的邻接法构建系统发育树。
1.3 总RNA提取和反转录
蚊虫所有龄期样品为4个生物学重复,每个重复的样品数目为:卵20只,1龄幼虫20只,2龄幼虫20只,3龄幼虫10只,4龄幼虫10只,蛹期5只,雄虫5只和雌虫5只。解剖雌性成虫获得的头、胸、中肠和表皮为4个生物学重复,每个重复的样品数目为10只。
采用磁珠法提取RNA,所用的磁珠通过0.1%的DEPC水溶液处理过夜后用灭菌锅消毒。取埃及伊蚊的4个发育时期(成虫、蛹、幼虫、卵)和4个不同组织(头、胸、中肠、皮)样品,分别加入200 μL的Trizol裂解液(InvitrogenTM)和适量的磁珠,放入研磨器中打磨4 min,使细胞充分裂解,提取样品的总RNA;为了避免基因组DNA对定量结果的影响,利用TakaRa公司的PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒对RNA进行去基因组DNA的处理,并进行总RNA反转录。
1.4 荧光定量PCR检测不同发育阶段和组织中的表达量
以埃及伊蚊的3-磷酸脱氢酶基因GAPDH(XM_011494724)为内参基因,采用qRT-PCR检测AaCPR100A基因在不同发育时期和不同组织的表达特征。根据AaCPR100A和GAPDH序列自行设计定量引物,见表1。
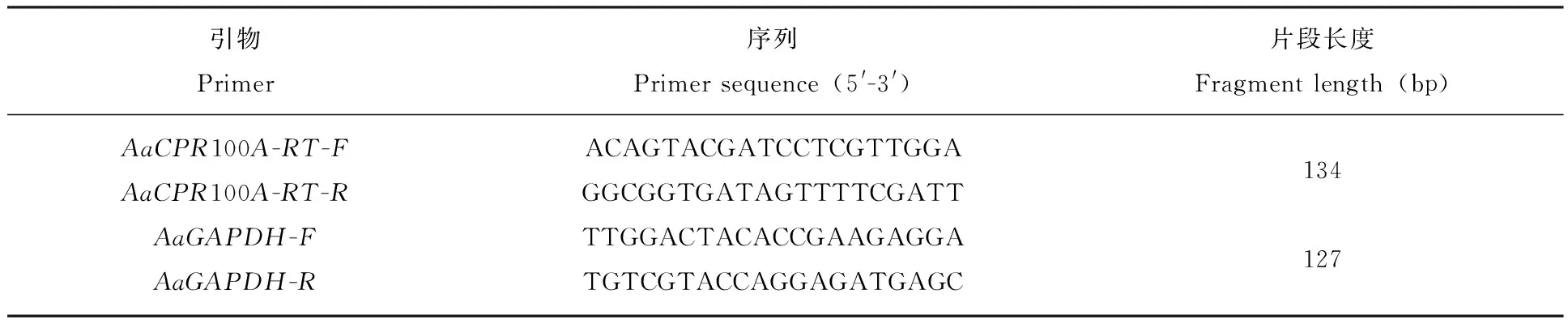
表1 引物序列
荧光定量PCR反应体系为:cDNA 2 μL;2×SYBR premix Ex TaqTM10 μL;PCR forward/Reverse primer(10 μmol/L)各0.4 μL;DEPC水6.8 μL。使用Roche公司的LightCycler96进行实时扩增检测。反应采用两步法PCR扩增标准程序:95 ℃ 20 s;95℃5 s;58 ℃ 30 s,共40个循环。
根据各组扩增的CT值,采用定量PCR仪数据处理程序,以2- △△ Ct法(Livaketal., 2001)分析基因表达水平计算样品间基因表达量的差异倍数,根据数据做柱形图。采用 SPSS13.0统计学软件方差分析(ANOVA)(Tamuraetal., 2013)进行数据的统计,采用 LSD 法进行多重比较检验,显著性检验水平P<0.05。
2 结果
2.1 埃及伊蚊AaCPR100A的序列特征和同源性分析
根据埃及伊蚊AaCPR100A的cDNA序列在埃及伊蚊基因组上的信息,克隆得到该基因的开放阅读框,其cDNA编码区全长765 bp,编码254个氨基酸,推测其蛋白分子量为28.6 kDa。氨基酸分析结果显示AaCPR100A蛋白含有19种不同的氨基酸组成,其中谷氨酰胺占15.4%、脯氨酸占11.4%,丙氨酸11%。蛋白结构域分析表明,进行Blastp检索和ScanProsite工具检索,AaCPR100A有一个Chitin-binding type R&R domain,位于蛋白的40~101位氨基酸(图1)。N末端具有信号肽,约为16个氨基酸。
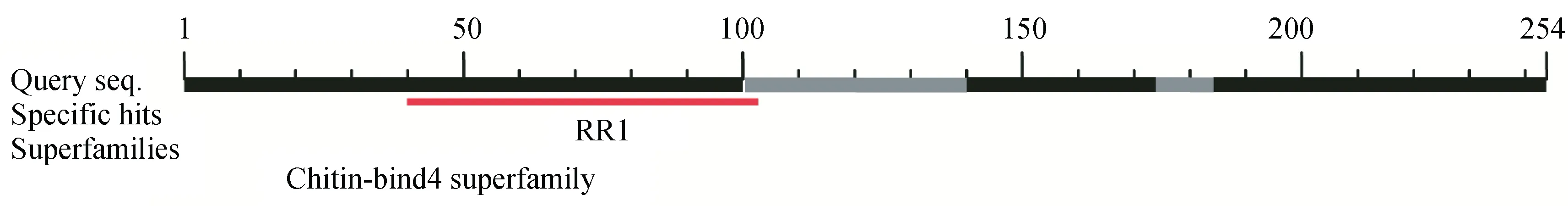
图1 AaCPR100A的蛋白结构域分析Fig.1 Protein domain analysis of AaCPR100A in Aedes aegypti
将AaCPR100A的氨基酸序列在NCBI数据库中进行同源序列比对分析,发现与白纹伊蚊、淡色库蚊、冈比亚按蚊和果蝇的相似性分别为95%、72%、61%、54%。采用Clustal进行多序列比对,结果显示保守区段主要集中在Chitin-binding type R&R结构域。利用clustal1.81 软件和MEGA7.0.26 软件以NJ法生成系统进化树进行Bootstrap 检测。结果显示,在分析的所有序列中,AaCPR100A与白纹伊蚊的进化地位最接近(图2)。
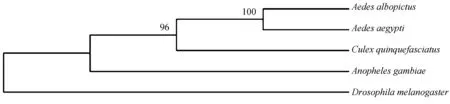
图2 AaCPR100A与其他物种的CPR100A氨基酸序列系统进化树分析Fig.2 Phylogenetic tree of Aedes aegypti and other species based on the amino acid sequences of their AaCPR100A
2.2 AaCPR100A基因的组织表达特性
以3-磷酸甘油醛脱氢酶GAPDH基因为内参,分别对埃及伊蚊头、胸、中肠和表皮以及不同发育阶段的表达水平进行定量PCR检测。组织定量结果表明AaCPR100A在4种组织中均有表达,但相比头部,在表皮中的表达丰度值达到42倍,其次在中肠中表达为2倍,脑的最低。由此可见,该基因的表达具有显著的组织差异性,在表皮中表达丰度最高(图3)。
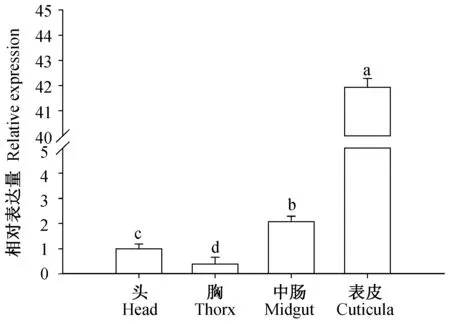
图3 成虫不同组织AaCPR100A的表达情况分析Fig.3 Expression patterns of AaCPR100A in different tissues of of Aedes aegypti三次独立实验统计分析,数据是平均值±SE;柱上标有不同字母表示显著性差异(P<0.05)。Data are mean±SE; Histograms with different letters indicate significant difference (P<0.05).
在不同发育阶段,AaCPR100A的表达呈现出显著差异性(图4)。随着发育阶段的推移,该基因的表达量呈减少趋势。卵的表达量与其他发育阶段具显著性差异,表达量最高,从2龄幼虫开始,与雄性成蚊的表达量相当。而雌性成蚊的略有所增加(图4)。该结果说明AaCPR100A的表达具有明显的发育阶段特异性,可能对于蚊虫早期表皮的形成起到重要的作用,并且可能与雌性成蚊腹部存储血液相关。
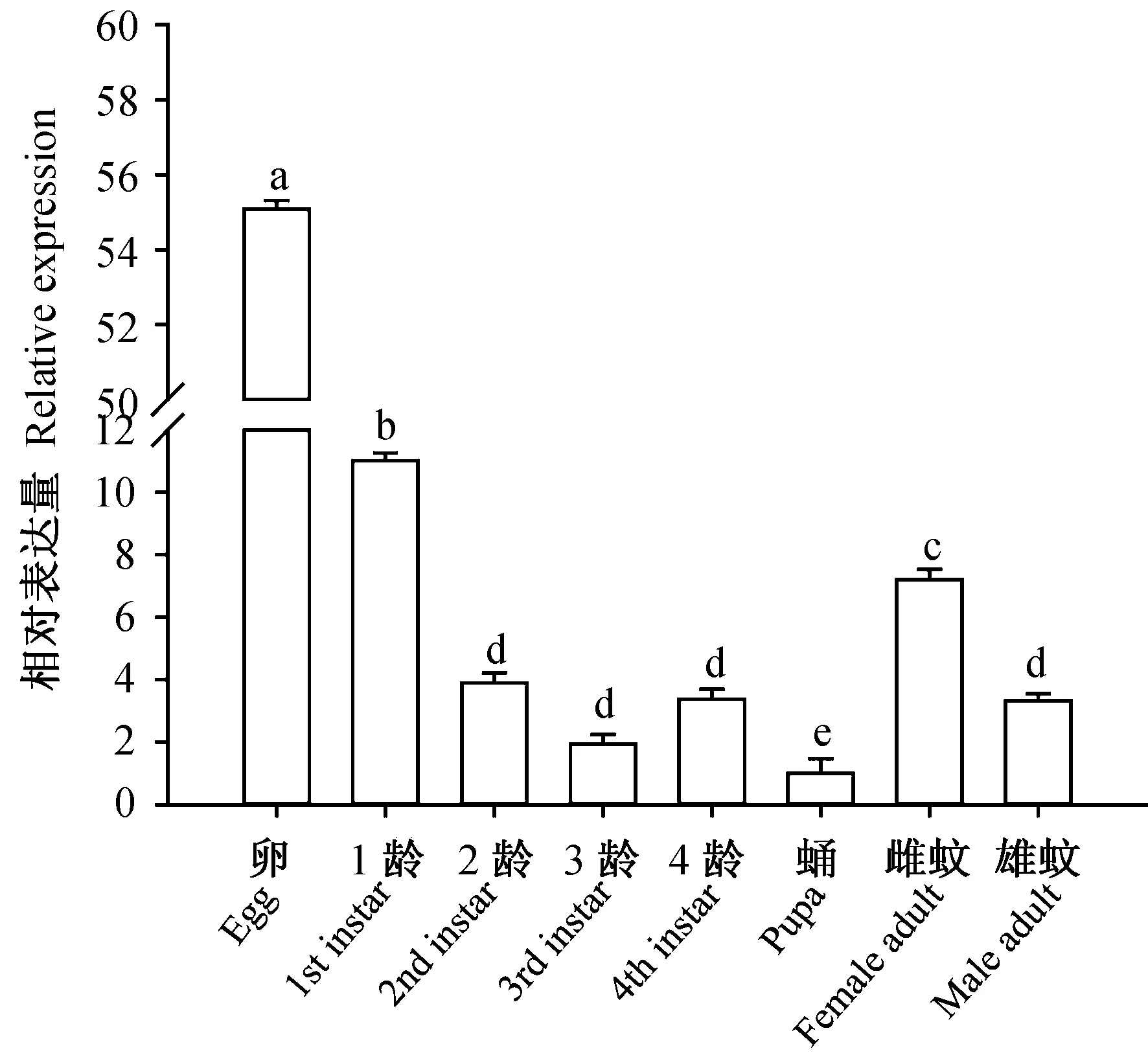
图4 AaCPR100A在埃及伊蚊不同龄期的表达量Fig.4 Expression of AaCPR100A in the different stages of Aedes aegypti数据是平均值±SE; 柱上标有不同字母表示显著性差异(P<0.05)Data are mean±SE; Histograms with different letters indicate significant difference (P<0.05).
3 讨论
昆虫表皮是昆虫抵御外界不良环境的第一道防线,独特的表皮是各种昆虫能成功生存于生物圈中的重要机理之一,不同的发育阶段均会产生新的表皮,且以不同的形式分布在昆虫身体内外,从本质上确保了昆虫的成功进化,反之昆虫表皮的独特性也使其成为杀蚊剂和虫媒控制的靶标(Luzetal., 2005)。
同时,表皮也是蚊虫抗药性形成的重要屏障。研究发现,在抗吡虫啉杀虫剂的幼虫和成虫中,AaCPR100A基因的表达均比敏感型虫体的表达高,幼虫比成虫的表达更显著(Riazetal., 2013)。抗氯菊酯类杀虫剂的库蚊Cx.quinquefasciatus品系表皮中有两个蛋白表达上调,分别属于RR-2和CPLC类型(Reidetal., 2012)。电镜扫描结果显示不吉按蚊Anophelesfunestus对卞氯菊酯产生抗性后,表皮增厚,药物穿透能力明显减弱,同时还发现抗性雌蚊的表皮厚度比抗性雄蚊表皮厚(Woodetal., 2010)。综合以上研究,表明昆虫可能会通过上调表皮蛋白基因的表达来合成更多的表皮蛋白,用以增厚表皮,减少杀虫剂向体内渗透,以提高其抗药性。对埃及伊蚊表皮基因的研究,将有助于我们了解这类基因在蚊虫柔性表皮发育及在雌性成蚊中的功能,并为其最终应用于蚊虫的生物防控提供了理论根据。
根据埃及伊蚊蛋白数据库,已发现成蚊和蛹的表皮蛋白分别有32和60个被命名,也有许多蛋白被标记为假定的表皮蛋白(Neneetal., 2007)。另外,一些预测蛋白被归类为柔性或刚性表皮蛋白。表皮蛋白和几丁质在不同特性和皮层中分布不同,由于几丁质分子链长和乙酰化程度的差异较小,因此表皮蛋白基因种类和数量的变化成为影响表皮结构及其机械性能的重要因素,表皮蛋白也被认为是昆虫重要的结构蛋白(Andersenetal., 1995; Liaoetal., 2017)。本研究基于前期研究的基础,对AaCPR100A基因的序列和时空表达分析,发现该基因在蚊虫的卵期发育过程转录水平明显高于幼虫和成虫期,雌性成蚊高于雄性成蚊,并具有一定的组织特异性,这可能不仅参与了蚊虫早期表皮结构的形成,而且在雌性成虫中也发挥重要作用。根据结构域的分析,AaCPR100A具有CPR家族中的RR-1基序,而RR-1亚族表皮蛋白首先是从柔性表皮中分离得到,现在普遍把RR-1型的CPR归类于柔性表皮。雌性蚊子的腹部往往需要能容纳下与其体重等同的血液,因此,形成具有保护作用的高度弹性的表皮对它尤其重要。因此,我们推测AaCPR100A可能参与了蚊虫柔性表皮的形成,这将在之后的功能研究中进一步探讨。

