DH71CRP全血血细胞分析仪的性能评价
宿亚菲,孙雯雯,张乐,陈冬哲,王召宝,邢芳琳,王秀芹,刘玲玲
1. 济宁医学院 医学信息工程学院 生物医学工程专业 2015级,山东 日照 276826;2. 山东大学附属省立医院 临床医学检验部,山东 济南 250021
引言
全血细胞分析仪目前是国内外全血血液分析最常用的筛检仪器之一,DH71CRP(帝迈,深圳)是一款设置有微量末梢全血、静脉全血、预稀释三种检测模式,具有双通道白细胞五分类及异常细胞筛选功能和全血CRP定量检测的全自动血液分析仪。末梢全血模式用血量仅20 μL即能完成血细胞计数、形态学五分类和全血CRP定量测定,用时1 min。因其用血量少、检测时间短、采用HCT校正技术,能够实现全血CRP结果的个体化校正,全血CRP结果与血清有很好的相关性,试剂成本低,现已成为儿童医院、大型综合医院急诊儿科化验室不可或缺的设备之一,尤其适合标本量较大的、对TAT时间要求高、对检验结果准确度要求高的临床检验医学实验室。根据ISO15189文件CNAS CL02医学实验室质量和能力认可准则(ISO15189:2012)的要求,参考卫生行业标准WS/T406-2012《临床血液学检验常规项目分析质量要求》[1],按照NCCLS EP5-A2[2]、EP15-A2[3]、EP6-P2[4]、EP9-A2[5]、EP10-A2[6]文件要求,参考全血血液分析仪性能验证的文献资料[7-14],对本实验室新安装的DH71CRP全血血细胞分析仪检测系统或方法的主要分析性能参数进行验证和评价。
1 资料与方法
1.1 试剂与仪器
1.1.1 验证仪器及参比仪器
验证仪器为DH71CRP全血血细胞分析仪,参比仪器为Sysmex XE-2100全自动五分类血细胞分析仪(参加国家卫计委临床检验中心室间质评,成绩合格)。
1.1.2 试剂
原装配套试剂(DIL-A稀释液, 批号:20170624,有效期:20190623; LYA-1溶血剂,批号:20170415,有效期:20190414; LYA-2溶血剂,批号:20170221,有效期:20190220;LYA-3溶血剂,批号:20170418,有效期:20190417;校准品,CBC-CAL PLUS/DM-CAL PLUS,批号:PLUS0917,有效期:20171005;质控品为血液学五分类X非定值质控品PRETROL BLOOD(批号:662290;有效期:20170717);Sysmex原装配套试剂(在效期内)、质控品e-CHECK(XE)ASSAY(批号:71340800;有效期:20170806)。
1.2 标本来源
所有检测标本选择2017年6月20日至7月12日就诊的门诊,住院患者和健康体检人员的EDTA抗凝全血标本。
1.3 方法
性能验证指标:精密度(批内、批间)、准确度、可比性、线性范围、临床可报告范围、携带污染率、不同进样模式间比对、仪器白细胞五分类性能。
1.3.1 仪器校准
由资深的工程师按DH71CRP SOP、参考WS/T347-2011《血细胞分析的校准指南》,使用合格的全血校准品进行仪器血常规各参数的校准,校准结果符合厂家声明和指南要求。
1.3.2 本底(空白)检测
用仪器配套稀释液作为标本,在仪器选定的检测模式下计数3次,测得结果为该种检测模式当前状态下的空白计数结果。若开机本底未达到要求者,必须经厂家售后服务工程师检修合格后才能做余下相关测试。
1.3.3 携带污染率测定
根据EP10-A2取高浓度全血标本,连续测定3次,测定值分别为 H1、H2、H3;再取低浓度全血标本,连续测定3次,测定值分别为L1、L2、L3。按公式计算携带污染率。
1.3.4 精密度验证
根据WS/T406-2012和EP5-A2、EP15-A2文件,参照厂家声明的CV进行验证。
(1)批内精密度。取高、中、低3个水平的新鲜全血,连续重复测定21次,取后10次结果计算变异系数(CV)和标准差(S);将实验所得的CV值与仪器厂家声明的CV值进行比较。
(2) 批间精密度。取高、低两个水平质控品,每天测定3次,每次检测之间相隔2 h,连续测定5 d,一共收集15个数据,如果因为质量控制程序或操作问题判断一次为失控,应剔除数据,并增加执行一次检测;计算CV和S。实验所得的CV值应符合WS/T406-2012批内、批间精密度评价标准,CV小于或等于各指标精密度评价标准判为合格。
1.3.5 准确度验证
本研究参考WS/T407-2012[15]《医疗机构内定量检验结果的可比性验证指南》,按照EP9-A2文件验证方案:用临床标本通过系统间的比对进行偏倚评估来进行准确度验证。选取10份当日采集的、各验证指标结果分布在参考范围内的的患者血液标本,同时在参比仪器和验证仪器上进行2次检测,取均值,同一标本在两检测系统之间的检测时间之差不超过4 h。

偏倚符合WS/T406-2012对准确度验证偏倚要求。
1.3.6 线性范围验证
参照WS/T408-2012[16]要求,参照EP6-A2文件,由于全血血液标本选取高值和低值样本的不可混合性的特殊性,本试验选取1份接近预期上限的高值全血标本,与仪器配套的稀释液进行混合配制,分别按100%,80%,60%,40%,20%,10%(当需要时),5%(当需要时)的比例进行稀释,每个稀释度测定1次。将实测值与理论值作比较(偏离应小于10%),计算Y=aX+b,验证线性范围。判定标准:a值在1±0.05范围内,相关系数r≥0.975或r2≥0.95为可接受。
1.3.7 仪器白细胞五分类的比对与验证
(1)形态学正常的白细胞仪器五分类的结果比对与验证。取20份非血液科非肿瘤科住院患者的EDTA-K2抗凝血,每份标本分别在两台比对仪器上重复测定2次,取五分类结果均值计算绝对偏差。同时每份标本制备血片2张,分别由2位具备资格的检验人员在油镜下选择体尾交界处,分类计数200个白细胞,共400个,取均值与DH71CRP仪器五分类均值结果进行比对[14]。
(2)形态学异常的白细胞仪器五分类验证。取20份血液科或肿瘤科住院患者的EDTA-K2抗凝全血,验证步骤同1.3.7中的步骤(1),取均值与DH71CRP仪器五分类均值结果进行符合度验证[17]。
1.3.8 不同进样模式间的比对结果验证
仪器校准后,取5份临床样本分别使用两种进样模式检测,每份样本各检测2次,分别计算两种模式下检测结果均值间的相对偏差,结果应符合卫生行业标准的判断标准要求。
1.4 数据处理
采用Excel 2003软件进行数据分析,对各指标的检测结果分别计算算术平均值、S及相对偏差,可比性和线性验证计算回归方程Y=aX+b和r。
2 结果
2.1 本底计数
经过用稀释液作为样本连续检测3次,WBC、RBC、HGB、PLT最大值均为0,满足WS/T 406-2012。
2.2 携带污染率
DH71CRP全血血液分析仪测定WBC、RBC、PLT、Hb的携带污染率均远低于判定标准的要求,见表1。

表1 携带污染率验证结果
2.3 精密度验证
WBC、RBC、PLT、Hb、MCV的批间、批内精密度验证结果均低于判定标准,见表2,满足WS/T406-2012的要求。
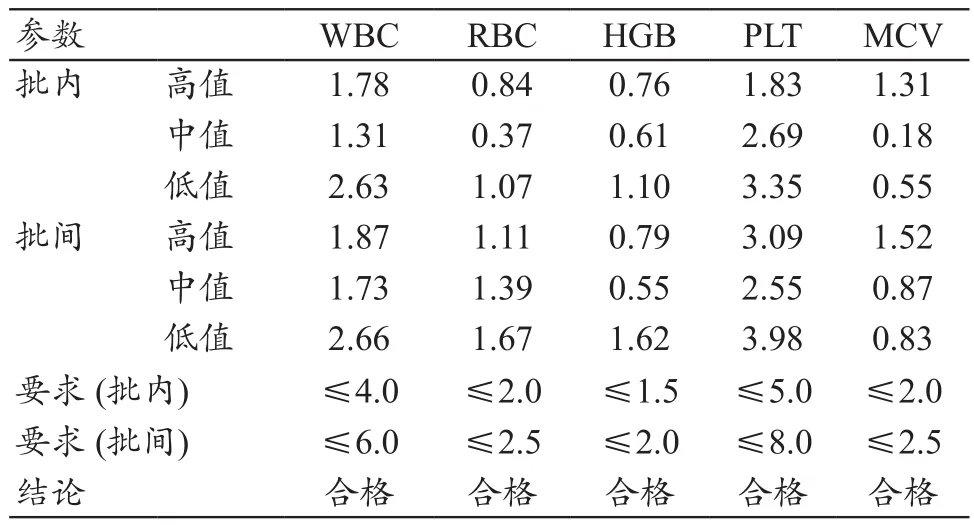
表2 批内以及批间精密度验证结果(%)
2.4 准确度验证
通过对比试验,DH71CRP与参比仪器测定结果进行均值偏倚计算,符合行业标准要求的数据达到80%即判断为合格。见表3。
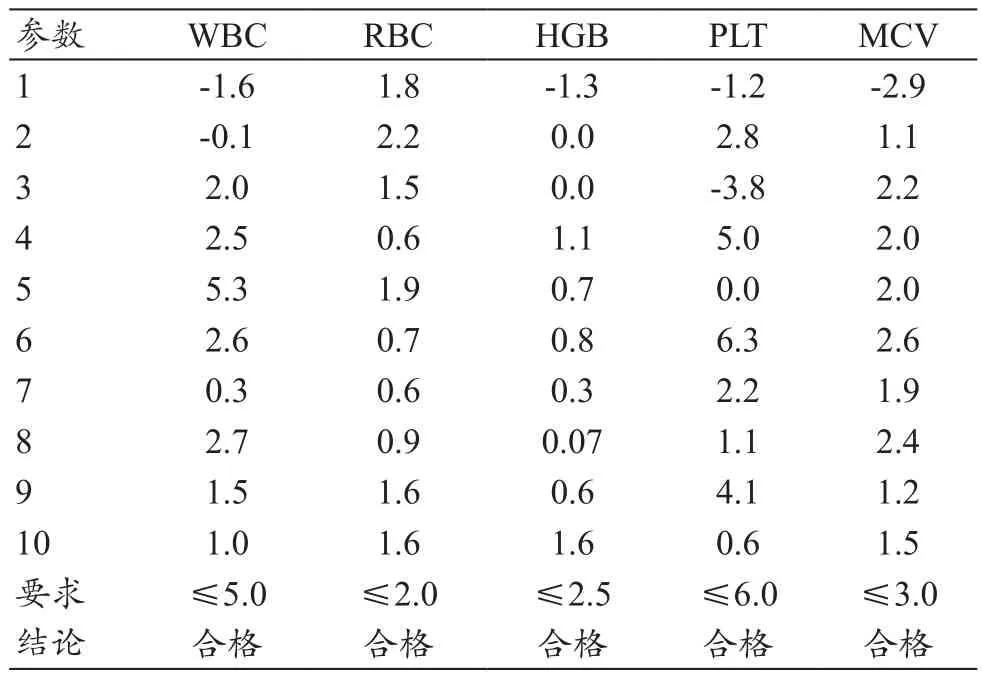
表3 准确度验证结果(%)
2.5 线性验证
WBC、RBC、Hb、HCT和PLT线性方程及线性范围,见表4,各检测项目的线性验证结果均符合合格的判定标准。

表4 线性验证结果
2.6 仪器白细胞五分类的比对与验证
(1)形态学正常的白细胞仪器五分类验证结果,见表5。取20份非血液科非肿瘤科住院患者的EDTA-K2 抗凝血,每份标本分别在两台比对仪器上重复测定2次,取五分类结果均值计算绝对偏差。同时每份标本制备血片2张,分别由2位具备资格的检验人员在油镜下选择体尾交界处,分类计数200个白细胞,共400个,取均值与DH71CRP仪器五分类均值结果进行比对。仪器间结果比对,见表5,与人工显微镜检分类有很好的一致性。

表5 形态学正常的白细胞仪器五分类结果的比对表(%)
(2)形态学异常的白细胞仪器五分类验证结果,见表6。取20份血液科或肿瘤科住院患者的EDTA-K2抗凝全血,验证步骤同(1),取均值与DH71CRP仪器五分类均值结果进行符合度验证[17]。仪器间结果比对见表6,与人工显微镜检分类有很好的符合性。20例样本说明:有7份 (3、8、9、12、16、17、18号)镜检复合异型淋巴细胞占比分别为6.5%、11%、13%、5.7%、9%、10.5%、7%,两仪器均有报警提示,散点图上也发现有明显的异常荧光区;有5例(1、2、11、13、15号)急性淋巴细胞白血病,镜检复合幼稚淋巴细胞占比12%,66.5%、15%、45%、23%,两仪器均有报警提示,2号DH71CRP散点图上显示淋巴细胞群与单核细胞群分界不清,XE-2100散点图上显示淋巴细胞群与单核细胞群未分类;有3例(5、6、20号)急性髓系白血病镜检复合幼稚细胞占比为23%,45%、35%;3例(4、7、14号)为慢性粒细胞白血病,2例(10、19号)为慢性淋巴细胞白血病。

表6 形态学异常的白细胞仪器五分类结果比对表(%)
2.7 不同进样模式间的结果验证
仪器校准后,取5份临床样本分别使用两种进样模式检测,每份样本各检测2次,分别计算两种模式下检测结果均值间的相对偏差,80%样本WBC、RBC、PLT、Hb、MCV比对的偏差范围结果符合WS/T406-2012的判断标准要求。
3 讨论
CNAS CL02医学实验室质量和能力认可准则(ISO15189:2012)、临床医学实验室管理办法、CAP实验室认证体系、卫生行业标准,都阐述了检测系统性能验证是临床实验室质量管理的重要内容,系统性能良好是保证患者检验结果报告准确、可靠的前提。良好的实验规范在最大程度上可以消除可能影响实验结果的主观和客观因素,减少误差,确保检验结果的准确可靠[18]。实验室在新设备或新试剂在投入使用前必须对其性能包括精密度、准确度、线性及携带污染率等进行验证和评价。
本研究中,DH71CRP全血血细胞分析仪在精密度、准确度、线性、携带污染率、不同模式间的比对、仪器白细胞五分类指标验证均符合要求,线性范围与厂家声明一致,仪器检测的线性范围很宽,完全能满足临床上标本的准确定量分析。特别需要强调的是白细胞五分类验证,无论是白细胞形态学正常还是异常的标本验证中,与XE-2100仪器有很好的可比性,与显微镜人工分类相比,有良好的符合性;对于白细胞形态学异常的标本,仪器也都有报警提示,散点图上也有异常改变。
综上所述,DH71CRP全血血细胞分析仪准确度及精密度良好,携带污染率低,线性范围覆盖临床可能遇到的水平,是一台性能良好的血液分析仪,可用于检验科的日常工作,基本能满足临床患者血液标本分析的需要。但是由于比对的异常样本例数较少,该结果会有偏差,需要在以后的使用中不断丰富病例。但是白细胞五分类的金标准还是人工显微镜检,要求检验人员在日常报告审核工作中,除了关注仪器计数的异常外,应根据本科室制定的复检规则并结合仪器报警提示、散点图等信息[19],在必要时进行人工显微镜复检[20],确保发出的临床报告准确可靠。给临床医师提供更多有价值的信息。

