大蒜多糖对急性酒精性肝损伤小鼠肠道菌群失调的影响
范颖,赵鑫,李娜,吴曼曼,李新莉,*
(1.大连医科大学临床技能中心,辽宁大连116044;2.大连医科大学生物技术系,辽宁大连116044)
酒精性肝损伤是酒精摄入过量(急性)或长期酗酒(慢性)导致的中毒性肝病[1],影响着全世界数百万人口,是导致发病率和死亡率的主要原因[2]。肝脏与肠道之间存在“肠——肝”轴[3],在肝损伤的发生发展机制研究中,肠道菌群发挥着重要作用,肠道与肝损伤之间的相互促进相互影响的关系也逐渐被阐明。如肠道菌群参与酒精的代谢,将乙醇转化为有毒性的、高浓度的乙醛,导致肠道的通透性增加,打破了肠道菌群的平衡,革兰阴性菌过度生长,产生的内毒素诱导肿瘤坏死因子(tumor necrosis factor-α,TNF-α),激活诱导型一氧化氮合酶系统(inducible nitric oxide synthase system,iNOS),加重了肠道的炎症反应,而NO的大量合成又促进了肝脏的氧化应激反应,造成肝脏的进一步损伤[4]。过量饮酒导致的肠道菌群失调,成为酒精性肝病的潜在发病机制,而肠道菌群失调造成内毒素升高也是造成肝脏损伤的重要发病原因。蔡夏夏等[5]研究表明酒精性肝损伤动物肠道菌群改变,出现肝脏脂肪变性及肠道上皮细胞屏障功能障碍等,通过补充天然活性成分能够刺激双歧杆菌等益生菌的生长,具有益生元的作用。Chen等[6]发现肝损伤患者服用乳糖醇可以增加乳酸杆菌和双歧杆菌,抑制条件致病菌的生长而减少内毒素的产生。因此益生菌和益生元具有减轻肝脏的损伤,改善肝脏功能的作用。
大蒜(Allium Sativum L.)为百合科葱属植物的鳞茎,是生活中常用的香辛料和调味品,其主要活性成分为大蒜素和大蒜多糖(garlic polysaccharide,Gp)。大蒜素具有抗菌、调血脂、降血糖、抗肿瘤、抗衰老等功能[7],且对酒精性肝损伤具有保护作用[8]。大蒜多糖来源于大蒜素提取之后的残渣,具有抗病毒、抗氧化、护肝、提高机体免疫力、促进神经细胞生长等作用[9]。
人体肠道细菌以厌氧菌为主,传统的微生物技术仅能反映肠道菌群数目变化这一指标,更有超过70%的肠道菌群无法通过传统的细菌培养方法进行培养和鉴定,不能反映肠道菌群结构的多样性和种群变化,因此,肠杆菌基因间重复共有序列基因扩增(enter obacterial repetitive intergenic consensus-polymerase chain reaction,ERIC-PCR)和聚合酶链式反应——变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)等分子生物学方法被广泛用于菌群结构及种群变化,具有灵敏度高、可重复性、可靠性好,省时省力等优点。
用大蒜多糖对小鼠预防给药30 d,使用56°红星二锅头灌胃小鼠建立急性酒精性肝损伤模型,ERICPCR和PCR-DGGE技术研究大蒜多糖对急性酒精性肝损伤小鼠肠道菌群的影响,分析肠道菌群结构的相似性和多样性,鉴定优势菌属序列。以肠道菌群作为治疗酒精性肝病的潜在作用靶点,初步探讨大蒜多糖预防酒精性肝损伤的可能作用机制,为进一步开发保肝护肝药物提供实验依据。
1 材料与方法
1.1 材料与试剂
新鲜大蒜:市售;护肝片:长春海外制药集团有限公司,批号:Z22020994,规格:0.35g;北京 56°红星二锅头:北京红星股份有限公司;粪便细菌DNA提取试剂盒:成都福际生物技术有限公司;GC-341f(5′-CGCCCGGGGCGCGCCCCGGGCGGGGCGGGGGCACGGGGGGCCTACGGGAGGCAGCAG)、518r(5′-ATTACCGCGGCTGCTGG)、ERIC-1(ATGTAAGCTCCTGGGGATTCAC)、ERIC-2(AAGTAAGTGACTGGGGTGAGCG):英潍捷基上海贸易有限公司;PCR-Mix:大连优萌威贸易有限公司;丙烯酰胺、甲叉双丙烯酰胺、尿素、去离子甲酰胺、琼脂糖、溴化乙锭(EB):大连羽铭生物科技有限公司;DL2000 Marker、DL100 Marker:大连宝生物工程有限公司。
1.2 仪器与设备
UVS-1涡旋振荡器:北京优晟科技有限公司;HC-3018R高速冷冻离心机(离心半径6 cm):安徽中科中佳科学有限公司;JY-spat琼脂糖水平电泳仪、DGGE电泳仪:大连竞迈设备有限公司。
1.3 大蒜多糖的制备
200 g新鲜大蒜提取大蒜素后的残渣,按料液比1 ∶4(g/mL)加入水 800 mL,80℃水浴 2 h,双层纱布过滤,滤液使用旋转蒸发仪减压浓缩至300 mL,加入无水乙醇使其终浓度为70%,4℃过夜,5 000 r/min离心15 min得到白色沉淀,冷冻干燥即得大蒜多糖(Gp)。
1.4 模型建立与分组
SPF级KM小鼠,雌雄各半,体重18 g~22 g,由大连医科大学实验动物中心提供,动物合格证号:SCXK(辽)2013-0002,本实验通过大连医科大学伦理委员会同意。护肝片和大蒜多糖分别溶于生理盐水配成护肝片溶液(6 mg/mL)、大蒜多糖高浓度(25 mg/mL)和低浓度(15 mg/mL)溶液[10]。小鼠随机分为正常对照组(N)、急性肝损伤组(A)、护肝片组(P)、大蒜多糖高(GpH)、低浓度组(GpL),每组8只。除N组和A组,其余各组灌服0.2 mL相应药物30 d,末次给药30分钟后,正常对照组灌服生理盐水,其他组灌胃14 mL/kg红星二锅头建立急性酒精性肝损伤模型,12小时后取每只小鼠粪便,于80℃保存。
1.5 粪便细菌DNA提取
使用试剂盒提取每只小鼠粪便细菌DNA,按说明书进行操作。
1.6 ERIC-PCR扩增
使用ERIC-PCR上、下游引物ERIC-1和ERIC-2,扩增体系(25μL)为:2×EasyTaqPCRSuperMix 12.5 μL,10 μmol/L 的上下游引物各 0.5 μL,DNA 模板 2 μL,去离子水补充至25 μL。PCR程序:预变性94℃5 min;变性94℃50 s,退火49℃ 30 s,46℃ 30 s,延伸72℃3 min,35个循环;充分延伸72℃9 min。PCR扩增产品用3%琼脂糖凝胶电泳检测,以2 000 bp Marker为参照。
1.7PCR-DGGE电泳
使用16S rRNA基因V3可变区上、下游引物GC-341f和518r,扩增体系同1.5。PCR程序:预变性94℃5 min;变性 94 ℃ 30 s,退火 54 ℃ 30 s,延伸 72 ℃ 30 s,30个循环;充分延伸72℃7 min。采用8%丙烯酰胺凝胶配制25%~50%DGGE变性梯度凝胶 [其中100%浓度变性梯度凝胶含40%(体积分数)去离子甲酰胺和7 mol/L尿素],取10 μL PCR产物于DGGE胶,60℃、70 V电泳5 h,电泳后取出凝胶使用0.125‰EB染色,拍照。
1.8 差别条带序列分析
切下PCR-DGGE图谱中的优势条带,加入20 μL无菌水捣碎,于95℃浸泡10 min,37℃过夜,取上清液做模板进行PCR扩增,引物为341f和518r,PCR反应体系和程序同1.6。PCR产物经测序,结果在GenBank数据库中进行Blast对比分析。
1.9 统计学处理
采用Quantity One 4.6.2软件分析ERIC-PCR图谱中主要条带的分子量,对PCR-DGGE图谱进行UPGMA相似性聚类分析和多样性分析,所得数据应用SPSS 10.0软件包处理,正态计量指标采用均数±标准差(±SD)表示,组间两两比较采用LSD-t检验;P值<0.05表示差异具有统计学意义。
2 结果与分析
2.1 EIRC-PCR图谱分析
大蒜多糖对小鼠进行预防给药30天后建立急性酒精性肝损伤模型,肠道菌群ERIC-PCR指纹图谱如图1所示。
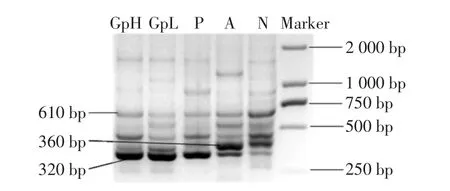
图1 小鼠肠道菌群ERIC-PCR图谱Fig.1 ERIC-PCR profiles of intestinal microflora in mice
正常对照组(N)条带较多,以小片段居多,3条主要条带集中在360、430 bp和610 bp附近。急性酒精性肝损伤组(A)以360 bp的条带为优势条带,而610 bp左右的条带强度减弱。与正常对照组相比,大蒜多糖和护肝片给药组(GpH,GpL,P),小鼠肠道中条带数量基本不变,但是320 bp左右的条带强度明显增大,610 bp左右的条带强度有减小的趋势。与急性肝损伤组相比,大蒜多糖和护肝片给药组(GpH,GpL,P)小鼠肠道中360 bp左右的条带强度明显减小。以上研究结果表明酒精建立急性肝损伤模型小鼠肠道菌群结构发生明显改变,320、360 bp和610 bp左右的条带为大蒜多糖预防给药组、护肝片组和急性酒精性肝损伤组小鼠肠道中的特征条带。
2.2 PCR-DGGE图谱分析
大蒜多糖对小鼠预防给药30天后使用红星二锅头建立酒精性肝损伤小鼠模型,肠道菌群DGGE图谱如图2所示。
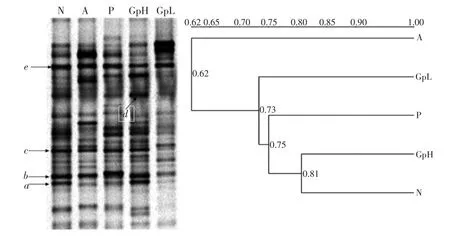
图2 小鼠肠道菌群DGGE图谱和UPGMA相似性聚类分析Fig.2 Representative DGGE profiles(A)and UPGMA dendrograms(B)of intestinal microflora
同一位置的条带代表相同的优势细菌,条带亮度则反映出这一细菌的相对含量。实验组各泳道条带较多,亮度较强,表明小鼠肠道菌群的种类和数量较多,肠道菌群结构的丰富度和多样性较高。条带a、b、c、e存在于各组样品中为共有条带,说明其所代表的细菌是小鼠肠道中的优势菌群,其中条带a所代表的细菌在正常对照组和大蒜多糖高剂量组中含量最大。条带d在GpH泳道中强度高,含量大,而在其他实验组中含量明显降低,这表明d所代表的细菌是大蒜多糖高剂量组小鼠与其他组小鼠肠道差异菌群。UPGMA分析DGGE图的相似性,结果显示各组小鼠肠道菌群结构聚成两大簇,急性酒精性肝损伤组(A)单独聚成一簇,其他组聚成另一簇,两大簇之间相似性较低,仅为0.62,表明酒精导致急性肝损伤的同时对小鼠肠道菌群结构造成影响。正常对照组(N)和大蒜多糖高剂量组(GpH)小鼠肠道菌群结构的相似性较高,为0.81,护肝片组(P)小鼠肠道菌群结构与上述两组也具有较高的相似性,为0.75,这说明护肝片和高剂量大蒜多糖对小鼠肠道菌群结构的影响相似。
2.3 不同给药组小鼠肠道菌群多样性分析
大蒜多糖预防给药小鼠肠道菌群结构多样性分析如表1所示。
Shannon-Weaver多样性指数(H’)比较不同给药组小鼠肠道菌群结构的多样性差异,H’指数越大,群落所含的信息量也就越大,均匀度Evenness(E)指数分析菌群分布情况。H’和E由以下公式获得:H’=-∑(pi)(lnpi),E=H’/lnS,pi=ni/∑ni,ni是条带灰度值[11],pi为第i条带的灰度值与该泳道所有条带灰度值总和的比值,S为条带数,H’为多样性指数,E为均匀度指数。与正常对照组相比,急性酒精性肝损伤组小鼠肠道菌群条带数目增多,丰富度指数S显著增大(P<0.01),推测酒精摄入导致肠道内某种细菌增多。急性酒精性肝损伤组小鼠肠道菌群结构的多样性指数H’和均匀度指数E与正常对照组相比显著减小(P<0.01),正常对照组、护肝片组和大蒜多糖高低剂量组菌群结构多样性指数H’和均匀度指数E与急性酒精性肝损伤组相比显著增大(P<0.05),以上实验结果表明,酒精的摄入对肠道菌群结构有明显影响,导致菌群多样性降低,菌群失调。其中,大蒜多糖高剂量组的多样性指数和均匀度指数最高,其DGGE图谱所反映的信息量最大。
表1 不同给药组小鼠肠道菌群多样性分析(±SD,n=8)Table 1 Microflora diversity indexes analysis of different groups(±SD,n=8)
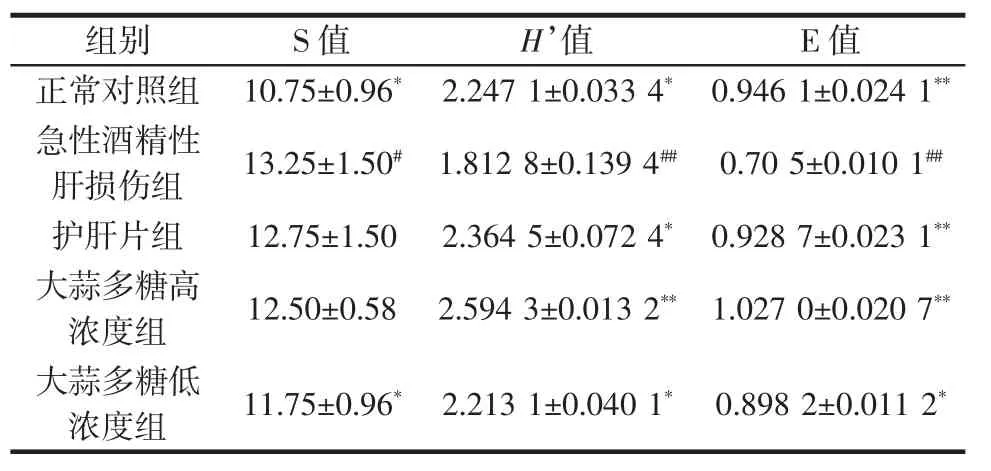
表1 不同给药组小鼠肠道菌群多样性分析(±SD,n=8)Table 1 Microflora diversity indexes analysis of different groups(±SD,n=8)
注:与急性酒精性肝损伤组小鼠肠道菌群结构相比,*P<0.05显著性差异,**P<0.01极显著性差异,与正常对照组相比较,##P<0.01极显著性差异。
组别 S值 H’值 E值正常对照组 10.75±0.96* 2.247 1±0.033 4* 0.946 1±0.024 1**急性酒精性肝损伤组 13.25±1.50# 1.812 8±0.139 4## 0.70 5±0.010 1##护肝片组 12.75±1.50 2.364 5±0.072 4* 0.928 7±0.023 1**大蒜多糖高浓度组 12.50±0.58 2.594 3±0.013 2** 1.027 0±0.020 7**大蒜多糖低浓度组 11.75±0.96* 2.213 1±0.040 1* 0.898 2±0.011 2*
2.4 差异条带序列分析
DGGE图谱优势条带测序结果在GenBank中用Blast进行检索和同源性比较,如表2所示。粪便细菌与数据库已知细菌序列的相似性均在93%以上。
由表2可知,菌a和Eubacterium plexicaudatum的相似性为94%,为优杆菌属(Eubacterium)细菌;菌b与维氏气单胞菌的相似性为93%;菌c与梭菌属的相似性为97%;菌d与Lactobacillus equicursoris的相似性为96%,为乳酸菌属(Lactobacillus);菌e与Enterococcus sulfureus的相似性为97%。以上研究结果可知,急性酒精性肝损伤的小鼠肠道菌群失调,粪便标本中优杆菌属和乳酸菌属细菌明显减少,而高剂量的大蒜多糖组,优杆菌属和乳酸菌属含量均增大。

表2 DGGE图谱中优势条带测序与参比序列对照结果Table 2 Comparative results of dominant band sequence and reference sequence in DGGE profile
3 结论与讨论
ERIC-PCR图谱表明正常对照小鼠肠道中菌群条带主要集中在360、430 bp和610 bp附近。急性酒精性肝损伤组小鼠肠道中以360 bp的条带为优势条带,而610 bp左右的条带强度减弱,大蒜多糖和阳性药护肝片组320 bp左右的条带强度均有明显增大,360 bp左右的条带强度减小。因此,推测320、360 bp和610 bp左右的条带为急性酒精性肝损伤组和大蒜多糖干预组小鼠肠道中的特征条带。320 bp和360 bp等特征条带的确定,可作为后续筛选治疗酒精性肝损伤药物的切入点。ERIC-PCR技术可以快速、灵敏地从分子水平比较分析微生物群落的结构,从而实现对调节肠道菌群药物的筛选,可是因为其通过DNA分子量来分离目标条带,可能相同条带包括多种细菌,ERIC-PCR只能简单判断样品中微生物的分布趋势。为明确肠道菌群优势条带的序列及菌群结构的整体差异,基于16S rRNA基因的PCR-DGGE技术被应用于研究大蒜多糖对急性酒精性肝损伤小鼠肠道菌群失调的影响,为开发利用大蒜多糖的生物活性提供一个新方向。本实验结果表明大蒜多糖预防给药能够增加肠道中优杆菌属和乳酸菌属细菌的数量,肠道菌群结构的多样性和均匀度指数均增大。优杆菌是人和动物口腔与肠道正常菌群的成员,对机体有营养生物拮抗和维持肠道微生物生态学平衡等功能[12]。乳酸杆菌也是人体肠道中正常的优势菌群,黏附于肠上皮细胞表面,在维持人体肠道微生态平衡、增强机体免疫力、降解有毒物质、激活免疫应答等方面发挥着重要作用,且能够促进宿主的消化、吸收和肠胃功能[13]。大蒜多糖促进这两种肠道有益细菌的生长,对小鼠肠道菌群结构具有很好的保护作用。
综上,由于“肠——肝”轴的存在,肠道菌群在肝损伤的发生发展中发挥着重要作用,很多改善肝脏功能的天然产物都具有调节肠道菌群平衡的作用。本研究利用ERIC-PCR和PCR-DGGE技术分析大蒜多糖对酒精性肝损伤小鼠肠道菌群的影响,发现急性酒精性肝损伤小鼠肠道菌群组成结构发生改变,大蒜多糖预防给药能够增加小鼠肠道中优杆菌属和乳酸菌属等益生菌数量,对急性酒精性肝损伤伴有的肠道菌群失调具有一定的预防作用。本课题为大蒜多糖预防酒精性肝损伤伴有的肠道菌群失调提供实验依据,为深入研究肠道菌群在酒精性肝损伤发生发展中的作用奠定基础,为以肠道菌群作为筛选治疗酒精性肝病药物的新靶点提供思路与途径。

