口腔扁平苔藓病损中Th17/Treg平衡及意义
贾沛茹 刘芳 柳汀 蔡扬
口腔扁平苔藓(oral lichen planus, OLP)是一种常见的口腔黏膜慢性炎性疾病,典型病理表现为上皮固有层有以T细胞为主的大量淋巴细胞呈密集带状浸润[1]。 越来越多的研究支持细胞免疫异常在OLP病因机制中的作用[2]。据报道Th17和Treg细胞均参与了OLP的局部免疫反应[3-6]。本研究采用免疫组织化学技术、qPCR技术分别检测IL-17、FOXP3、TGF-β1的表达和分布以及IL-17、RORc和FOXP3mRNA的表达情况,探讨Th17/Treg平衡在OLP局部病损中的作用和意义。
1 材料与方法
1.1 研究对象
口腔黏膜组织标本选自2010~2015 年就诊于贵州医科大学附属医院口腔黏膜专科的初诊患者41 例(非糜烂型20 例,糜烂型21 例),年龄18~65 岁,经临床和病理确诊为OLP(诊断参考[1])。根据病损基底部黏膜是否伴有糜烂分为非糜烂型和糜烂型。均无系统及免疫性疾病,不伴皮损,未经过任何治疗。对照组15 例来自正颌外科手术的正常口腔黏膜。本研究经贵州医科大学附属医院伦理委员会审核批准,所有研究对象均知情同意。
1.2 主要试剂及仪器
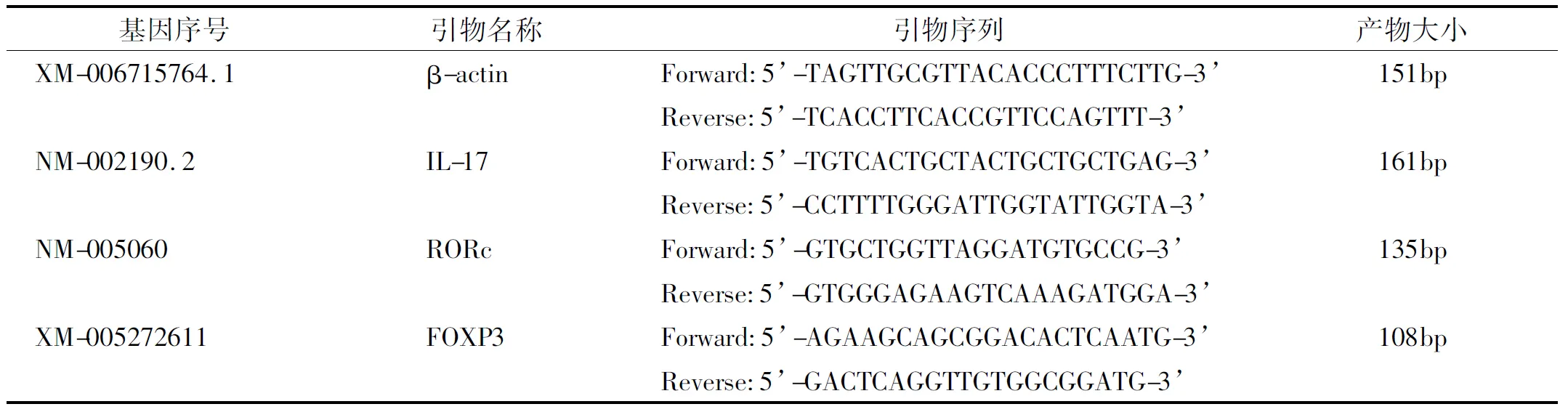
兔抗人IL-17多抗、兔抗人FOXP3多抗(Proteintech, 美国);鼠抗人TGF-β1单抗(eBioscience,美国);DAB(北京中杉);RNAiso Plus、PrimeScriptTMRT reagent Kit(TakaRa,日本);荧光定量PCR仪(BIO-RAD CFX96,美国);核酸蛋白分析仪(Gene Quant 100,美国);YS100光学显微镜(Nikon,日本);qPCR引物序列(上海生工)详见表 1。
1.3 实验方法
1.3.1 免疫组化 免疫组化超敏二步法检测OLP病损组织切片中IL-17、FOXP3、TGF-β1的表达。检测IL-17时采用微波抗原修复(0.01 mol/L枸橼酸盐缓冲液;中火8 min,断火5 min,中火6 min);检测FOXP3和TGF-β1时用高温高压修复(0.01 mol/L枸橼酸盐缓冲液;3 min)。一抗浓度:IL-17多抗(1∶50),FOXP3多抗(1∶50),TGF-β1单抗(1∶500)。二抗用PV6001山羊抗兔IgG/HRP聚合物。操作严格按试剂盒说明进行,以PBS代替一抗作为空白对照。
结果判读:阳性染色表现为棕黄色颗粒。IL-17和TGF-β1染色后主要位于胞浆中,FOXP3主要位于胞核中。采用盲法在光学显微镜下随机观察每片5 个×400 倍视野(参照Fu等[7]的方法计算分析)。阳性细胞≤5%为0 分;6%~25%为1 分;26%~50%为2 分;51%~75%为3 分;>75%为4 分。细胞染色强度:不染色计0 分;淡黄色计1 分; 棕黄色计2 分; 棕褐色计3 分。采用两计分方法之积进行结果判定,并计算阳性细胞数平均百分比。0~2 分为阴性(-),3~5 分为弱阳性(+),6~8 分为中度阳性(++),9~12 分为强阳性(+++)。将+~+++都归为阳性表达。
1.3.2 qPCR 取样本组织约50 mg,Trizol法提取总RNA,并测定A260/A280值,估计RNA纯度。取1 μg RNA逆转录为cDNA。按FastStart Essential DNA Green Master试剂盒说明书在冰上操作,配制10μl qPCR反应体系(表 2)。在荧光定量PCR仪中进行95 ℃ 10 min;95 ℃ 10 s,60 ℃ 15 s,72 ℃ 20 s完成后面的39 个循环。通过扩增曲线和溶解曲线分析排除非特异性扩增,每个样本重复2 次,使用2-△Ct法进行相对定量分析。

表 2 荧光定量PCR反应体系
1.4 统计学分析
应用SPSS 19.0进行统计分析。非正态分布资料采用中位数(四分位间距)进行描述,2 组间均数比较采用秩和检验;计数资料采用卡方检验,相关分析采用Spearman相关性分析,P<0.05差异具有统计学意义。
2 结 果
2.1 OLP中IL-17、FOXP3和TGF-β1的表达
41 例OLP中有35 例(85.37%)见大量的IL-17阳性表达在固有层淋巴细胞中;少量IL-17散在分布于正常口腔黏膜的上皮及上皮下层浸润的细胞,阳性表达率20.00%(3/15)。OLP中FOXP3阳性表达率为87.80%(36/41),阳性细胞主要位于固有层浅层淋巴细胞中;正常黏膜组织中阳性率为13.33%(2/15),散在分布于上皮及上皮下层浸润的细胞。TGF-β1在OLP中呈强阳性表达,阳性率为82.93%(34/41),主要分布于固有层淋巴细胞中;而在正常口腔黏膜阳性率为13.33%(2/15),主要分布于基底层、棘层及颗粒层;经统计学分析,OLP病损中IL-17、FOXP3和TGF-β1的阳性表达率均显著高于正常对照组(P<0.01)(图 1,表 3)。
2.2 OLP病损组织中IL-17、RORc、FOXP3mRNA的表达
OLP病损中IL-17、RORc、FOXP3mRNA的相对表达量高于正常组,差异具有统计学意义(Z1=-2.44,Z2=-2.95,Z3=-2.41;P<0.05);但OLP两型间差异无统计学意义(P>0.05)(图 2)。
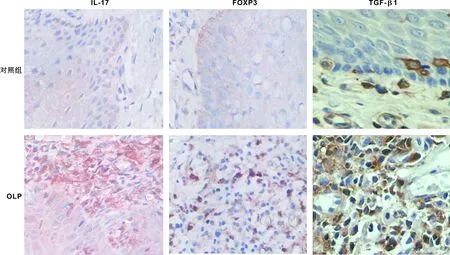
图 1 IL-17、FOXP3和TGF-β1在正常对照组及OLP固有层淋巴细胞的表达(×400)
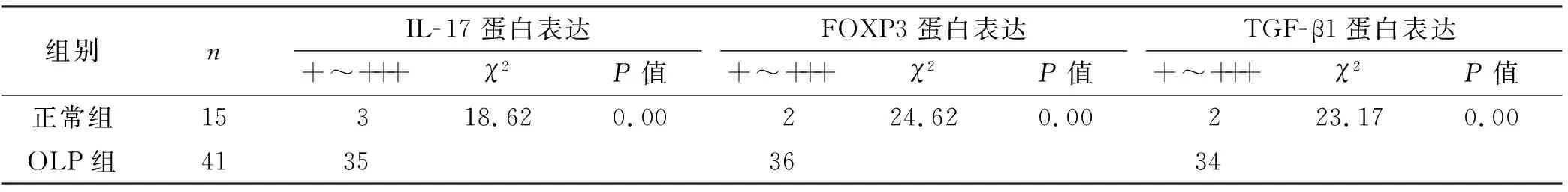
表 3 IL-17、FOXP3和TGF-β1在OLP组织中的表达

图 2 非糜烂型、糜烂型OLP病损组织和对照组中IL-17、RORc、FOXP3mRNA的表达
Spearman相关性分析显示RORc与FOXP3mRNA的相对表达量呈正相关(r=0.69,P<0.05)。糜烂型OLP中RORc/FOXP3高于正常组(P<0.05);但非糜烂型OLP与对照组相比差异无统计学意义(图 2)。
3 讨 论
OLP是一种较常见病因未明的口腔黏膜慢性炎性疾病。目前大部分的研究支持免疫因素在OLP病因及发病机制中的作用。研究表明不仅Th17细胞在OLP的发病起中到重要作用,而且Treg细胞也参与其中[3-6]。但是2 种细胞数量变化及它们与OLP临床分型间的关系不尽相同。
Th17细胞以分泌高水平的IL-17为特征,具有强大的促炎作用并参与多种自身免疫性及炎性疾病的发生发展。本研究显示OLP病损中IL-17的阳性表达率显著高于对照组(P<0.01),推测Th17细胞在OLP局部病损组织中发挥着促炎作用。目前,学者们认为OLP病损中Th17细胞及其相关因子如IL-17、IL-23、IL-22的表达均高于正常组[8-10]。有研究[4]指出CD4+IL-17+细胞数量在正常对照组、斑纹型与糜烂型OLP中有增高趋势, 但无统计学差异。而Piccinni等[11]只在糜烂型OLP病损中发现Th17细胞及其相关因子的表达高于正常组,因此他们认为Th17细胞参与了糜烂型OLP的致病过程。鉴于以上不同观点,本研究通过定量检测Th17细胞的细胞因子IL-17及特征性转录因子RORc发现OLP中IL-17及RORcmRNA均高于对照组(P<0.05),表明Th17细胞参与了OLP的局部病理反应。然而它们在OLP两型中差异无统计学意义,推测Th17细胞分泌的促炎因子IL-17与疾病的严重程度无关。
与Th17细胞功能不同,Treg细胞在外周免疫耐受的维持中发挥核心作用[12]。它主要通过细胞依赖的抑制作用或者释放细胞因子如IL-10、TGF-β等发挥抗炎作用。叉头框转录因子3(FOXP3)被认为是Treg群体功能和发展中的一个关键调节因子。本研究免疫组化及qPCR结果均显示,OLP病损中FOXP3表达增加(P<0.05),提示Treg细胞参与了OLP的局部病理反应。本研究进一步检测了Treg的细胞因子TGF-β1,发现它在OLP固有层中呈强阳性表达且高于对照组(P<0.05)。研究表明TGF-β1在下调T细胞介导的免疫反应和控制自身免疫中发挥着重要作用[13]。Sugerman等[14]发现OLP淋巴细胞中TGF-β1和TβR-Ⅰ表达几乎缺失,提示TGF-β1/TβR-Ⅰ信号通路在OLP细胞免疫中存在障碍,推测OLP局部病损中由于TGF-β1受体途径障碍导致Treg细胞增殖。
本研究OLP病损中RORc与FOXP3mRNA的相对表达量呈正相关,提示Th17细胞的改变可能协同Treg细胞参与了OLP的免疫调节过程。目前Th17/Treg平衡在OLP中的研究较少,为了探讨其在OLP局部病损致病机制中的作用,本研究进一步分析了RORc/FOXP3的变化,发现糜烂型OLP高于对照组(P<0.05),但非糜烂型OLP与正常组相比差异无统计学意义,推测Th17/Treg失衡可能参与了糜烂型OLP的致病过程,这与谢三祥等[5]结论一致。为探寻失衡原因,本研究中IL-17及RoRc在OLP中都升高,推测Th17细胞通过分泌IL-17发挥促炎作用。与谢三祥等[5]观点不同,IL-17及RoRc的表达与OLP临床分型无关,可能是不同研究组中研究对象本身免疫状态差异造成的。此外,TGF-β1增高提示Treg抗炎作用可能由于TGF-β1受体途径障碍导致Treg细胞的增殖。Th17与Treg细胞关系复杂,分化途径相同,功能相反,还可相互转化。对于OLP中Th17/Treg平衡的确切调控机制仍需进一步研究。
综上,本研究表明Th17/Treg失衡可能参与了糜烂型OLP病损的形成。对Th17/Treg细胞平衡调控的深入研究,将可能为OLP患者的治疗提供新的靶点。

