响应面法优化树脂纯化茶多酚工艺研究
曹雪文, 熊道陵, 李洋, 王露琦, 宗毅, 欧阳少波
(江西理工大学冶金与化学工程学院,江西 赣州341000)
茶多酚是一类由多酚类衍生物组成的混合物,具有2-苯基苯并吡喃的基本结构,C环是含氧六元苯并杂环,即吡喃环,其成分复杂,分子量不定,存在多种异构体,多羟基的结构使其显酸性且具有较好的水溶性,苯环结构使其具有独特的光谱特性,基本结构如图1所示[1-2].在降血脂[3]、抗氧化[4]、消炎杀菌[5]、防癌防辐射[6]等方面都有显著功效,此外,茶多酚在食品、饮品、冷藏等方面研究前景广阔[7-8].

图1 茶多酚基本结构
目前茶多酚的提取工艺主要是水提与醇提.最近有研究者利用双水相,再借助各类辅助手段进行改进来提取茶多酚.例如李洋等[9]利用该法使茶多酚提取率达到17.43%,但是制得的茶多酚粗品效果差强人意.为了得到纯度更好的目标产物,未来研究的重点应放在纯化工艺上.赖榕辉等[10]分别用硅胶与C18作为吸附剂,用甲醇、氯仿、水分梯度对其进行洗脱,来纯化儿茶素单体.结果发现,硅胶纯化的EGCG纯度明显高于C18纯化的EGCG纯度.该方法不仅工艺简单,而且溶剂无毒无害,但是吸附剂的选择工作投入较大.杨洋等[11]借助制备型高效液相色谱法将牛磺胆酸钠成功从牛胆汁中分离纯化,纯度可达到98.1%,该方法纯化目标产物的效果较好,但是应用范围小,投入巨大.侯善欣等[12]尝试了用高速逆流色谱法对茶多酚中的黄酮类物质的分离,调节混合溶剂的配比,验证了在流速5mL/min、转速500 r/min下,该方法均可得到纯度在99%的黄酮类物质单体.该方法应用范围有所扩大,但是操作量极少,不适合大规模生产.
本研究本着绿色、环保、高效、的目的,对茶叶浸取液进行纯化处理.依据茶多酚含有丰富酚羟基且自身可以形成氢键的特性,丰富的孤对电子与空轨道使其形成的氢键作用力较强的特性,利用大孔吸附树脂的选择性吸附的特点,借助Design-Expert软件优化工艺条件,本实验建立了一种经济、环保、可重复生产的新工艺.
1 材料与方法
1.1 材料与仪器
采用的材料分别为:茶多酚标品,上海抚生实业有限公司生产;乙腈、乙酸(色谱纯),陇西化工股份 有 限 公 司 生 产 ;XDL-1、XDL-2、D-101、HPD-600、NKA-2、DM-301、HPD-722、NKA-9 型大孔吸附树脂,沧州宝恩吸附材料科技有限公司生产.
采用的仪器分别为:Pump System型高效液相色谱仪,德国赛卡姆公司生产;UV-6300型紫外可见分光光度计,上海美普达仪器有限公司生产.
1.2 纯化方法
准确称取活化好的各个型号树脂5.0000 g,加入一定量的提取液(称取10.0000 g茶叶,用95℃水进行水浴加热,浸提两次,并将每次抽滤所得溶液合并为一份溶液),调节反应温度与体系pH,按公式(1)、(2)、(3)分别求得树脂的吸附量、吸附率和洗脱率.
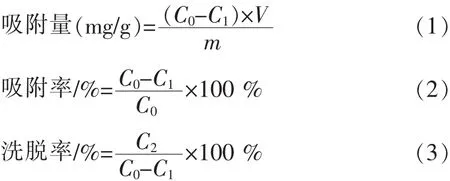
其中,C0吸附前样液的浓度 (mg/mL);C1吸附后样液的浓度(mg/mL);C2洗脱液的浓度(mg/mL);V 样液体积(mL);m 树脂重量(g).
实验流程如图2所示.
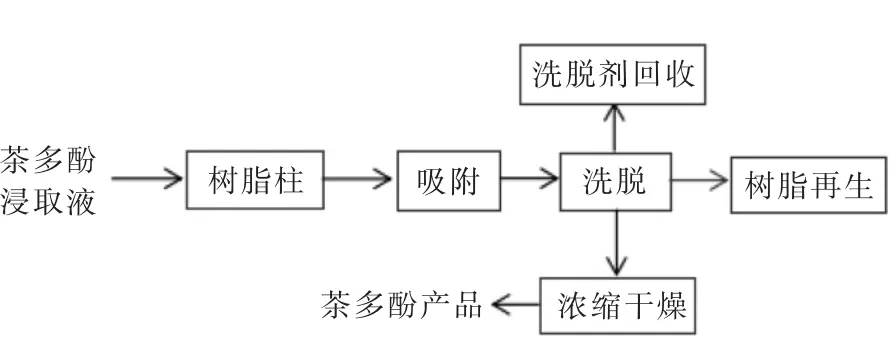
图2 茶多酚纯化工艺流程
1.3 分析方法
茶多酚溶液含量按照酒石酸亚铁法[13](GB/8313—2002)测定.
茶多酚产品液相色谱分析:分别配置0.4mg/mL的标液与样液,分别过超滤膜,色谱柱:Agilent E clipse XDB-C18 (4.6mm×250mm,10 μL); 流动相A:0.5%乙酸混合3%乙腈水溶液;流动相B:0.5%乙酸混合30%乙腈水溶液;检测波长:280 nm;柱温:30℃;流速:1mL/min,以标品与产品作对照,分析产品成分及含量.
2 结果与分析
2.1 树脂筛选试验
在试验初,测得样液茶多酚浓度为3.15mg/mL,经过对不同类型的树脂的吸附-洗脱试验,依次算得各个树脂对茶多酚的吸附与洗脱的各项性能指标,如表1所示.

表1 不同大孔树脂吸附-洗脱茶多酚能力比较
由表1可知,对茶多酚吸附能力最强的3种树脂分别为:XDL-1、XDL-2、HPD-600, 而解析率最高的 3 种树脂分别为:DM-301、XDL-1、D-101.通过比较发现,虽然DM-301的解析率比XDL-1略大,但是其吸附量相较于XDL-1差了13.28 mg/g.综合考虑以上数据,选取XDL-1作为试验所用树脂对茶叶提取液中的茶多酚的纯化.
2.2 静态吸附试验
2.2.1 吸附时间的影响
在吸附温度为25℃、pH为6的条件下,在不同时间梯度下取测树脂的吸附量,结果如图3所示.
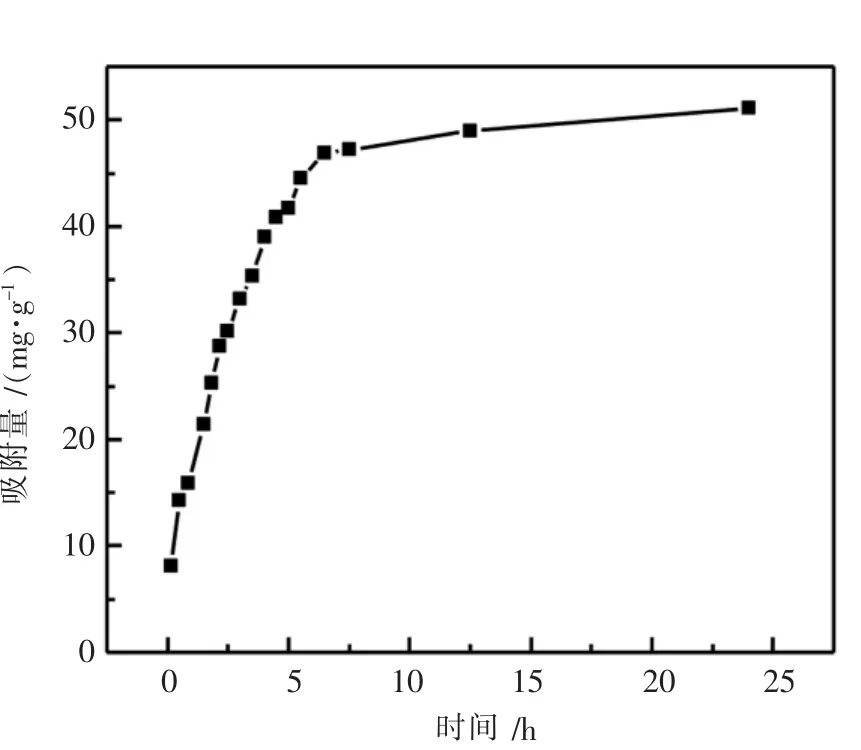
图3 吸附量受时间的影响
由图3可知,吸附量随着时间的延长而升高,最后趋于水平状态.这是因为吸附开始阶段,溶液中的目标产物含量相对较高,并且其与树脂的接触较充分.吸附量随时间的延长而快速上升,但是当树脂内的吸附空间被填满后,吸附量很难再提高.由实验结果,本试验选择6 h为最佳吸附时间.
2.2.2 吸附温度的影响
在吸附时间为6 h、pH为6的条件下,在不同温度梯度下取测树脂的吸附量,结果如图4所示.

图4 吸附量受温度的影响
由图4可知,吸附率随温度的升高而快速升高,当温度达到25℃时,吸附率出现最高值,随后呈缓慢下降趋势.这是因为温度升高体系中的分子运动加剧,促进了目标产物的分子快速扩散到树脂内部,但是温度持续升高,树脂内部的空间结构发生细微变化,在一定程度上阻碍了目标产物的进入,因此本试验选择25℃为最佳吸附温度.
2.2.3 吸附pH的影响
在吸附时间为6 h、温度为25℃的条件下,在不同pH梯度下取测树脂的吸附量,结果如图5所示.
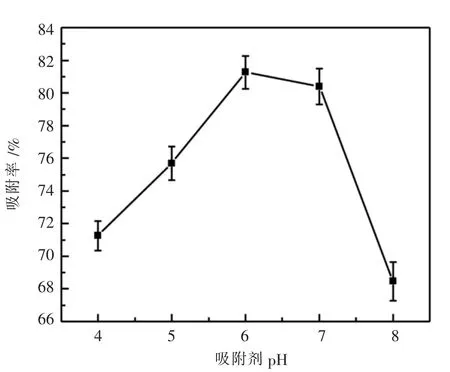
图5 吸附量受pH的影响
由图5可知,体系pH在6之前,吸附率与pH呈正比例关系;pH在6时,吸附率达到了81.26%;当体系偏碱性后,吸附率迅速下降.这是因为目标产物中的酚羟基结构有活泼的氢离子电离出,使得体系呈酸性条件时更有利于吸附的进行,当体系中出现OH-后,电离出的H+与之反应从而影响试验结果.因此本试验选取6作为最佳pH值.
2.3 静态洗脱试验
2.3.1 洗脱剂浓度的影响
在温度为40℃、pH为6的条件下,用不同体积分数的洗脱剂洗脱2 h,分别取测洗脱率,结果如图6所示.

图6 洗脱率受洗脱剂体积分数的影响
由图6可知,洗脱剂体积分数的升高有助于洗脱反应的进行,但是并不是体积分数越高越好.当体积分数到达80%时,洗脱率达到78%,出现最高值.但是之后响应值又有下降趋势,这主要是因为洗脱剂体积分数的提高虽然能促进目标产物从树脂中溶出,但是体积分数过高,导致洗脱剂流动性相对较差,又不利于目标产物的溶出.故而选取80%的乙醇作为本试验的洗脱剂.
2.3.2 脱温度的影响
用体积分数为80%的洗脱剂在pH为6的条件下,设置不同温度洗脱2 h,分别取测洗脱率,结果如图7所示.

图7 洗脱率受洗脱剂温度的影响
由图7可知,洗脱温度对洗脱率的影响比较显著.在40℃之前,洗脱率随着温度的升高而升高,但是一旦温度超过40℃,洗脱率反而下降.这主要是因为当温度较低时,体系内的分子整体活跃度不高,影响了洗脱反应的进行,而当温度过高时,树脂内部结构又出现膨胀现象,不利于目标产物的洗脱.故选取40℃为最佳洗脱温度.
2.3.3 洗脱pH的影响
用体积分数为80%的洗脱剂在40℃的条件下,调节不同pH洗脱2 h,分别测洗脱率,结果如图8所示.

图8 洗脱率受洗脱剂pH的影响
由图8可知,随着洗脱剂pH的持续升高,洗脱率先升高随后降低,在pH=6处出现最高值.鉴于茶多酚在偏酸性环境下较为稳定,因此当体系偏碱性时洗脱率急剧下降,因此本试验选取pH为6的乙醇溶液作为洗脱剂.
2.3.4 洗脱时间的影响
用体积分数为80%的洗脱剂在pH为6,温度为40℃的条件下,分不同时间节点分别取测洗脱率,结果如图9所示.
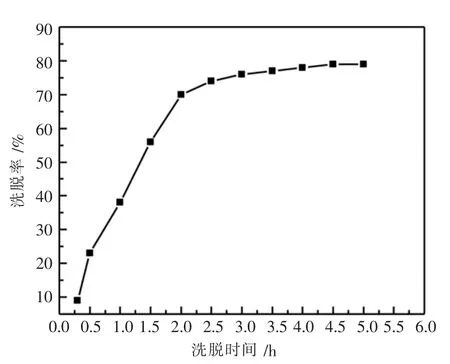
图9 洗脱率受洗脱剂时间的影响
由图9可知,随着时间的推移,在脱附剂的作用下茶多酚从树脂上洗脱得越多,但是过长的洗脱时间,会很大程度地影响试验整体的进度,时间太短,又达不到洗脱的效果,当实验进行到两小时时,大部分茶多酚被洗脱下,而之后洗脱率增长速度较慢,因此洗脱时间确定在2 h为宜.
2.4 响应面法优化洗脱工艺条件
2.4.1 Box-Behnken因素水平和编码
在单因素试验的基础上,依据Box-Behnken设计原理[14],以洗脱剂体积分数(A)、洗脱温度(B)、洗脱 pH(C)、洗脱时间(D)为自变量,响应值(Y)为茶多酚的洗脱率,其因素水平和编码详见表2.
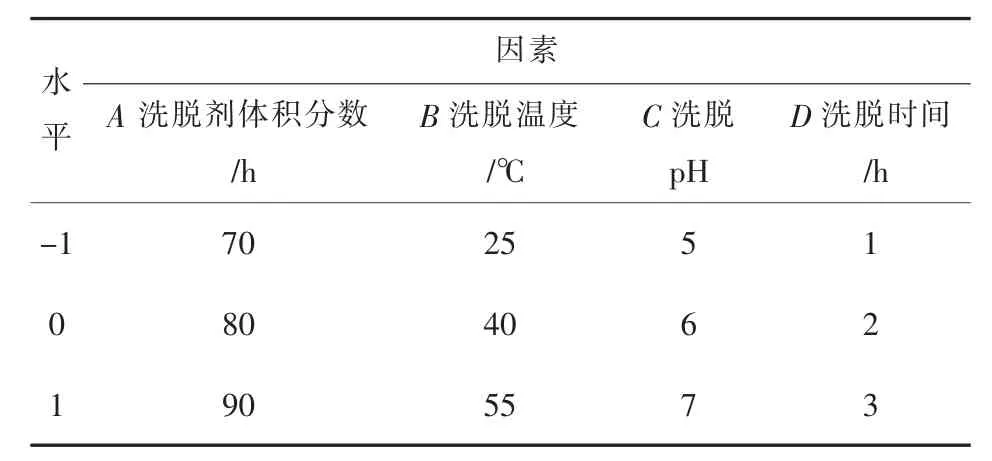
表2 Box-Behnken因素水平和编码
2.4.2 Box-Behnken试验设计与结果
利用Design-Expert软件在3水平4因素的基础上共得到29组分析试验,其试验设计与结果详见表3.
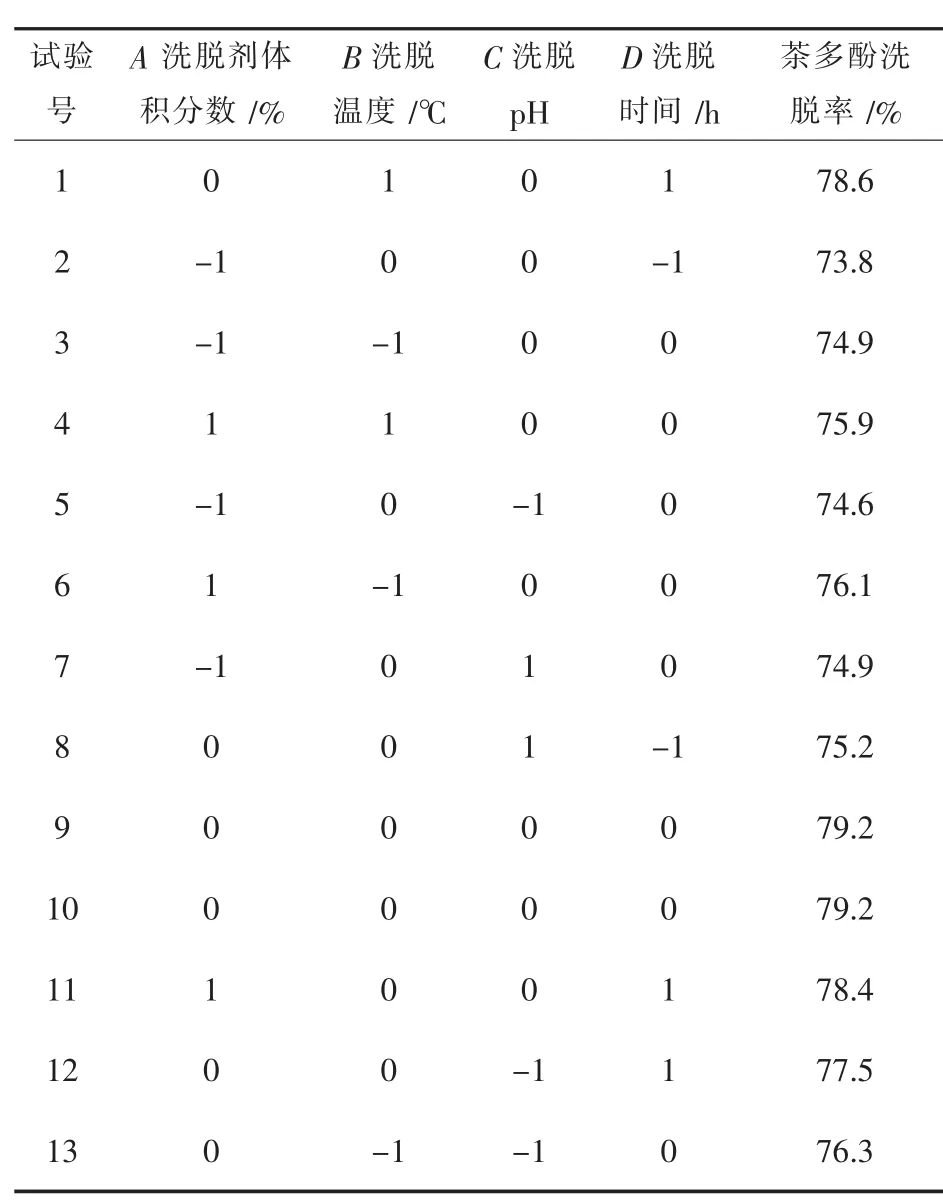
表3 Box-Behnken试验设计与结果

续表3 Box-Behnken试验设计与结果
2.4.3 Box-Behnken试验方差分析
利用Design-Expert软件分析整理上述29组试验结果,其结果详见表4.
响应面中的系数R2与方差分析是直接判断模型的可靠性的依据[15],由表4数据分析可知,在模型中P值远低于0.01,说明该模型的显著性极强,试 验 R2为 0.9613, 变 异 系 数 (coefficient of variation,CV)为 0.59%,信噪比为 16.7183,即回归方程的拟合度与可信度均达到了设计要求,故该模型可用于实验工艺条件的优化与预测[16].同时F值[17]的大小直接反映了各个因素与实验结果关系的紧密程度即:洗脱时间(D)=126.99>洗脱剂体积分数(A)=23.06>洗脱温度(B)=5.92>洗脱 pH(C)=2.56,经对试验数据回归拟合后可建立二次多元方程:
吸附率Y=79.20+0.63A+0.32B+0.21C+1.47D-0.40AB-0.10AC-0.27AD+0.17BC-0.075 BD+0.050CD-1.96A2-1.20B2-1.46C2-1.10D2
2.4.4 响应分析与提取工艺优化
利用响应面法作图可得洗脱率受洗脱体积、洗脱温度、洗脱时间、洗脱pH四个单因素交互作用的影响,图10、图11只呈现了脱率Y受洗脱体积、洗脱温度、洗脱时间三个单因素变量交互作用的影响.
图10和图11中的三维空间曲面图与等高线分析图直观的反映了茶多酚洗脱率Y受洗脱体积、洗脱温度、洗脱时间三个单因素变量交互作用的影响,两图曲面陡峭、等高线趋于椭圆,交互作用显著(洗脱pH和这三个单因素变量的也有一定的交互影响,但是交互作用不显著,故在此不做特别说明)通过对拟合方程的求解可预测四因素最佳工艺条件组合为:洗脱剂体积分数77.78%、洗脱温度40.01℃、洗脱pH为6.18、洗脱时间2.43 h.为方便实际操作,将预测四因素最佳工艺条件修正为:洗脱剂体积分数80%、洗脱温度40℃、洗脱pH为6、洗脱时间2.4 h.最终经过3次重复试验取平均值得洗脱率为79.20%,其预测值79.42%,说明该模型可以优化该实验的工艺条件.

表4 Box-Behnken试验方差分析

图10 洗脱剂体积分数与温度对结果影响的等高线及响应面图

图11 洗脱剂体积分数与时间对结果影响的等高线及响应面图
2.5 产品表征
通过不同时间所出的峰来确定被测物质的性质,而峰面积则可表示各物质的含量,以此来表征茶多酚并达到测定其纯度的目的.
在图12、图13中,各个峰形对应的物质及相应面积如表5所示[18-19].

图12 茶多酚标品液相谱图
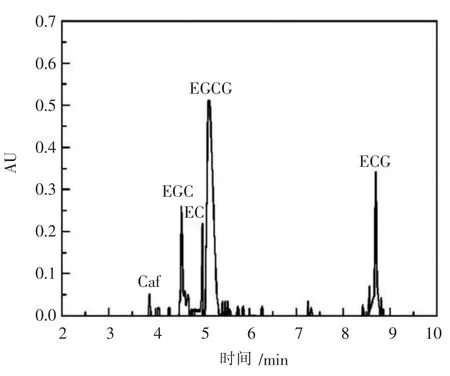
图13 茶多酚产品液相谱图

表5 茶多酚标品与产品出峰时间与面积对照
由图12可知,不同的峰位置对应的时间分别为 :3.795 min、4.439 min、4.962 min、5.158 min、8.856 min,在此检测条件下的出峰时间分别对应的物质为3.795min处对应的是Caf、4.439min处对应的是EGC、4.962min处对应的是EC、5.158min处对应的是EGCG、8.856min处对应的是ECG.由图13可知,样品的主要出峰时间与标品的出峰时间基本吻合,分别为:3.825min、4.503min、4.981min、3.209min、8.492min,即可断定产品与标品属于同一类物质[20],经过树脂吸附纯化的目标产物纯度可达到67.09wt%.与杨思勇等[21]研究结果相比,产物纯度提高率达到48.17%.
3 结 论
1)本试验通过对8种树脂的选型试验,选取XDL-1为试验所用树脂.
2)吸附试验中,在吸附时间为6 h,温度为25℃,pH为6的条件下,茶多酚的吸附率可达到83.21%.
3)在洗脱单因素试验的基础上,借助Design-Expert软件进行单因素条件优化,得出最佳条件为:洗脱剂浓度为80%,洗脱温度为40℃,pH为8,洗脱时间为2 h,此时茶多酚的洗脱率为79.20%,其预测值79.42%,实际值与预测值相差不大,说明该模型可以优化该实验的工艺条件,茶多酚产品的纯度可达到67.09 wt%.

