miR-124在结肠癌中表达及其对结肠癌肺转移的调控作用
楚琰 ,李沛,杨光, ,赵换维,王雅台,戴建国,朱介法,孙健勇
(1.西安海棠职业学院医学技术学院 基础医学教研室,陕西 西安 710038; 2.空军军医大学唐都医院 胸腔外科,陕西 西安,710038;3.空军军医大学西京消化病医院 消化外科,陕西 西安,710032)
结肠癌(colon cancer)是常见的恶性消化道肿瘤之一,全球病死率逐年上升,而肿瘤转移复发是致死的重要原因[1],其发生、发展涉及多种基因以及蛋白质分子调控的复杂过程,对此过程中异常表达的分子进行研究可能发现癌症发生的分子机制及新的治疗靶点故生物治疗可能成为治疗结肠癌的突破点。微小RNA(microRNA,miRNA)是一种内源性单链非编码小RNA,通过与mRNA的3'非翻译区互补配对,抑制mRNA翻译或直接使其降解,抑制靶基因的表达[2]。最近有多项研究结果证实,miRNA的异常表达在众多恶性肿瘤的发生、发展中扮演着重要角色。
2007年,Mishima等[3]研究了小鼠中枢神经中miR-124的表达,从此拉开了miR-124的研究序幕。有多项研究发现,miR-124在不同肿瘤中的表达异常,并影响肿瘤的生物学行为。Zhao等[4]在对头颈部鳞癌的研究中发现miR-124的表达量比正常组织低4倍多,而在升高JHU-22细胞中miR-124的表达后,可以发现miR-124可以通过抑制靶基因SphK1进而抑制肿瘤细胞的增殖。另外miR-124被发现在结肠癌中低表达[5],并诱导结肠癌细胞自噬和凋亡,并证实了miR-124的抑癌作用。目前关于miR-124与结肠癌发生发展的关系及其机制尚不完全清楚。因此,本实验将检测miR-124在结肠癌的表达情况,并调节miR-124的表达来观察其对结肠癌细胞生物学行为的影响,并探讨其内在机制。
miRNA常常通过调节下游靶分子来对肿瘤的恶性进展发挥调节作用。整合素β1(integrin β1,ITGB1)是一种重要黏附分子,其在肿瘤细胞的侵袭和转移过程中起到了重要作用。ITGB1是介导细胞和细胞外基质相互作用的主要受体,在细胞增殖、黏附和侵袭过程中发挥重要作用,是肿瘤发展相关信号通路的重要调节分子,有研究[6-8]表明其与miRNA表达调控有关,与肿瘤的发生发展密切相关。如果在结肠癌进展中能将ITGB1作为miRNA调控的靶基因,将对肿瘤的临床靶向治疗提供研究依据。
1 材料与方法
1.1 材料
结肠癌组织及其对应癌旁组织来源于2014年—2015年空军军医大学西京消化病医院收治的结肠癌手术患者,共40例患者,40对样本(男20例,女20例;年龄区间24~79岁,中位年龄63岁),术后对组织标本参照AJCC/UICC的TNM分期标准进行诊断、分级及分期。TNM分期:I期7例,II期20例,III期9例,IV期4例。肿瘤大小:≥5 cm 26例,<5 cm 14例。组织学分化程度:高分化及中分化组28例,中低分化组6例,低分化组6例。淋巴结转移阳性者22例,阴性18例。癌组织均取自于肿瘤中心非液化坏死区,癌旁正常组织取自距肿瘤>5 cm的部位,所有组织经病理证实。所有实验均经空军军医大学伦理委员会同意;胃黏膜上皮来源的永生化细胞GES、结肠癌细胞系HT29、SW480、Lovo及HEK-293T细胞由空军军医大学肿瘤生物学国家重点实验室馈赠。RPMI 1640培养基、DMEM培养基、胎牛血清购自Gibco公司;TRIzol及Lipofectamine 2000试剂购自Invitrogen公司;miR-124 qRT-PCR引物试剂盒及逆转录试剂盒miScript Reverse Transcription Kit购自Qiagen公司,实时定量PCR试剂SYBR Green Real-time PCR Master Mix购自TaKaRa公司;LvmiR-124、LV-luc、Lv-shITGB1、Lv-shEGFP慢病毒质粒由我校生化教研室馈赠;AnnexinV-FITC凋亡检测试剂盒购自珠海健康元生物医药有限公司;BALB/C裸鼠购自空军军医大学实验动物中心;双荧光素酶报告基因载体购自Promega公司;miR-124模拟物及阴性对照序列购自上海吉玛公司;Dual-Luciferase Reporter 1000 Assay System购自ABI公司,β-actin、ITGB1抗体均购自美国Santa Cruze公司。
1.2 方法
1.2.1 组织及细胞RNA提取 按TRIzol试剂说明书提取结肠癌组织或结肠癌细胞株的总RNA,用紫外分光光度计测量总RNA浓度及A260/280比值,取比值为1.8~2.0之间的RNA进行逆转录。取1 μg总 RNA,按miScript Reverse Transcription Kit说明书操作将RNA逆转录为cDNA,保存于4℃备用。
1.2.2 qRT-PCR实验 检测miR-124在结肠癌组织中的表达情况及miR-124在结肠癌细胞株中的感染效率(以U6做内参)。反应条件:预变性95 ℃ 3 min,变性 95 ℃ 10 s,退火 56 ℃ 15 s,延伸72 ℃ 15 s,共45个循环,72 ℃延伸5min终止反应。所有反应均设立3个复孔,用-ΔCt值表示miR-124的相对表达量。qRT-PCR结果采用 2-△△Ct法表示。miR-124 引物序列:TAA GGC ACG CTG AAT GCC GG。ITGB1序列正向:TTT TGA GCT CGT ACT GCC CGT GCA AAT CCC ACA A;反向:TTT TAC GCG TTG CTT TTC CTC AAC TTC TTT AA。GAPDH序列正向:AGA AGG CTG GGG CTC ATT TG; 反 向:AGG GGC CAT CCA CAG TCT TC。
1.2.3 细胞培养及感染、转染 培养结肠癌细胞株Lovo 48 h后,更换新鲜培养基,同时加入终浓度为8 µg/mL的病毒液感染细胞。筛选4周后得到稳定表达miR-124的结肠癌细胞株、低表达ITGB1的结肠癌细胞株和阴性对照LV-luc及Lv-shEGFP细胞株。结肠癌细胞株用含10%胎牛血清和双抗的RPMI 1640培养基在37 ℃,5% CO2的培养箱中培养。按说明书用Lipofectamine 2000将miR-124模拟物/阴性对照序列及WT-ITGB1-3'UTR、Mut-ITGB1-3'UTR-1、Mut-ITGB1-3'UTR-2、Mut-ITGB1-3'UTR-1-2及参照质粒转染结肠癌细胞株。
1.2.4 凋亡实验 在建立稳定高表达miR-124或低表达ITGB1细胞株的基础上,将结肠癌细胞悬浮培养于PolyHEMA板中,收集细胞,按凋亡检测试剂盒加入相应试剂,移液器轻轻吹打混匀,室温下避光放置10 min,使用流式细胞仪定量观察miR-124或ITGB1对结肠癌细胞抗脱落凋亡(转移)敏感性能力的影响。实验重复3次。
1.2.5 双荧光素酶报告基因实验 在48孔板中用含10%FBS的DMEM培养HEK-293T细胞,当长满至80%~90%时,将miR124模拟物/阴性对照序列分别与WT-ITGB1-3'UTR/Mut-ITGB1-3'UTR-1/Mut-ITGB1-3'UTR-2/Mut-ITGB1-3'UTR-1-2及pRL-TK参照质粒用Lipofectamine 2000共转染HEK-293T细胞。转染48 h后用Dual-Luciferase Reporter 1000 Assay System分 析Firefly及Renilla荧光强度。
1.2.6 Western blot实验 将不同表达miR-124的结肠癌细胞株用PBS冲洗,加入RIPA裂解液,吹打,冰上裂解后收集裂解液,离心后收集上清液,与上扬缓冲液共同煮沸20 min,每孔上样10 µL后用SDS-PAGE电泳,转PVDF膜,5%脱脂牛奶封闭,4 ℃一抗孵育过夜,PBST洗膜后二抗孵育2 h,洗膜,化学发光法检测,暗室内压片曝光。
1.2.7 动物实验 实验用裸鼠5~7周龄,雌性20只,用PBS重悬对数生长期的稳定表达miR-124/低表达ITGB1和表达阴性对照LV-luc/Lovo-Lv-shEGFP的Lovo结肠癌细胞亚株。将细胞浓度调整为5×103/mL,采用尾静脉注射的方法将细胞注入裸鼠体内。观察裸鼠肺表面结节直径>0.5 mm转移灶的数量,并取裸鼠肺脏组织进行HE染色。
1.3 统计学处理
所有数据由重复性3次独立实验得出,采用SPSS 20.0统计学软件及Graph Prism 5.0对以上实验结果数据进行分析。计量实验数据均以均数±标准差(±s)表示,组间差异用单因素方差分析和配对t检验分析。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-124在结肠癌中的表达及其临床参数的关系
在40对结肠癌及其配对癌旁组织中,miR-124在结肠癌组织中的表达均值明显低于癌旁组织(1.48 vs.2.58,P<0.05)(图1)。结肠癌组织中miR124表达量升高的15例,表达量降低的25例,经分析发现,miR-124在结肠癌组织中的表达水平与肿瘤大小、分期、淋巴结转移情况有关(均P<0.05)(表1)。

图1 miR-124在结肠癌组织及癌旁组织中的表达Figure 1 Expressions of miR-124 in colon cancer and adjacent tissues
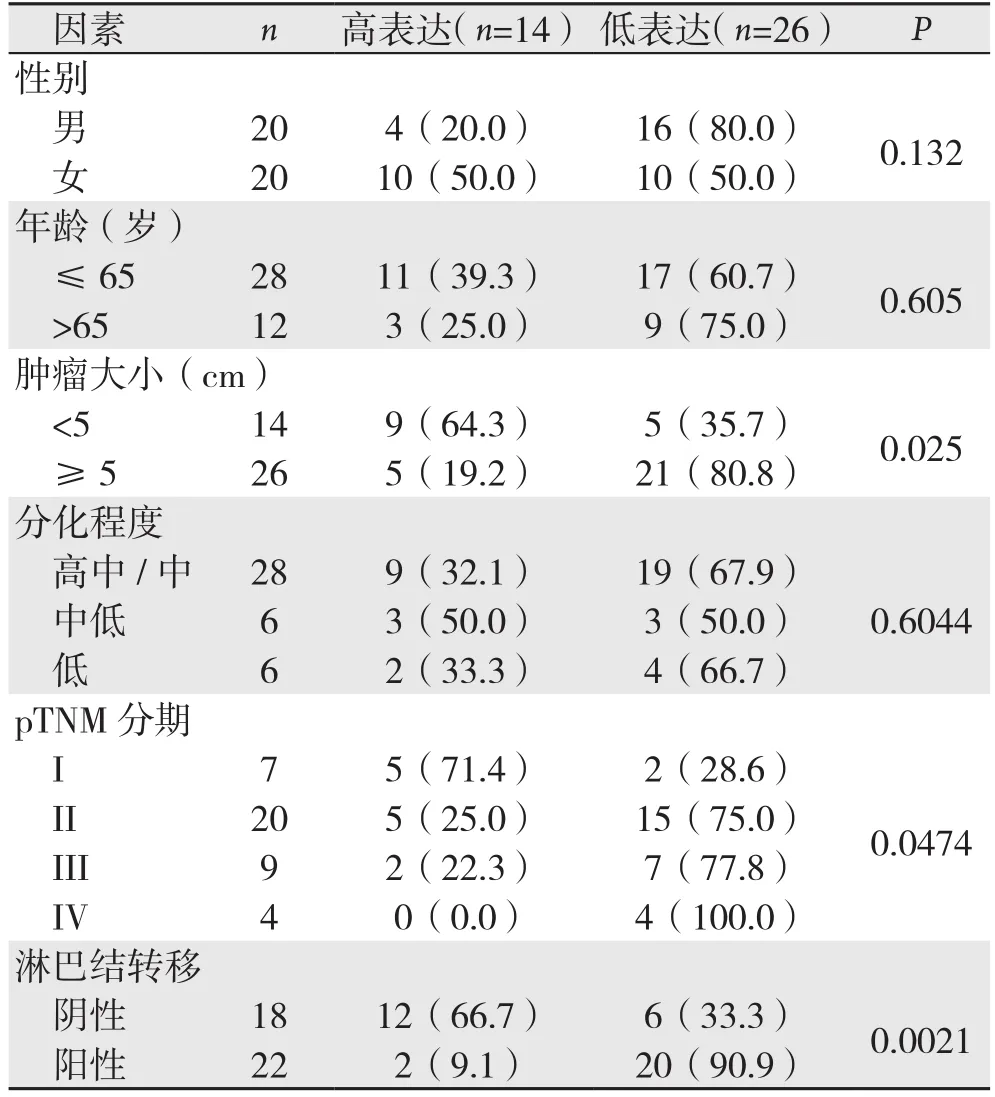
表1 miR-124表达与患者临床因素的关系[n(%)]Table 1 Relations of miR-124 expression with the clinical factors of the patients [n (%)]
2.2 miR-124在结肠癌细胞系中的表达水平
进一步在GES、HT29、SW480和Lovo细胞系中利用qRT-PCR的方法分析内源性miR-124表达水平的差异。结果显示,miR-124在各结肠癌细胞系中表达水平均明显低于GES细胞(均P<0.05),且随着癌细胞恶性程度的增加,miR-124的表达逐渐降低(GES>HT-29>SW480>Lovo)。其相对Ct值分别为:5.978±0.531、3.023±0.401、1.211±0.190、1.000±0.07(图2)。

图2 miR-124在结肠癌细胞中的表达水平Figure 2 Expressions of miR-124 in colon cancer cells
2.3 miR-124过表达结肠癌细胞株的建立
用慢病毒感染的方法用LV-miR-124及对照LV-luc病毒分别感染结肠癌细胞株,并采用Blasticidin进行药物压力筛选。结果显示:LV-miR-124明显上调了Lovo结肠癌细胞miR-124的表达(图3),从而获得了稳定高表达miR-124的结肠癌细胞株。
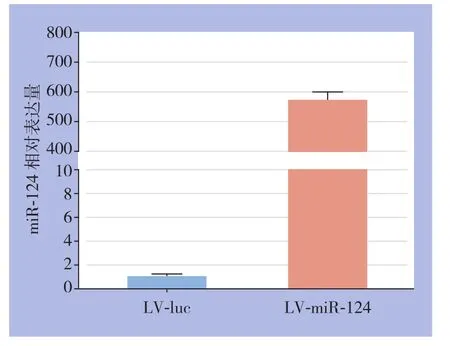
图3 转染miR-124模拟物后结肠癌细胞中miR-124的表达水平Figure 3 The miR-124 expression level in colon cancer cells after transfection of miR-124 mimics
2.4 miR-124过表达对结肠癌细胞凋亡的影响
用Annexin-V染色结合流式细胞分析技术定量观察发现,稳定过表达miR-124的Lovo结肠癌细胞在悬浮培养36 h后的凋亡细胞比例从对照组(LV-luc)的(1.5±0.69)%升高至(16.6±7.28)%,差异有统计学意义(P<0.05)(图4)。

图4 miR-124对结肠癌细胞凋亡的影响Figure 4 The influence of miR-124 on apoptosis in colorectal cancer cells
2.5 结肠癌细胞中ITGB1与miR-124的关系
根据miRNA预测软件miRBase(http://www.mirbase.org)预测分析,有2个与miR-124互补识别的可能结合位点(图5A-B)。故克隆了包含该识别区域在内的DNA片段,建立了针对此3'UTR序列的报告基因系统,在HEK293T细胞中进行了双荧光素酶报告基因的检测。结果显示:利用化学合成的miR-124模拟物转染HEK293细胞,可明显抑制野生型ITGB1-3'UTR报告基因的活性。但对miR-124结合位点发生突变的3种突变体报告基因的荧光素酶活性的调节能力均有不同程度的减弱。提示ITGB1可能是miR-124的靶基因(图5C)。并通过Western blot实验证实在结肠癌细胞中,ITGB1是miR-124的靶基因(图5D)。

图5 miR-124靶基因预测与鉴定 A:miR-124的预测靶点;B:ITGB1 3'UTR报告基因的设计;C:双荧光素酶报告基因系统结果;D:ITGB1的表达变化Figure 5 Prediction and identification of the target genes for miR-124 A: The predicted targets of miR-124; B: Design of the ITGB1 3’UTR reporter gene; C: Results of dual luciferase reporter assay; D: Change in ITGB1 expression
2.6 miR-124对小鼠结肠癌肺转移与生存期的影响
尾静脉注射结肠癌细胞20 d后取裸鼠肺组织进行转移灶计数,显微镜下观察发现,LV-luc组裸鼠肺脏中有明显的肺转移灶生成,而LV-miR-124组裸鼠肺脏中却很少能够观察到明显的肺转移灶。注射LV-luc细胞的裸鼠绝大多数都出现肺脏的转移(7/10),而注射LV-miR-124细胞的裸鼠却几乎没有形成转移灶(1/10)。而病理切片的结果显示,注射参照细胞LV-luc细胞的裸鼠肺组织切片染色显示肿瘤细胞出现成团分布,并侵润肺组织,而注射LV-miR-124细胞的裸鼠肺组织切片染色显示并未发现明显的肿瘤细胞分布及侵润(图6A)。转移灶数分别为(44.3±13.52)个、(13.9±4.72)个,差异有统计学意义(P<0.05)(图6B)。
为更进一步明确miR-124对荷瘤小鼠生存的影响,对尾静脉注射结肠癌细胞的小鼠进行了生存时间的记录。结果显示miR-124高表达结肠癌细胞组小鼠的生存时间明显长于对照组(P<0.05)(图6C)。

图6 miR-124对结肠癌细胞小鼠肺转移及生存的影响 A:显微镜下观察(HE×200);B:肺转移灶比较;C:生存时间比较Figure 6 The influence of miR-124 on pulmonary metastasis and survival in nude mice A: Views under microscopes (HE×200);B: Comparison of the pulmonary metastases; C: Comparison of the survival times
2.7 ITGB1对结肠癌细胞凋亡及小鼠结肠癌肺转移与生存期的影响
采用慢病毒感染的方法将ITGB1低表达组LV-shITGB1及对照LV-shEGFP慢病毒分别感染Lovo结肠癌细胞,并使用Puromucin进行药物压力筛选。qRT-PCR结果如图所示:与LV-shEGFP比较,LV-shITGB1明显抑制了Lovo结肠癌细胞内源ITGB1的表达水平(P<0.05)(图7),从而获得了稳定低表达ITGB1的结肠癌细胞亚株。
在建立低表达ITGB1稳定细胞亚株的基础上,利用PolyHEMA包被培养板,将细胞种入其中,建立了结肠癌细胞的悬浮培养模型。使用Annexin-V染色结合流式细胞分析技术定量观察低表达ITGB1对结肠癌细胞抗脱落凋亡敏感性能力的影响。结果显示低表达ITGB1的Lovo结肠癌细胞在悬浮培养36 h后的凋亡细胞比例明显升高[(1.3±0.65)%vs.(10.8±5.47)%,P<0.05](图8)。
在进行尾静脉注射20 d后取小鼠肺脏组织进行HE染色,发现Lovo-LV-shEGFP组小鼠肺脏中有明显的肺转移灶生成,而Lovo-LV-shITGB1组小鼠肺脏中却只有克隆较小的肺转移灶。转移灶数分别为(54.8±17.84)个vs.(14.4±4.70)个,差异有统计学意义(P<0.05)(图9A-B)。ITGB1低表达Lovo结肠癌细胞注射组小鼠的生存时间明显长于对照组(图9C)。
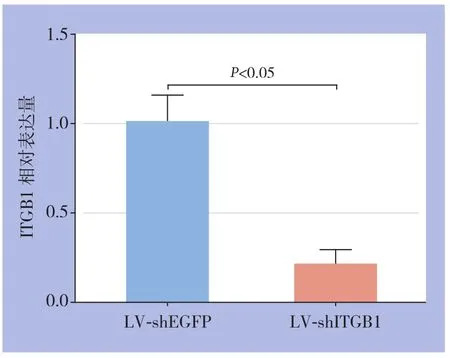
图7 转染ITGB1 shRNA后结肠癌细胞ITGB1的表达水平Figure 7 The ITGB1 expression level in colon cancer cells after transfection of ITGB1 shRNA

图8 ITGB1对结肠癌细胞凋亡的影响Figure 8 The influence of ITGB1 on apoptosis in colorectal cancer cells
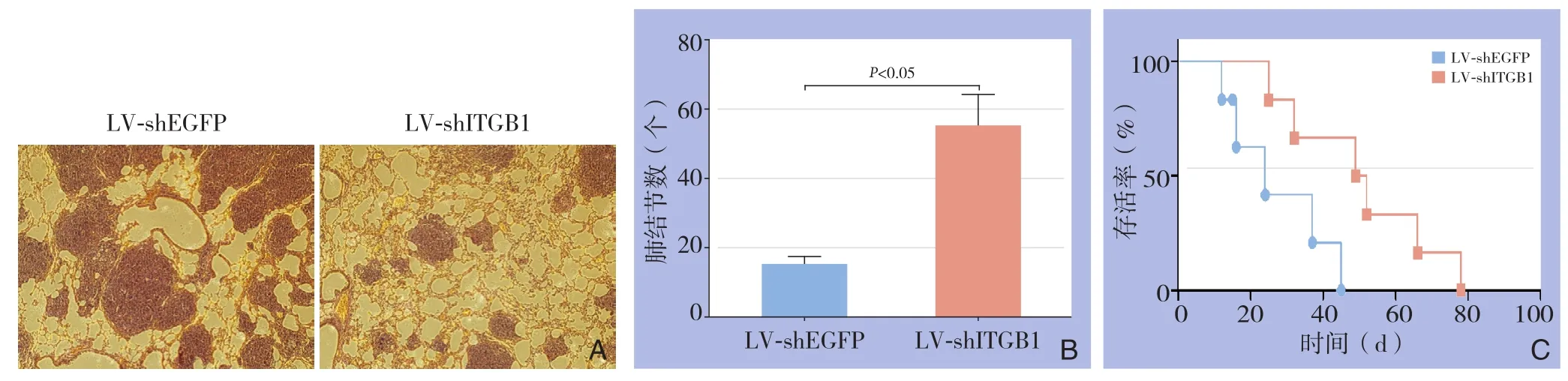
图9 ITGB1对结肠癌细胞小鼠肺转移及生存的影响 A:显微镜下观察(HE×200);B:肺转移灶比较;C:生存时间比较Figure 9 The influence of ITGB1 on pulmonary metastasis and survival in nude mice A: Views under microscopes (HE×200);B: Comparison of the pulmonary metastases; C: Comparison of the survival times
2.8 miR-124与ITGB1表达的相关性分析
为进一步明确miR-124与潜在靶基因ITGB1在结肠癌发生与发展进程中的联系,分析了所收集结肠癌组织样本中miR-124与ITGB1在RNA水平的表达相关性。结果如图所示:miR-124与ITGB1呈负相关(r=-0.4936,P=0.002)(图10)。
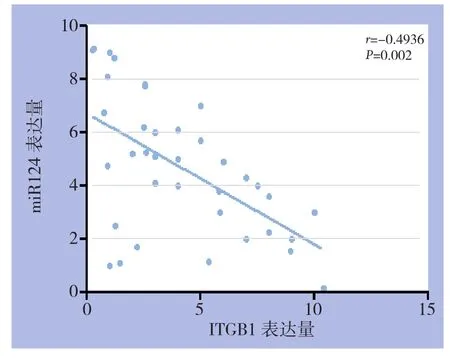
图10 miR124与ITGB1表达的相关性Figure 10 Correlation between miR124 and ITGB1 expressions
3 讨 论
3.1 miRNA与肿瘤细胞生物学机制研究
结肠癌是一种常见的消化道恶性肿瘤,其致死性高、预后差,肿瘤转移复发是致死的重要原因[9]。肿瘤细胞复发、转移过程极其复杂,牵涉多种分子生物学机制。而近年来生物治疗成为了治疗肿瘤的重要突破口,因此,寻找其治疗靶点对治疗结肠癌具有重要意义。
在肿瘤的发生及进展中,癌基因及抑癌基因均起到调节作用,越来越多的人类miRNA 被发现证实与肿瘤的侵袭、转移等生物学行为密切相关,在肿瘤发生发展过程中起着致癌或抑癌的作用。根据国内外的研究报道,miRNA-124在人类疾病中扮演着重要的角色,其与儿童溃疡性结肠炎[10]、阿尔兹海默症[11-12]以及多种恶性肿瘤[4,13-15]关系密切。有报道[16]发现miR-124在结肠癌中低表达,并调控结肠癌的放疗敏感性;另有研究[17]报道,miR-124在结肠癌中靶向抑制ROCK1的表达,进而调控结肠癌细胞的生物学行为。而miRNA的靶基因众多,目前miRNA对结肠癌生物学行为的影响机制并不十分明确。因此,对miRNA-124影响结肠癌细胞生物学行为的机制进行了进一步的探讨。
3.2 miR124以往及本研究的成果
与之前关于miR-124的研究报道结果类似,本研究发现miR-124在结肠癌组织中表达水平下降,另外,发现miR-124在结肠癌组织中的表达与肿瘤大小、TNM分期、淋巴转移分类有关。而以上结果与miR-124在胃癌中发现的情况相似[18]。为了研究miR-124对结肠癌细胞凋亡的影响,本研究构建了过表达miR-124慢病毒系统,经过感染的结肠癌细胞miR-124表达量提高了500多倍。通过结肠癌细胞悬浮培养模型结合流式细胞仪的检测发现,miR-124可以显著影响结肠癌细胞的抗脱落凋亡的敏感性,即促进离巢结肠癌细胞的凋亡。有理由认为miR-124调节肿瘤细胞的抗脱落凋亡的敏感性可能是其抑制结肠癌远处脏器转移灶形成的重要原因之一,进而削弱肿瘤转移的能力。本研究通过裸鼠体内实验发现miR-124抑制裸鼠结肠癌的肺转移并可以延长裸鼠的生存时间。但miR-124通过何种机制来调控靶基因来影响结肠癌细胞的生物学行为,都需要进一步的深入研究。
在以往的研究中,miR-124被发现可以通过抑制其靶基因STAT3[19-20]、KITENIN[21]、GATA6[22]及capn4[23]来抑制肿瘤细胞侵袭转移。而miR-124在结肠癌中是否还通过其他靶基因影响来侵袭转移能力尚不清楚。经过软件预测分析,miR-124的靶基因可能是ITGB1,ITGB1作为一种重要的黏附分子在肿瘤的侵袭和转移中扮演着重要作用[24]。在结肠癌组织中发现miR-124与ITGB1 mRNA的表达水平成显著负相关,并通过双荧光素酶试验及Western blot实验证实ITGB1是miR-124的直接靶基因。在设计的ITGB1低表达的结肠癌细胞中,也发现ITGB1的下调可以促进结肠癌细胞的脱落凋亡敏感性,进而抑制结肠癌细胞肺转移,而这与miR-124对结肠癌细胞的生物学行为影响基本一致。
3.3 基于miR124研究的临床应用前景
miRNA与肿瘤的发生、发展、肿瘤转移和预后密切相关,其研究成果可能对肿瘤治疗产生重要作用[25]。本研究发现,miR-124在结肠癌中低表达,并与肿瘤大小、TNM分期、淋巴转移分类有关,miR-124在结肠癌细胞中扮演着抑制结肠癌细胞侵袭转移的角色,经过实验验证其是通过抑制靶基因ITGB1来实现的。这为下一步研究结肠癌中miR-124影响结肠癌细胞生物学行为的研究建立了细胞模型,并为如何将miR-124应用于临床治疗提供了依据,为治疗结肠癌及控制复发转移的治疗方法做出了一些探索。

