过表达IDO的骨髓间充质干细胞分泌外泌体下调树突状细胞免疫促进分子表达和上调Treg细胞数量
谢巧丽,李贝贝,撒亚莲,韩金秀,严丹,贺继刚*
(昆明理工大学附属医院,云南省第一人民医院1心脏大血管外科,2基础研究所,3重症医学科,昆明650032)
终末期器官的治疗是困扰医学界的一个难点,移植是治疗的有效手段,而器官排异反应是影响移植器官存活的主要问题。间充质干细胞(bone marrow mesenchy mal stem cells, BMSCs)可以通过分泌细胞因子抑制T细胞的成熟及增殖,发挥免疫抑制作用[1]。吲哚胺2, 3-双加氧酶(indoleamine 2, 3-dioxygenase, IDO)可催化色氨酸转化为犬尿氨酸,而犬尿氨酸是一种毒性代谢产物,可抑制T细胞的增殖,即IDO主要通过催化色氨酸所产生的毒性产物犬尿氨酸发挥免疫抑制作用[2]。外泌体(exosome, ES)是细胞产生的鳞片状脱落囊泡,具有多种生物学功能,能使细胞在不直接接触下完成细胞与细胞间生物信号的传导[3]。为了明确在BMSCs中过表达IDO是否可以通过分泌外泌体对DC细胞和T细胞发挥免疫抑制剂调节作用。本研究通过构建过表达IDO-BMSCs并提取分泌的外泌体,检测过表达IDO的BMSCs分泌的外泌体对DC细胞表面CD40、CD86、CD80、MHCII、CD274、CD45RA、CD45RA+CD45RB 、OX62等免疫调节分子表达及对T细胞CD4、CD8等标志物表达和调节性T细胞(T regulatory cells, Treg细胞)亚群数量的影响。
材料与方法
1 实验动物
SPF级雄性健康5周龄SD大鼠9只,由成都达硕公司提供,许可证号:SCXK(川)2015—030。动物喂养按照非临床研究管理规范执行。
2 实验试剂和仪器
各流式抗体购自eBioscience(美国);细胞因子购自PeproTech(美国);大鼠DC细胞纯化磁珠购自Miltenyi(德国);定量多聚酶链检测仪购自ABI(美国);流式细胞仪购自BD(美国)。
3 大鼠BMSC的分离、培养及鉴定
采用全骨髓贴壁法提取大鼠骨髓间充质干细胞,经胰蛋白酶消化,反复传代培养至P7代,流式细胞检测大鼠骨髓间充质干细胞CD29、CD44、CD90、CD73、CD45、CD11b、CD34的表达,结果显示BMSCs中超过90%细胞表达CD29、CD44、CD90和CD73,不表达CD45、CD11b和CD34[4]。
4 IDO过表达慢病毒载体及基因开启技术构建过表达IDO大鼠骨髓间充质干细胞
将已构建成功的IDO 基因插入慢病毒包装质粒GV308 中,构建GV308- IDO 重组慢病毒包装质粒。用慢病毒包装辅助元件Psi、cPPT、3FLAG、TetR、IRES、WRPE、TetIIP、Ubiquitin Promoter、SV40 origin 及 HIV 的基本元件 5’LTR 和 3’LTR,共培养法转染80%融合的BMSCs 细胞。加入DOX(强力霉素)48h后,以定量RT-PCR检测比较过表达IDO大鼠骨髓间充质干细胞(IDO-BMSCs)和对照大鼠骨髓间充质干细胞(NC-BMSCs)IDO mRNA表达水平(IDO-BMSCs IDO mRNA较NC-BMSCs mRNA增高62906.27倍)[4]。
5 外泌体提取及检测
收集细胞培养液以3,000× g离心15min,以去除细胞及细胞碎片。 而后将上清液转移至无菌管中,加入适当体积的ExoQuick-TC Exosome 沉淀液。冷藏(4℃)过夜至少12h。1, 500g离心ExoQuick-TC/体液混合液,30min。Exosome沉淀位于试管底部,呈浅褐色或白色。扫描电镜观察可见外泌体呈白色、圆形、大小40~100nm的颗粒(图1)。

图1 外泌体形态扫描电镜检测。比例尺,100nmFig. 1 Scanning electron microscopic observation on morphology of the exosomes. Scale bar, 100nm
6 外周血来源DC细胞的分离和培养
经大鼠腹主动脉提取大鼠血液10ml,采用粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colonystimulating factor,GM-CSF)联合白细胞介素4(interleukin-4,IL-4)进行诱导培养10d,在培养皿可见半悬浮状态细胞,轻轻摇动培养皿可见细胞发生脱落,而后收集含有细胞的上清液[5]。
7 T细胞获取
取SD大鼠脾脏,制备细胞悬液而后按照MACS[Anti-Rat DC(OX62) MicroBeads]磁珠纯化说明书进行细胞纯化。纯化过程如下:每107个细胞用80μl的MACS buffer重悬细胞。并加入20ul MACS。混匀,4℃放置15min。300g离心10min,弃上清;用500μl 的buffer重悬细胞,将柱子放到磁力架的合适位置,用500μl的缓冲液润洗一下柱子,将细胞悬液加到柱子中。收集流过柱子的细胞,用缓冲液冲洗三次,收集负选细胞即为T细胞。
8 实验分组与DC/T细胞的外泌体培养
A组:IDO-BMSCs外泌体与DC细胞培养组(IDO-BMSCs-ES+DC);B组:IDO-BMSCs外泌体与T细胞培养组(IDO-BMSCs-ES+T);C组:NC-BMSCs外泌体与DC细胞培养组(NC-BMSCs-ES+DC);D组:NC-BMSCs外泌体与T细胞培养组(NC-BMSCs-ES+T);E组:BMSCs外泌体与DC细胞培养组(BMSCs-ES+DC);F组:BMSCs外泌体与T细胞培养组(BMSCs-ES+T);G组:无外泌体的DC细胞培养组(DC);H组:无外泌体的T细胞单独培养组(T)。将相应大鼠骨髓间充质干细胞分泌的外泌体浓度调整为800mg/ml,每组加入的外泌体浓度一致,将大鼠DC及T细胞进行计数以1∶1比例与各细胞分泌的外泌体共培养,同时加入5µg/ml的脂多糖,48h后以定量RT-PCR检测DC细胞内IDO mRNA表达水平,流式细胞术检测A、C、E、G组CD40、CD86、CD80、MHCII、CD274、CD45RA、CD45RA+CD45RB、OX62表达水平和B、D、F、H组中Treg、CD4及CD8表达水平。
9 定量RT-PCR
在Pubmed上查询对应物种的目的基因mRNA序列,以CDS序列设计引物。引物序列:Ido1-F TTAAGACGCAATGAAGACT;Ido1-R GAGGTGGAACATTCTGAG。提取总RNA并检测RNA浓度。RNA 逆转录合成cDNA第一条链。采用Q-PCR扩增目的基因。设置PCR循环反应条件:预变性95℃10min,变性95℃ 15s,退火及延伸60℃ 30s(40-45个循环),溶解曲线分析:95℃:15s;60℃:30s;95℃:15s。放入ABI StepOne仪器中完成上述步骤。
10 流式细胞术
待共培养至48h后,收集消化相应分组的细胞。取100μl细胞悬液分装到1.5mlEP管中,加相应抗体,避光孵育15min。每支100μl的细胞悬液加相应抗体量为1μl 0.5mg/ml CD40 抗体、0.8μl 0.2mg/ml CD86抗体、1.4μl 0.2 mg/ml CD80抗体、2μl 0.5mg/ml MHCII抗体、1μl 0.5mg/ml CD274 抗体、0.5μl 0.2mg/mL CD45RA 抗体、1.4μl 0.1mg/ml CD45RA+CD45RB抗体、8μl 0.1mg/ml OX62抗体、0.5μl 0.5mg/ml CD3抗体、1μl 0.2mg/ml CD4抗体、0.5μl 0.2mg/ml CD8抗体,采用流式细胞技术检测上述分子的表达量[4]。
Treg细胞染色与检测步骤:取100μl细胞悬液到离心管中,加细胞表面抗原0.5μl 0.5mg/ml CD4和0.5μl 0.2mg/ml CD25,避光孵育20min。加1ml Foxp3固定/穿透液进行涡旋,室温避光孵育40min;加2ml 1×穿透缓冲液,500g离心5min,弃上清;用100μl 穿透缓冲液重悬细胞,1000r/min离心5min弃上清使剩余体积约为100μl。加3μl细胞内染色抗体0.2mg/ml Foxp3抗体,室温避光孵育40min。加2ml 1×穿透缓冲液,500g离心5min,弃上清。加300μl PBS重悬细胞后,采用BD Accuri C6流式细胞仪进行检测。
11 统计学分析
使用SPSS15.0软件进行统计分析。数据以¯x±s表示。各组间比较采用单因素方差分析。所有统计假设检验均为双侧。以P<0.05为差异有统计学意义。
结 果
1 IDO-BMSCs外泌体培养上调DC细胞IDO表达
定量RT-PCR检测显示,以过表达IDO的BMSCs分泌的外泌体(IDO-BMSCs-ES)培养的DC细胞内IDO表达量显著高于NC-BMSCs-ES或BMSCs-ES 培养的DC细胞及单独培养的DC细胞(图2),即IDO基因修饰的MBSCs分泌的外泌体能显著上调DC细胞IDO的表达。
2 IDO-BMSCs外泌体下调DC细胞中CD40、CD86、CD80、MHCII、CD45RA+CD45RB、OX62表达,上调CD274表达
流式细胞术检测显示(图3),以IDO-BMSCs-ES培 养 的 DC细 胞 中,CD40、CD86、CD80、MHCII、CD45RA+CD45RB和OX62表达率显著低于NC-BMSCs外泌体、BMSCs-ES外泌体分别培养的 DC细胞和无外泌体培养的DC细胞,而以IDO-BMSCs外泌体培养的DC细胞中CD274表达率显著高于NC-BMSCs外泌体、BMSCs-ES外泌体分别培养的 DC细胞和无外泌体培养的DC细胞,即IDO-BMSCs外泌体培养显 著下调DC细胞中CD40、CD86、CD80、MHCII、CD45RA+CD45RB和OX62的表达,上调CD274的表达;IDO-BMSCs外泌体培养,对DC细胞组CD45RA的表达无明显影响。
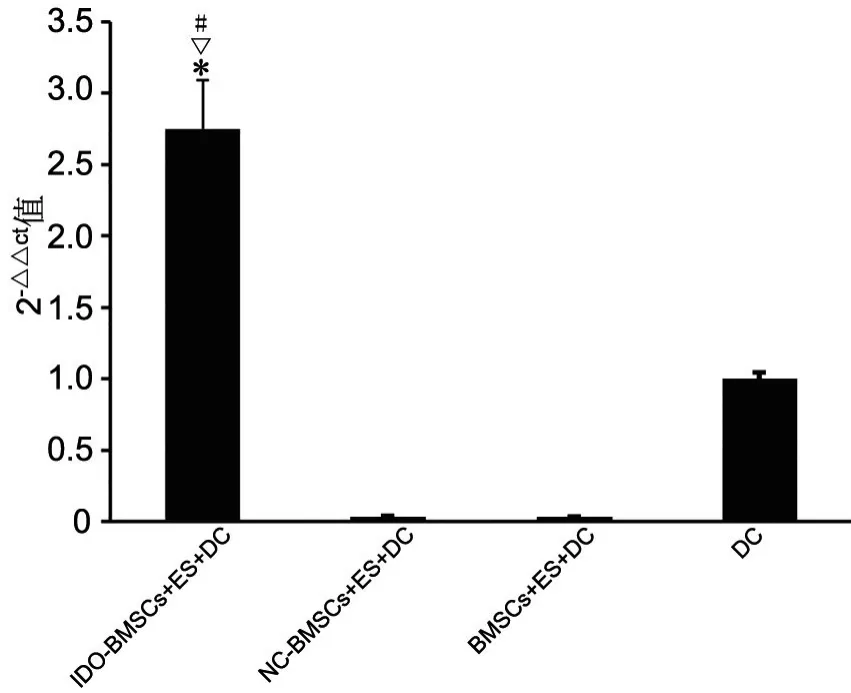
图2 IDO-BMSCs外泌体培养对DC细胞IDO mRNA表达影响的定量RT-PCR检测。*,与NC-BMSCs-ES+DC组比较,P<0.01;#,与BMSCs-ES+DC组比较, P<0.01;▽,与DC组比较,P<0.01;n=3Fig. 2 Quantitative RT-PCR detection for the effect of culture with IDO-BMSCs exosomes on expression of IDO mRNA of DC cells. *,compared with NC-BMSCs-ES+DCgroup, P<0.01; #, compared BMSCs-ES+DC group, P<0.01; ▽, compared with DC group, P<0.01; n=3
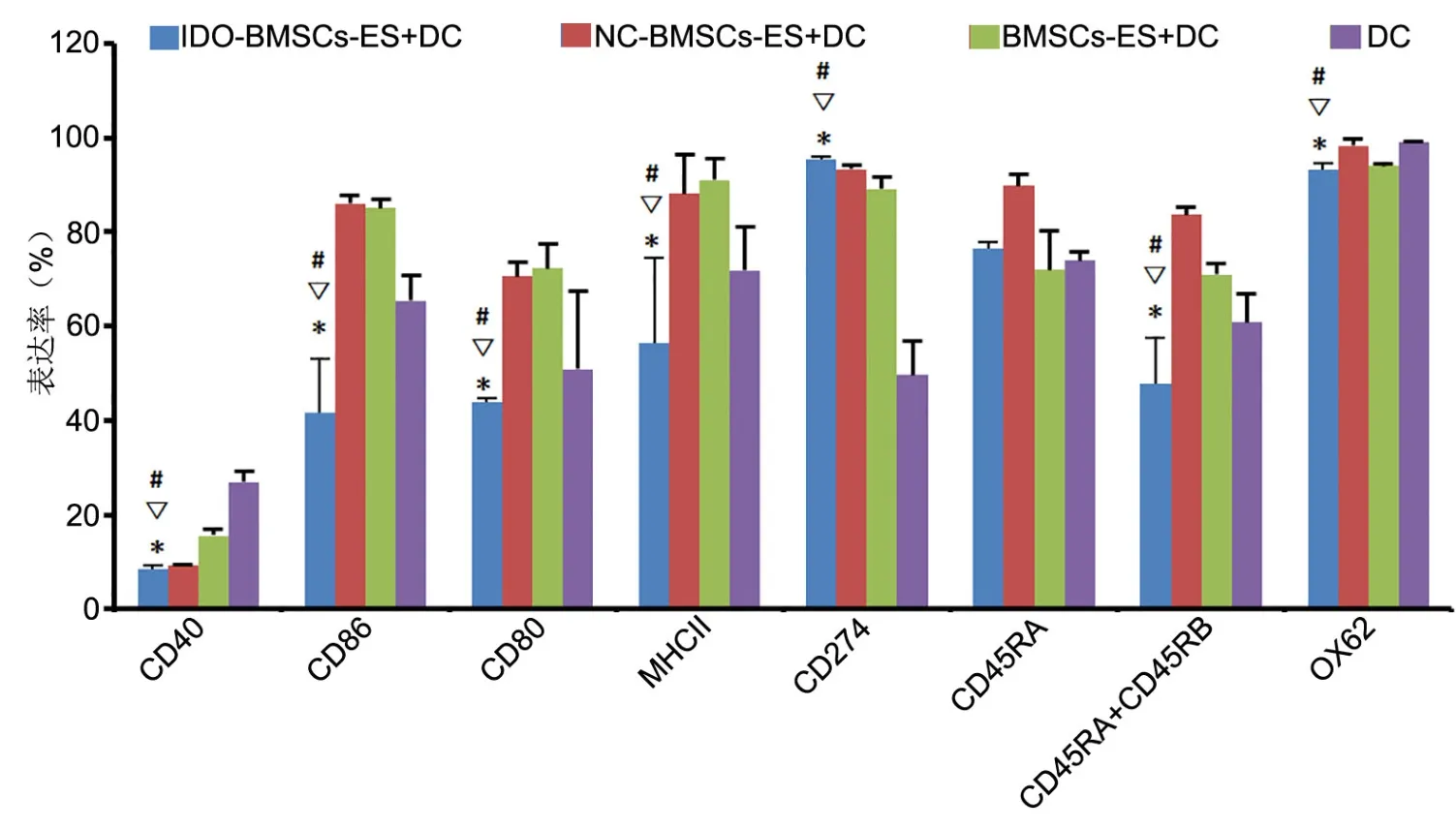
图3 IDO-BMSCs外泌体培养对DC细胞中免疫调节分子表达影响的流式细胞术分析。*,与NC-BMSCs-ES+DC组比较,P<0.01;#,与BMSCs-ES+DC组比较, P<0.01;▽,与DC组比较,P<0.01Fig. 3 Flow cytometry analysis of the effect of culture with IDO-BMSCs exosomes on the expression of immunoregulatory molecules on DC cells. *,compared with NC-BMSCs-ES+DCgroup, P<0.01; #, compared BMSCs-ES+DC group, P<0.01; ▽ , compared with DC group, P<0.01
3 IDO-BMSCs外泌体使T细胞中Treg细胞数量和CD8表达下调
流式细胞检测显示(图4),以IDO-BMSCs外泌体培养的T细胞中,Treg细胞表达水平显著高于NC-BMSCs外泌体、BMSCs外泌体分别培养的T细胞或无外泌体培养的T细胞;而以IDO-BMSCs外泌体培养的T细胞中CD8表达率显著低于NC-BMSCs外泌体、BMSCs外泌体或无外泌体分别培养的T细胞。即IDO-BMSCs外泌体培养显著上调T细胞中Treg细胞数量,下调CD8细胞的数量,IDO-BMSCs外泌体培养对T细胞中CD4细胞的数量无明显影响。
讨 论
器官移植是治疗终末衰竭器官的一种有效方法,但由于免疫排异反应及昂贵的免疫抑制剂使得该项技术发展非常缓慢。基于此,本研究力图找到一种行之有效的生物免疫抑制剂。

图4 IDO-BMSCs外泌体培养对T细胞中亚群数量影响的流式细胞术分析。*,与NC-BMSCs-ES+T组比较,P<0.05;#,与BMSCs-ES+T组比较, P<0.05;▽,与T组比较,P<0.05Fig. 4 Flow cytometry analysis of the effect of culture with IDO-BMSCs exosomes on the number of T cells subgroups. *, compared with NC-BMSCs-ES+DCgroup, P<0.05; #, compared BMSCs-ES+DC group, P<0.05;▽, compared with DC group, P<0.05
最新研究发现骨髓间充质干细胞(BMSCs)可以抑制免疫排异反应[6,7]。吲哚胺2, 3双加氧酶(IDO)是母体耐受胎儿的一个重要的因子[8]。而外泌体可以使细胞在不需要直接接触下完成细胞间生物信号转导[9]。
目前已经研究证明DC细胞表面表达的免疫调节分子,如CD40、CD86、CD80、MHCII、、CD45RA、CD45RA+CD45RB 、OX62表达的降低可以抑制DC细胞的免疫应答能力[10]。IDO-DC细胞则是DC细胞中一类免疫耐受细胞,其数量的增加可以抑制DC细胞的抗原递呈作用[11]。而CD4、CD8则是T细胞中产生免疫应答的两类主要的T细胞亚群CD4细胞又称为免疫系统的辅助手(helper),能指挥身体对抗微生物,例如病原微生物;CD8+T细胞通过直接杀伤作用,主要负责对靶细胞的清除,如被病毒感染的细胞。Treg细胞是一类具有免疫负调控功能的T细胞亚群,早期亦称做suppressor T cells,能同时表达CD4、CD25和Foxp3[10]。
本实验正是在上述研究基础上通过体外细胞共培养采用RT-PCR、流式细胞技术证实,过表达IDO的BMSCs分泌的外泌体与DC细胞共培养48h后DC细胞的 CD40、CD86、CD80、MHCII、CD45RA、CD45RA+CD45RB 、OX62表达降低,而CD274的表达升高。目前已知CD40是一种抗原呈递细胞上的共刺激蛋白,它是激活抗原呈递细胞所必须的。CD86是抗原呈递细胞上表达的蛋白质,它是T细胞活化和存活所必需的共刺激信号分子。CD80是在活化的B细胞和单核细胞上发现的蛋白质,其提供T细胞活化和存活所必需的共刺激信号。MHCII类分子仅存在于抗原呈递细胞如树突细胞,单核巨噬细胞[4]。以上分子表达的减少抑制DC细胞的免疫应答活性。而CD274(PD-L1,B7-H1)是在人类中由CD274基因编码的蛋白质,PD-L1是一个40kDa的1型跨膜蛋白,现已证实它能起到抑制免疫系统的作用[4]。PD-L1表达的增加,可以有效改善DC细胞对免疫系统抑制。说明过表达IDO-BMSCs分泌的外泌体调节免疫的关键细胞为DC细胞。采用RT-PCR检测各BMSCs分泌的外泌体与DC细胞共培养中DC细胞内IDO表达量,可见过表达IDO-BMSCs分泌的外泌体与DC细胞共培养,其DC细胞内IDO表达量最高。证明过表达IDO-BMSCs细胞分泌的外泌体可以促进耐受性DC细胞生成[10]。
各组分泌的外泌体在与T细胞共培养48h,T细胞中Treg数量增加,CD4阳性T细胞的变化无明显规律,但CD8阳性T细胞降低。目前已知,在免疫学中,CD3 T细胞有助于激活细胞毒性T细胞,CD4是免疫细胞如T辅助细胞、单核细胞、巨噬细胞和树突状细胞的表面上发现的糖蛋白。CD8结合主要组织相容性复合体(MHC)分子,但是只特异性识别I类MHC蛋白。FOXP3是参与免疫系统反应的蛋白质,作为FOX蛋白家族的一员,FOXP3在Treg细胞的发育和功能中起主调节作用;Treg细胞通常使免疫应答降低[4]。因此,过表达IDO-BMSCs分泌的外泌体调节T细胞的群体为CD8阳性的T细胞并可以促进Treg细胞的增生。
由此可见,过表达IDO的BMSCs分泌的外泌体可以通过有效调节DC细胞及T细胞,从多个免疫层面进行免疫抑制调节。

