大豆种子分泌物对大豆疫霉发育行为的影响及其与品种抗病性关系
文景芝,徐 莹,张卓群,宋光梅,陈宇飞,赵钰琦,高新颖,贾梦瑱,朱加楠
(东北农业大学农学院,哈尔滨 150030)
大豆疫霉根腐病(Phytophthora root rot)是由大豆疫霉(Phytophthora sojae Kaufmann and Gerdemann)引起的世界性土传病害,可造成重大经济损失[1]。
生育期大豆均可被大豆疫霉侵染,出苗前侵染种子引起烂种,出苗后侵染根部和茎基部导致地上部枯萎。大豆疫霉以卵孢子形式在病残体或土壤中越冬并作为初侵染源[2],当土壤温湿度适宜时,卵孢子萌发形成孢子囊,孢子囊由顶口释放游动孢子,游动孢子是大豆疫霉侵染寄主主要形式,游动一定时间后便可成囊、萌发[3],通过芽管穿透寄主表皮侵入[4]。
种子分泌物作为种子际一部分,对种子周围病原菌生长和发育尤为重要[5]。种子分泌物中营养物质可为病原菌生长提供能量[6],其抑菌物质可抑制病原菌生长发育[7],抵抗病原菌入侵,与植物抗病性关系密切。
大量研究证明种子分泌物中含有抑菌物质,如羽扇豆(Lupinus albus)种子分泌物中含有大量几丁质酶,可有效抑制病原真菌生长[8];菜豆(Phaseolus vulgaris L.)抗病品种种子分泌物抑制灰葡萄孢菌(Botrytis cinerea)菌丝生长,与种子分泌物中含有较多酚类物质有关[9]。大豆抗病品种与大豆疫霉非亲和互作涉及一系列复杂机制,包括固有抗病性和诱导抗病性。大豆疫霉根腐病是典型“基因对基因”病害[10],大豆疫霉接触寄主时,寄主大豆抗病基因(Rps gene)识别病原菌Avr基因(Avirulence gene)后产生蛋白效应子激发免疫反应(Effectorstriggered immunity,ETI)[11],限制大豆疫霉侵染。另一方面,植物产生与抗病性有关生理活性物质,由病原菌侵染诱导产生,如β-1,3葡聚糖酶[12]等,或植物固有木栓质[13]等。
目前,Rps基因定位和鉴定拓展大豆疫霉诱导性抗病机制研究[14],关于固有抗病性机理研究有限。种子分泌物作为寄主植物固有抗病性是抗病过程重要部分,本试验选用大豆疫霉抗病品种Williams82和感病品种Sloan,测定其种子分泌物对大豆疫霉发育行为的影响,分析大豆种子分泌物与品种抗病性关系,为了解大豆抗病品种种子分泌物在大豆抗疫霉根腐病中作用,有效控制该病害提供科学依据。
1 材料与方法
1.1 材料
供试菌株:增强型绿色荧光蛋白标记菌株Eps597-3,由东北农业大学农学院植物病理实验室提供,致病型为1a,3c,7。
供试大豆品种:感病品种Sloan,不含任何已知抗大豆疫霉根腐病基因,可被大豆疫霉任何生理小种侵染;抗病品种Williams82,对供试菌株Eps597-3表现抗病;以上2个品种均由Dr.Sung M.Lim(University of Arkansas)惠赠。
供试培养基:胡萝卜琼脂(Carrot agar,CA)培养基,称取200 g新鲜胡萝卜,加少量无菌蒸馏水,组织捣碎机搅碎,四层纱布过滤,滤液中加20 g琼脂粉,煮沸熔化,加无菌蒸馏水补至1 000 mL,分装,121℃高压灭菌30 min。
1.2 方法
1.2.1 大豆种子分泌物收集
分别称取籽粒饱满、尺寸均匀抗感品种大豆种子20 g,75%酒精消毒1 min,超纯水漂洗3次,放在无菌培养皿(d=10 cm)中,加入20 mL超纯水,置于黑暗条件下25℃恒温培养,24 h后种子吸水膨胀释放种子分泌物,补充超纯水至20 mL。48 h后收集种子分泌物,收集浓度为1 g种子鲜重对应1 mL超纯水,孔径为0.22 μm一次性细菌滤器过滤,分装置于-80℃冰箱保存。试验所用种子分泌物终浓度均为20%收集浓度。
1.2.2 大豆种子分泌物对大豆疫霉菌丝生长及卵孢子形成的影响
将保存的Eps597-3菌株转移至胡萝卜琼脂培养基活化4~5 d,取抗、感病大豆种子分泌物溶液分别与胡萝卜琼脂培养基混合后倒平板(d=5 cm),打孔器选取长势一致大豆疫霉菌饼转移至平板中央,黑暗条件25℃恒温培养,每隔12 h测定菌落直径,以加等量超纯水胡萝卜琼脂培养基为空白对照,评价不同品种种子分泌物对大豆疫霉菌丝生长的影响(参照文献[15]方法,稍作改进)。分别于第5、7及10天在每个处理相同位置选取3个菌碟,显微镜下观察记录卵孢子数量,每个菌碟100×显微镜下观察3个视野,记录各处理下卵孢子形成情况。每个处理3次重复,3次生物学重复。
1.2.3 大豆种子分泌物对大豆疫霉卵孢子萌发的影响
大豆疫霉卵孢子悬浮液制备:将保存的Eps 597-3菌株转移至胡萝卜琼脂培养基培养30 d,从平板上切取含大量卵孢子的琼脂块,加超纯水50 mL,组织捣碎匀浆机(5 000 r·min-1)匀浆2 min,匀浆液经4层纱布过滤获得卵孢子悬浮液,将卵子悬浮液配制成适当浓度备用(参照文献[16]方法)。
取卵孢子悬浮液和抗、感病大豆种子分泌物溶液加入离心管中,充分混合后置于25℃培养箱内恒温培养,以加等量超纯水代替种子分泌物为空白对照,分别于5、7及10 d观察各处理卵孢子萌发情况,每个处理随机选取200个卵孢子,计算萌发率。每个处理3次重复,3次生物学重复。
1.2.4 大豆种子分泌物对大豆疫霉游动孢子趋化性的影响
大豆疫霉游动孢子悬浮液制备:将保存的Eps597-3菌株转移至胡萝卜琼脂培养基上活化4~5 d,打孔器将菌落分割成直径约1 cm菌饼,放入无菌培养皿中,加超纯水至刚好超过菌饼表面。将培养皿置于20℃培养箱中恒温培养,期间每隔30 min换1次超纯水促进孢子囊产生。7~8 h后镜检孢子囊产生情况,待产生大量孢子囊后,置于4℃冰箱,40 min后取出,放至实验台上静置2~3 h,即可产生大量游动孢子。移除菌饼,将游动孢子悬浮液配制成适当浓度备用。
在洁净载玻片上相距3 cm位置粘两条塑料片,两条塑料片上盖玻片,形成深度为3 mm空间。用移液枪向空间内加入新鲜游动孢子悬浮液(2×104个·mL-1),使其充满全部空间。取2 μL抗、感病大豆种子分泌物溶液毛细管插入趋化性测定室一端3 mm,另一端插入2 μL超纯水毛细管作对照(参照文献[17]方法,稍作改进)。分别记录5、15及25 min时两只毛细管游动孢子数量,比较大豆疫霉游动孢子对抗病和感病大豆品种种子分泌物趋化性差异。试验时室内温度25℃,每个处理重复3次,3次生物学重复。
1.2.5 大豆种子分泌物对大豆疫霉游动孢子成囊的影响
取2×104个·mL-1游动孢子新鲜游动孢子悬浮液加入离心管中,向离心管加入抗、感病大豆种子分泌物溶液,混合均匀。取混合液加入凹玻片凹槽内,以加等量超纯水代替种子分泌物为空白对照。将凹玻片放置实验台上,分别记录30 min、1 h及2 h时各处理游动孢子成囊率。试验时室内温度25℃,每处理重复3次,3次生物学重复。
1.2.6 大豆种子分泌物对大豆疫霉孢囊萌发的影响
取含有2×104个·mL-1新鲜游动孢子悬浮液加入离心管中,10 000 r·min-1涡旋混合器中震荡70 s即可使游动孢子成囊。向游动孢子悬浮液中加入抗、感病大豆种子分泌物溶液,混合均匀后置于实验台上培养,以加等量超纯水代替种子分泌物为空白对照,取混合液加入凹玻片凹槽内,分别记录8、9及10 h时各处理孢囊萌发率。试验时室内温度25℃,每个处理重复3次,3次生物学重复。
2 结果与分析
2.1 抗、感大豆品种种子分泌物对大豆疫霉菌丝生长的影响
大豆疫霉菌丝72~96 h时生长速率最快,120 h时充满玻璃皿(d=5 cm)。感病品种Sloan种子分泌物促进大豆疫霉菌丝生长,抗病品种Williams82种子分泌物抑制大豆疫霉菌丝生长(见图1A)。随时间推移,感病品种Sloan种子分泌物促进作用逐渐减小,而抗病品种Williams82种子分泌物抑制作用逐渐增强,但与空白对照相比,均未达显著差异,因此认为抗、感大豆品种种子分泌物对大豆疫霉菌丝生长无显著影响(见表1)。
2.2 抗、感大豆品种种子分泌物对大豆疫霉卵孢子形成的影响
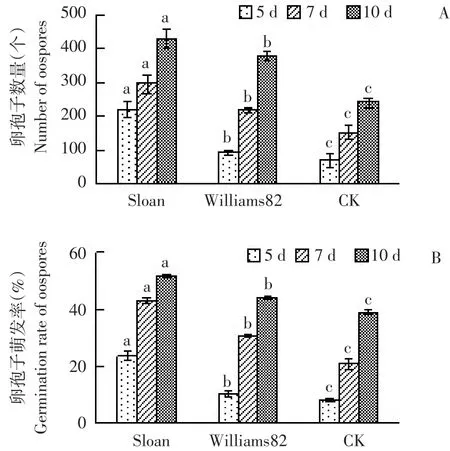
与对照相比,抗、感大豆品种种子分泌物均显著促进卵孢子形成。接种后5 d内感病品种Sloan种子分泌物处理卵孢子形成速率显著高于抗病品种Willams82(见图2A)。7 d时,感病品种Sloan种子分泌物处理卵孢子平均数量为297.3个,抗病品种Williams82为219个,对照处理为147.7个(见图1B)。随时间推移,抗、感品种种子分泌物处理间卵孢子数量差距逐渐缩小,但仍均显著高于对照,10 d时,感病品种Sloan种子分泌物处理卵孢子平均数量为427个,抗病品种Williams82为377个,超纯水对照处理为242个。
2.3 抗、感大豆品种种子分泌物对大豆疫霉卵孢子萌发的影响
抗、感大豆品种种子分泌物处理卵孢子萌发率均显著高于对照,感病品种Sloan种子分泌物处理卵孢子萌发率显著高于抗病品种Williams82(见图2B)。
随时间推移,各处理卵孢子萌发率逐渐增加。7 d时,感病品种Sloan种子分泌物处理卵孢子萌发率为43.05%,抗病品种Williams82为30.59%,超纯水对照处理为20.94%(见图1C)。

图1 抗、感大豆品种种子分泌物对大豆疫霉菌丝生长、卵孢子形成及萌发的影响Fig.1 Effects of seed exudates of resistant and susceptible soybean cultivars on Phytophthora sojae mycelial growth,oospores formation and germination
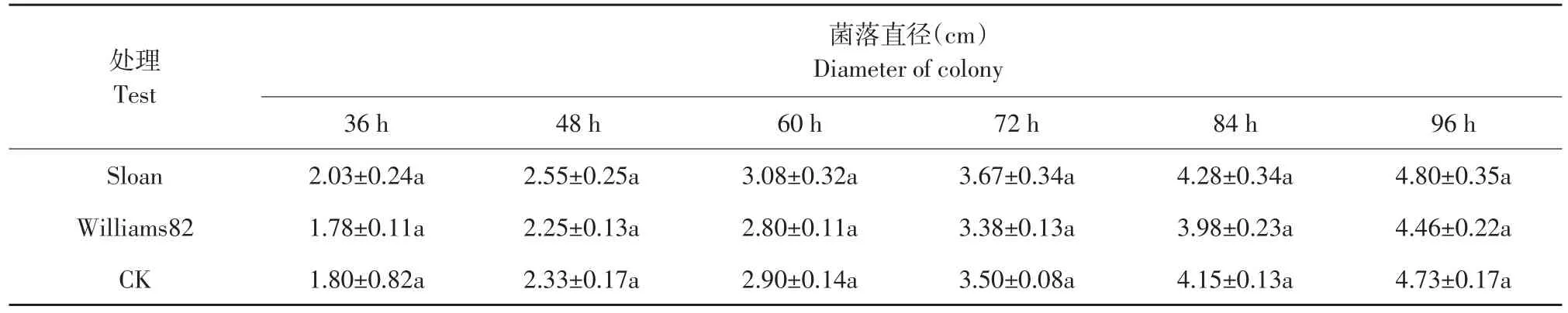
表1 抗、感大豆品种种子分泌物对大豆疫霉菌丝生长影响Table 1 Effect of seed exudates of resistant and susceptible soybean cultivars on mycelial growth of Phytophthora sojae
2.4 抗、感大豆品种种子分泌物对大豆疫霉游动孢子趋化性的影响
与对照相比,抗、感大豆品种种子分泌物显著吸引大豆疫霉游动孢子,其中感病品种Sloan种子分泌物吸引大豆疫霉游动孢子数量显著高于抗病品种Williams82(见图3)。分别测定接种后5、15和25 min时吸引游动孢子数量,发现15 min时种子分泌物对游动孢子吸引量达最高值,感病品种Sloan种子分泌物吸引游动孢子平均为143.8个,抗病品种Williams82为58.2个,超纯水对照处理为28.9个(见图4A)。
2.5 抗、感大豆品种种子分泌物对大豆疫霉游动孢子成囊的影响
与对照相比,抗、感大豆品种种子分泌物显著促进大豆疫霉游动孢子快速成囊,其中感病品种Sloan种子分泌物中游动孢子成囊速度更快,成囊率显著高于抗病品种Williams82(见图5A)。与种子分泌物混合1 h后,感病品种Sloan种子分泌物中游动孢子成囊率已达89.63%,抗病品种Williams82为52.08%,超纯水对照处理为17.11%(见图4B);2 h时,成囊率依次为96.9%、89.39%和59.52%。
2.6 抗、感大豆品种种子分泌物对大豆疫霉游动孢囊萌发的影响
抗、感大豆品种种子分泌物孢囊萌发率显著高于超纯水对照,其中,感病品种Sloan种子分泌物中孢囊萌发速率更快,萌发率显著高于抗病品种Williams82(见图5B)。各处理孢囊萌发率随时间推移逐渐增加。10 h时,感病品种Sloan种子分泌物孢囊萌发率为96.75%,抗病品种Williams 82为62.58%,超纯水对照处理为43.62%(见图4C)。
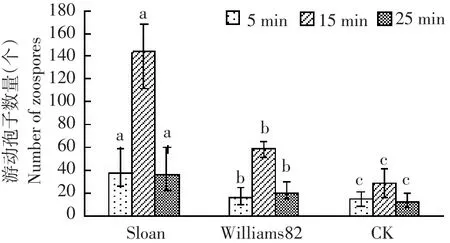
图3 毛细管中抗、感大豆品种种子分泌物吸引大豆疫霉游动孢子数量Fig.3 Number of Phytophthora sojae zoospores attractted by seed exudates of resistant and susceptible soybean cultivars in capillary tubes

图4 抗、感大豆品种种子分泌物处理游动孢子趋化性、成囊及孢囊萌发Fig.4 Chemotaxis,cysts formation and germination of Phytophthora sojae in seed exudates of resistant and susceptible soybean cultivars
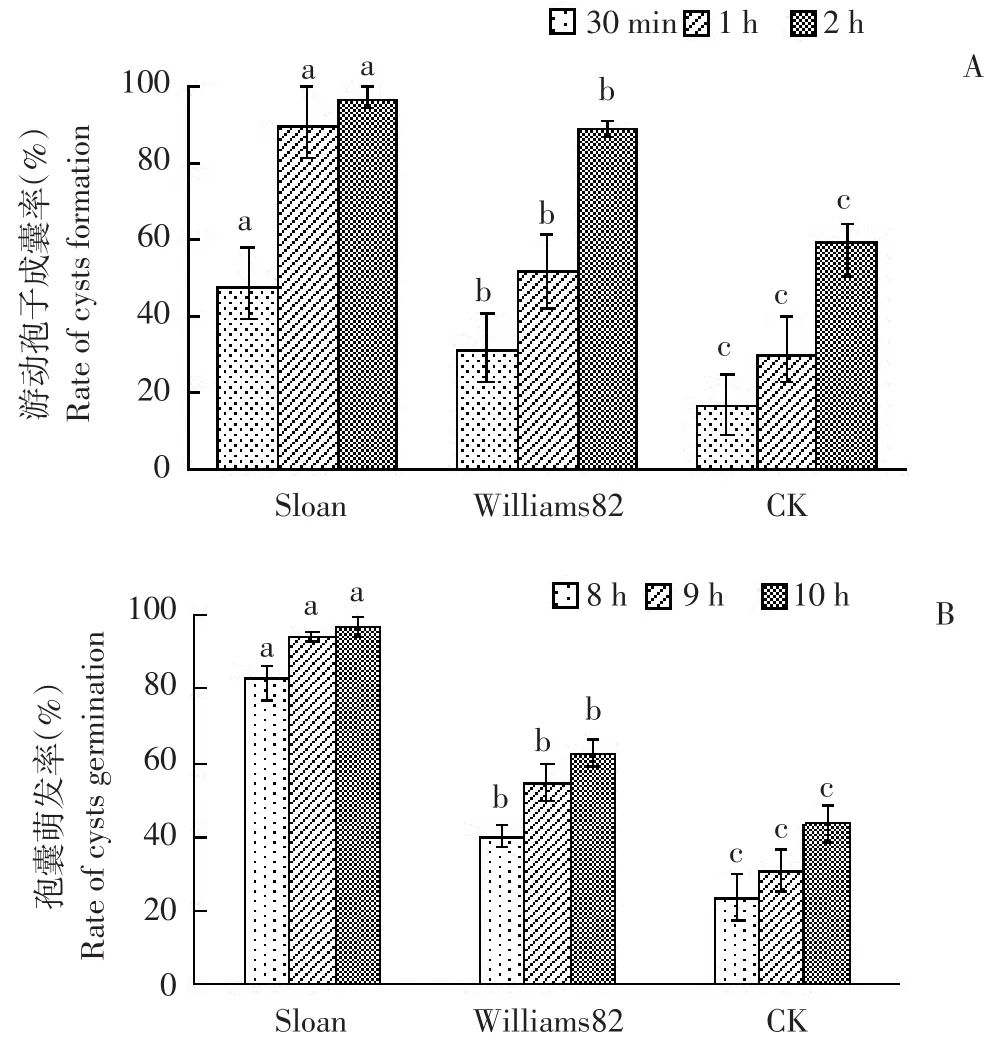
图5 抗、感大豆品种种子分泌物中大豆疫霉游动孢子成囊及孢囊萌发情况Fig.5 Phytophthora sojae cysts formation and germination in seed exudates of resistant and susceptible soybean cultivars
3 讨论与结论
大豆疫霉通过游动孢子寻找寄主,识别寄主是与寄主相互作用的第一步[18]。抗、感大豆品种种子分泌物均可有效吸引大豆疫霉游动孢子,但游动孢子对感病品种种子分泌物趋化性更强,因其对种子分泌物中特异性或非特异性引诱剂具有高度敏感性,例如氨基酸[19]、异黄酮daidzein和genistein[20]等。不同大豆品种种子分泌物组分种类和含量差异较大,导致对游动孢子吸引力差异。大豆疫霉可通过识别种子分泌物中寄主专化性信号分子如异黄酮,选择适合侵染的寄主[21]。此外,不同浓度种子分泌物对游动孢子吸引力差异显著,试验过程中发现相对原位浓度下抗、感品种种子分泌物对游动孢子吸引量均与对照无显著差异,且游动孢子吸引量随种子分泌物稀释倍数增加而增加,稀释5倍(本试验终浓度)时游动孢子吸引量最大,且抗、感品种间差异显著,因为种子分泌物中某些组分在低浓度下吸引游动孢子,高浓度下则对游动孢子有驱避作用。
种子分泌物中蛋白质、次生代谢物质等也是一类有效分子防御物质,可抑制病原菌活性从而阻止侵染[22]。大豆种子分泌物存在63种分泌蛋白,包括β-1,3葡聚糖酶、角素、外源凝集素、脂氧化酶等,均与植物防御有关[23]。此外,大豆种子分泌物中还含有大量胰蛋白酶抑制剂,可抑制植物病原菌蛋白活性[24],起抗病作用。无论是抗病品种还是感病品种,均可被大豆疫霉侵染[25]。本试验中,与对照相比,抗、感品种种子分泌物均可促进大豆疫霉发育行为变化,促进侵染,但是抗、感品种间差异显著,与感病品种相比,抗病品种种子分泌物显著抑制卵孢子形成及萌发,且孢囊萌发率明显降低,说明不同品种种子分泌物影响大豆对大豆疫霉抗性,种子分泌物作为寄主抵御病原菌第一道防线,与抗病性程度密切相关。

