摘叶处理对黑穗醋栗叶片和果实AsA-GSH循环代谢的影响
霍俊伟,刘庆帅,秦 栋,孙小娟,李芳晓
(东北农业大学园艺园林学院,农业部东北地区园艺作物生物学与种质创制重点实验室,寒地小浆果开发利用国家地方联合工程研究中心,哈尔滨 150030)
抗坏血酸(Ascorbic acid,AsA)是从食物中摄取的小分子物质,具有极强抗氧化性,具有防治坏血病,参与造血、促进胶原蛋白合成,治疗哮喘、抗肿瘤等作用[1-2]。其在植物内可清除自由基,作为某些还原酶辅因子参与还原反应,在调节植物生长、诱导开花、延缓衰老、促进细胞分裂、碳氮代谢、信号转导和传递等生理调控过程具有重要作用[3-4]。L-半乳糖途径是大多数植物抗坏血酸生物合成主要途径[5-6],已在苹果[7]、葡萄[8]、刺梨[9]、番茄[10]和猕猴桃[11]等园艺作物上得到验证。抗坏血酸-谷胱甘肽(Ascorbate-glutathione,AsA-GSH)循环是AsA再生途径之一,其在黑穗醋栗果实AsA积累中作用已被证实[12]。
黑穗醋栗(Ribes nigrum L.)属虎耳草科(Saxifragaceae)茶藨子属落叶丛生灌木[13],果实为黑色浆果,有光泽,近球形,味酸甜,清香,营养价值丰富,富含高水平AsA,含量高达200~400 mg·100 g-1FW[14],是重要AsA植物源。
黑穗醋栗不同品种果实AsA含量不同,差异明显,AsA含量与抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)、单脱氢抗坏血酸还原酶(MDHAR)活性呈正相关,果实AsA含量较高品种,叶片AsA含量也高,果实坐果后叶片AsA含量明显下降[15]。
研究表明,植物叶片等源器官具备完整AsA合成途径,由于AsA长距离运输理论的提出,使植物库器官AsA形成机制复杂化,尤其对葡萄、苹果、梨、越橘等低AsA含量水果的AsA合成能力,其组织间差异是研究果实AsA积累机制基础,也是提高果实AsA水平前提[16]。14C喂饲拟南芥和紫花苜蓿后,发现AsA可从叶片经韧皮部向芽、花和根长距离运输[17];AsA转运参与刺梨果实AsA积累,但刺梨除果实外,其他各组织器官DHA含量均较高,叶片AsA和DHA浓度相对其他叶柄和枝条更高,刺梨可能以叶片为合成源头,将氧化产物长距离运输到果实[18]。番茄同位素标记试验表明,番茄植株AsA从叶片输出后大部分积累在绿色未成熟果实中,而在成熟果实中未积累[19]。可见长距离运输积累AsA途径,不仅在器官和组织间存在差异,也因物种不同而不同。
为进一步研究黑穗醋栗果实与叶片AsA含量关系,Qin等在果实开始坐果时,摘去50%果实(总坐果量50%),探讨摘果处理对AsA含量及AsA-GSH循环影响,结果表明,摘果处理显著增加果实AsA含量,但叶片AsA含量减少;而摘果处理组枝条果实AsA含量增加与减少与自身AsA再生循环无联系,可能受枝条总叶片AsA含量影响[12]。叶片减少是否影响果实AsA含量及AsAGSH代谢循环,尚未见详细报道。
为全面揭示黑穗醋栗果实AsA合成积累机理,本试验作摘叶处理,探讨摘叶处理对叶片和果实AsA含量及AsA-GSH代谢循环影响,为选育高含量AsA加工专用新品种提供科学依据。
1 材料与方法
1.1 材料
试材为8年生、长势相对一致但果实AsA含量差异显著的3个栽培品种:亚德、布劳德和利桑佳,其果实和叶片AsA含量见表1。试材定植于东北农业大学黑穗醋栗种质资源圃内,管理水平中等。
1.2 摘叶处理
黑穗醋栗果实开始坐果时(5月初),每个品种单株选取生长势相近、结果数及叶片数相近两个植株,对其中1个植株摘叶处理,去除其50%叶片,另一植株作对照,每个品种处理30个单株,每次采样后保证处理枝条叶片始终是对照枝条总叶片数50%。每隔7 d采样1次,直至果实成熟,共采样8次。每次取样后,当天或第2天测量部分新鲜果实和叶片样品AsA含量,其余果实和叶片经液氮冷冻后,贮存于-80℃冰箱,用于相关酶活性测定。
1.3 测定方法
AsA含量测定采用高效液相色谱法[15]。TAsA、DHA含量测定参考文献[20]。APX、MDHAR、DHAR、GR活性测定分别参考文献[21-22],GSH和GSSG含量测定参考文献[23]。以上测定均重复3次。
1.4 统计分析
运用Excel 2003处理数据并绘图,DPS 9.5软件作显著性检验分析。
数据处理及结果分析中,未摘叶处理(对照组)叶片、未摘叶处理(对照组)果实、摘叶处理(处理组)叶片和摘叶处理(处理组)果实分别记为CL、CF、TL和TF。
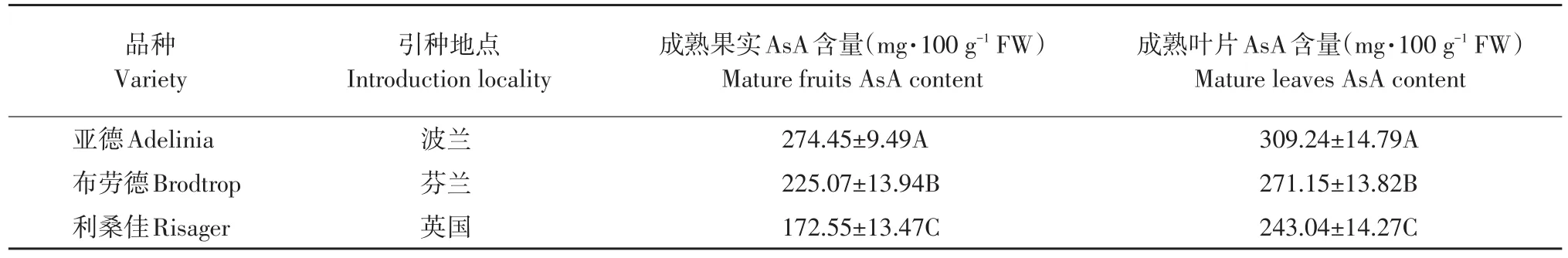
表1 黑穗醋栗品种及AsA含量(±标准差)Table 1 Black currant varieties and AsA content(±standard deviation)
2 结果与分析
2.1 摘叶处理对黑穗醋栗叶片及果实AsA含量的影响
由图1可知,高AsA含量品种亚德和低AsA含量品种利桑佳,其叶片和果实AsA含量变化趋势相同,随果实发育而增加,第3周达最大值,亚德、布劳德和利桑佳每100 g鲜重果实AsA含量分别为424.03、256.97和274.96 mg;叶片AsA含量分别为122.36、81.07和70.04 mg;由于果实膨大而下降,果实着色期和成熟期(第5~8周)趋于稳定。
与未摘叶处理(对照)相比,摘叶处理明显增加处理组叶片AsA含量,且差异极显著(p<0.01),第3周,亚德摘叶处理组叶片AsA含量是对照1.31倍;摘叶处理对果实AsA含量影响与叶片相反,摘叶处理组中,果实AsA含量明显低于对照,差异极显著(p<0.01)。第3周,利桑佳果实AsA含量是对照0.87倍,可能是随叶片相对减少,果实AsA含量相对减少,反之促进叶片AsA合成。
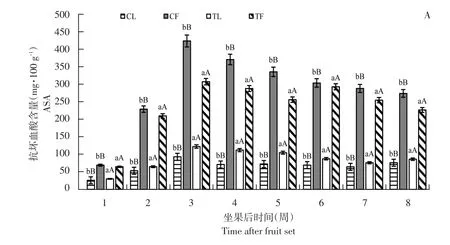
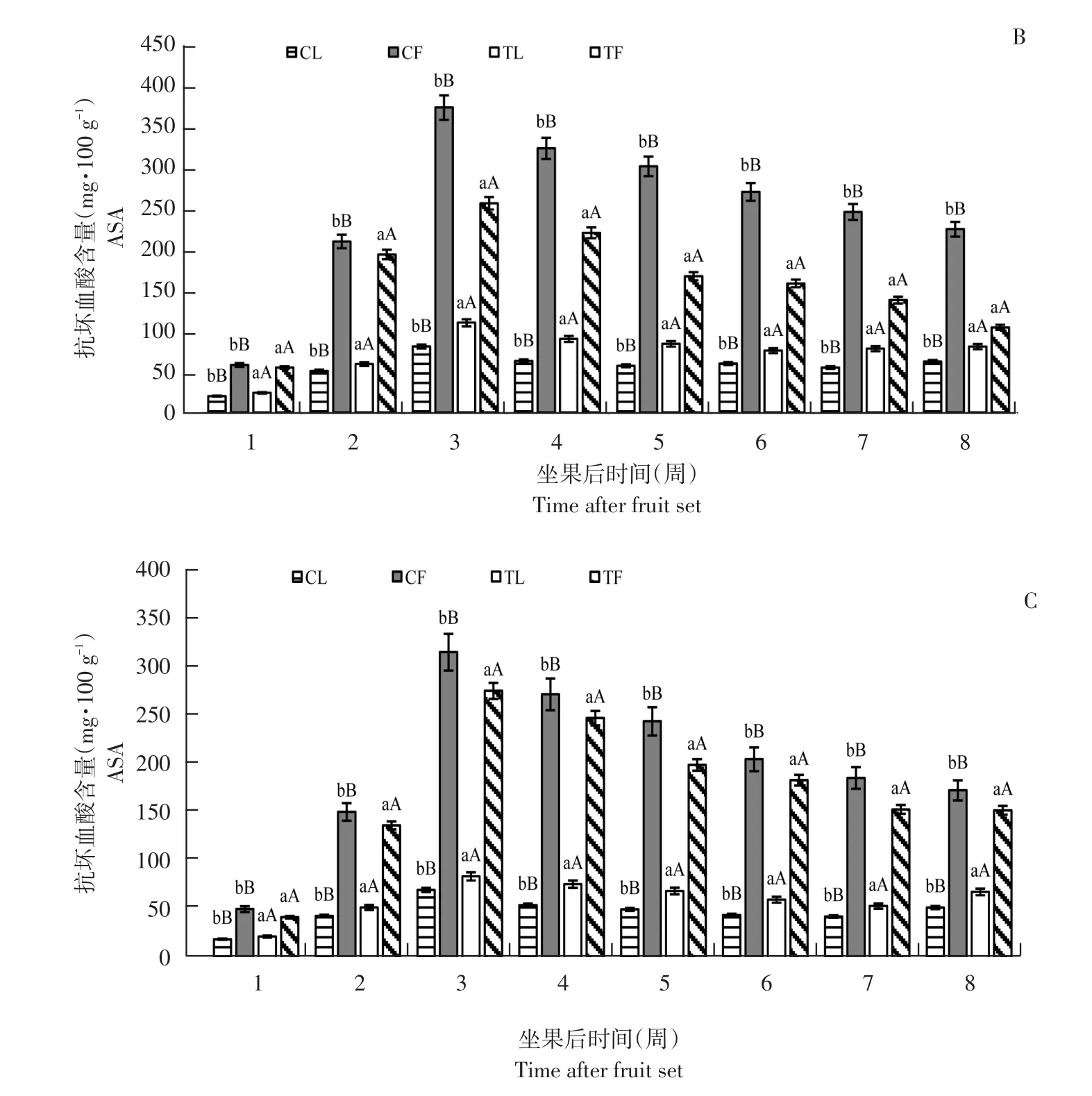
图1 3个黑穗醋栗品种摘叶处理与对照组抗坏血酸含量比较Fig.1 Comparison of ascorbic acid content between defoliation and control in three black currant varieties
2.2 摘叶处理对黑穗醋栗叶片及果实GSH含量及GSH/GSSG的影响
果实发育期内,摘叶处理对叶片及果实GSH含量无显著影响(以布劳德为例)。坐果后第1周,果实GSH含量较低,至第3周略有上升,后缓慢下降,幅度不大(见图2A)。摘叶处理后,对照组与处理组果实GSH含量无显著差异(P>0.05),表明叶片相对减少,对果实GSH含量无显著影响。
3个品种叶片GSH含量试验周期呈先升后降趋势(以布劳德为例)。坐果后第1周含量最低(15.93 mg·100 g-1),后迅速上升,第3周达峰值(34.02 mg·100 g-1),是第1周2.13倍,随后由于果实膨大而有所下降,果实着色期和成熟期(第5~8周)趋于平稳,与果实AsA含量变化趋势相似。随果实发育,果实GSH/GSSG呈缓慢上升趋势(见图2B),而叶片GSH/GSSG变化幅度较大,但始终低于同期果实(见图2B)。叶片GSH/GSSG变化趋势与叶片AsA含量变化同步,坐果后1周比值最低,随果实发育,呈先升后降趋势,第3周达峰值,是第1周4.7倍,之后逐渐下降,第8周下降为1.9,与第1周GSH/GSSG相差小。与未摘叶处理(对照)相比,摘叶处理后处理组叶片GSH/GSSG增加,第4周相差最大,差值为0.5;但摘叶处理对果实GSH/GSSG影响小。表明叶片相对减少影响叶片AsA-GSH循环。
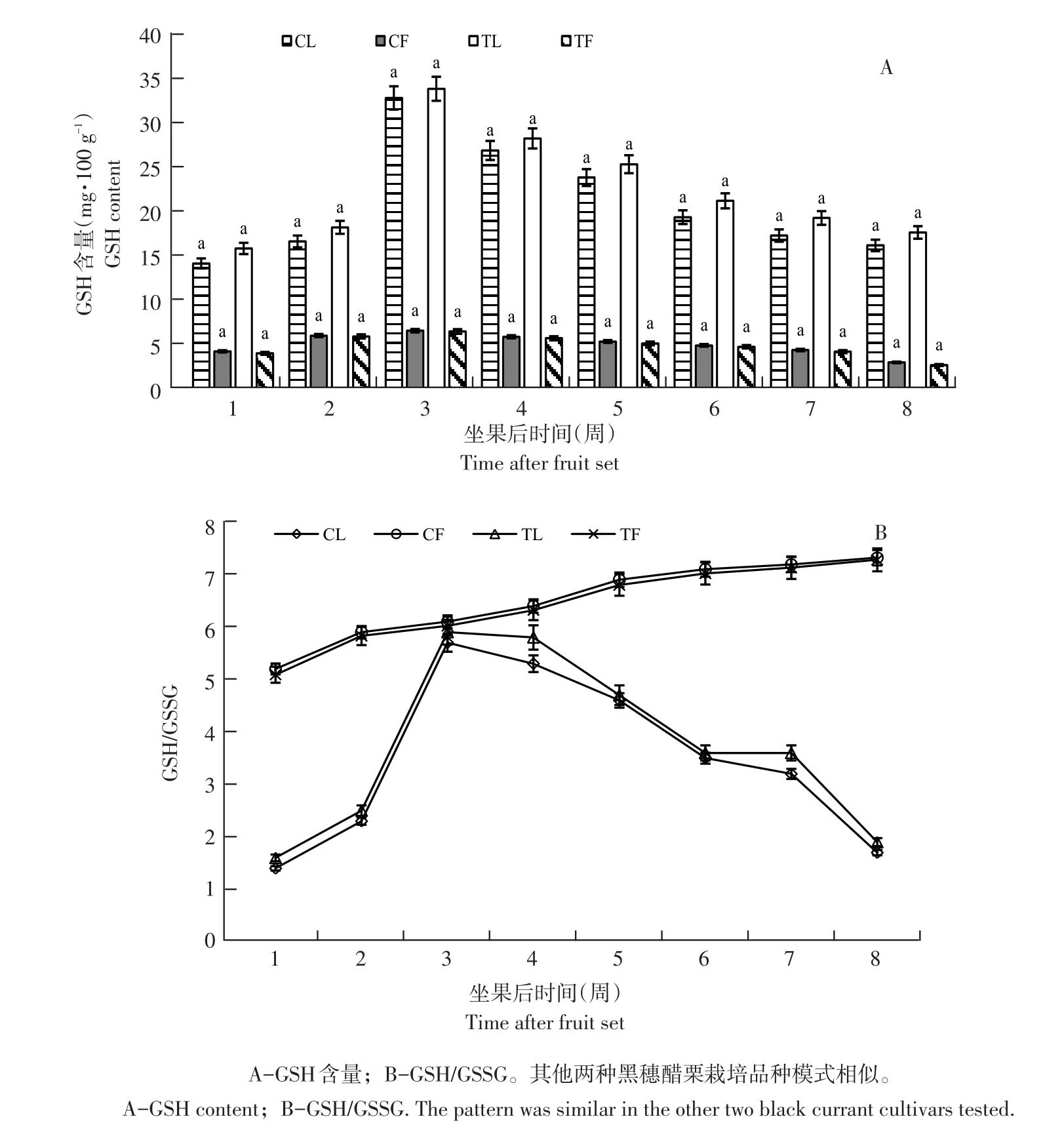
图2 摘叶处理布劳德GSH含量及GSH/GSSGFig.2 GSH content and ratio of GSH/GSSG in Brodtrop after defoliation
2.3 摘叶处理对黑穗醋栗叶片及果实AsA-GSH循环相关酶活性影响
植株生长发育过程中,3个品种APX酶活性变化趋势相同,但每个品种叶片和果实酶活性变化存在差异(见图3)。
果实中,APX活性初期活性较高,之后随果实发育,呈下降趋势,其中1~3周下降幅度较大,4~8周酶活性变化较小,与果实AsA含量变化趋势相反。叶片中,酶活性1~2周下降,随后迅速升至第3周达峰值,亚德、布劳德和利桑佳叶片APX活性分别为39.35、36.37和33.57 U·g-1;之后由于果实膨大下降,但在果实成熟期(第7~8周)略升。
与未摘叶处理(对照)相比,摘叶处理增加处理组果实APX活性,第3周,亚德品种处理组果实APX活性是对照组1.12倍;摘叶处理对叶片APX活性影响与果实相反,处理组中,叶片酶活性低于对照,第3周,利桑佳品种叶片APX活性是对照0.93倍。可能因叶片减少,导致叶片APX活性降低,但反之促进果实APX活性升高。
3个品种DHAR活性高低与AsA含量呈正比,亚德和利桑佳,其DHAR活性变化趋势相同(见图4),均随果实发育呈先升后降趋势,但与AsA含量变化不同,其酶活性在坐果后第4周达峰值(滞后1周),亚德、布劳德和利桑佳果实DHAR活性分别为46.71、42.68和34.58 U·g-1;叶片DHAR活性分别为56.22、53.79和49.48 U·g-1;之后由于果实膨大下降,果实成熟期(第7~8周)趋于稳定。
与未摘叶处理(对照)相比,摘叶处理对处理组果实DHAR活性无显著影响;而叶片中,处理组叶片DHAR活性始终高于同期对照组叶片酶活性,且AsA越高,差异越显著(p<0.05)。由此可知,摘叶处理影响叶片DHAR活性,但对果实DHAR活性影响小。
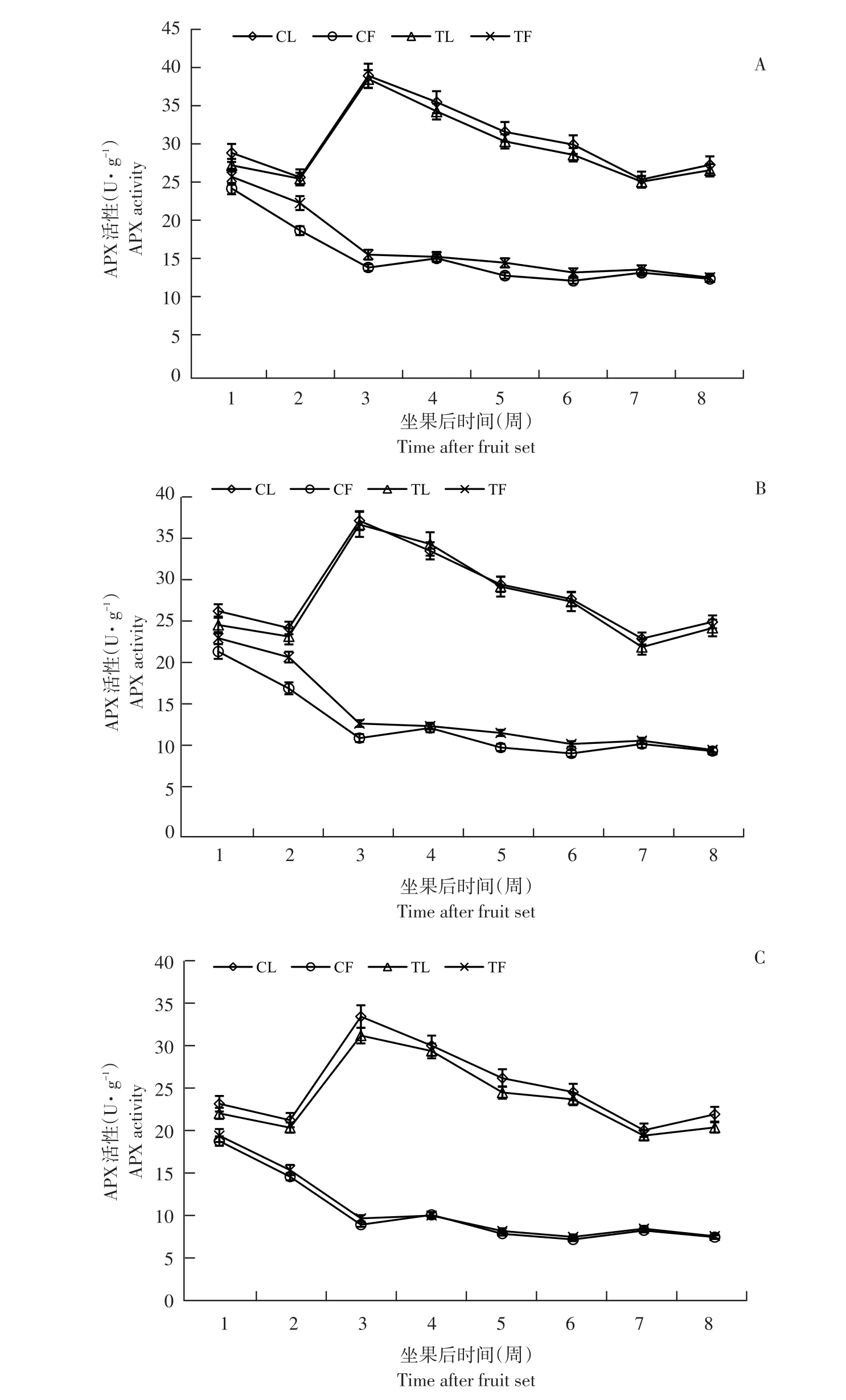
图3 3个黑穗醋栗品种摘叶处理与对照APX活性比较Fig.3 Comparison of APX activity between defoliation and control in three black currant varieties
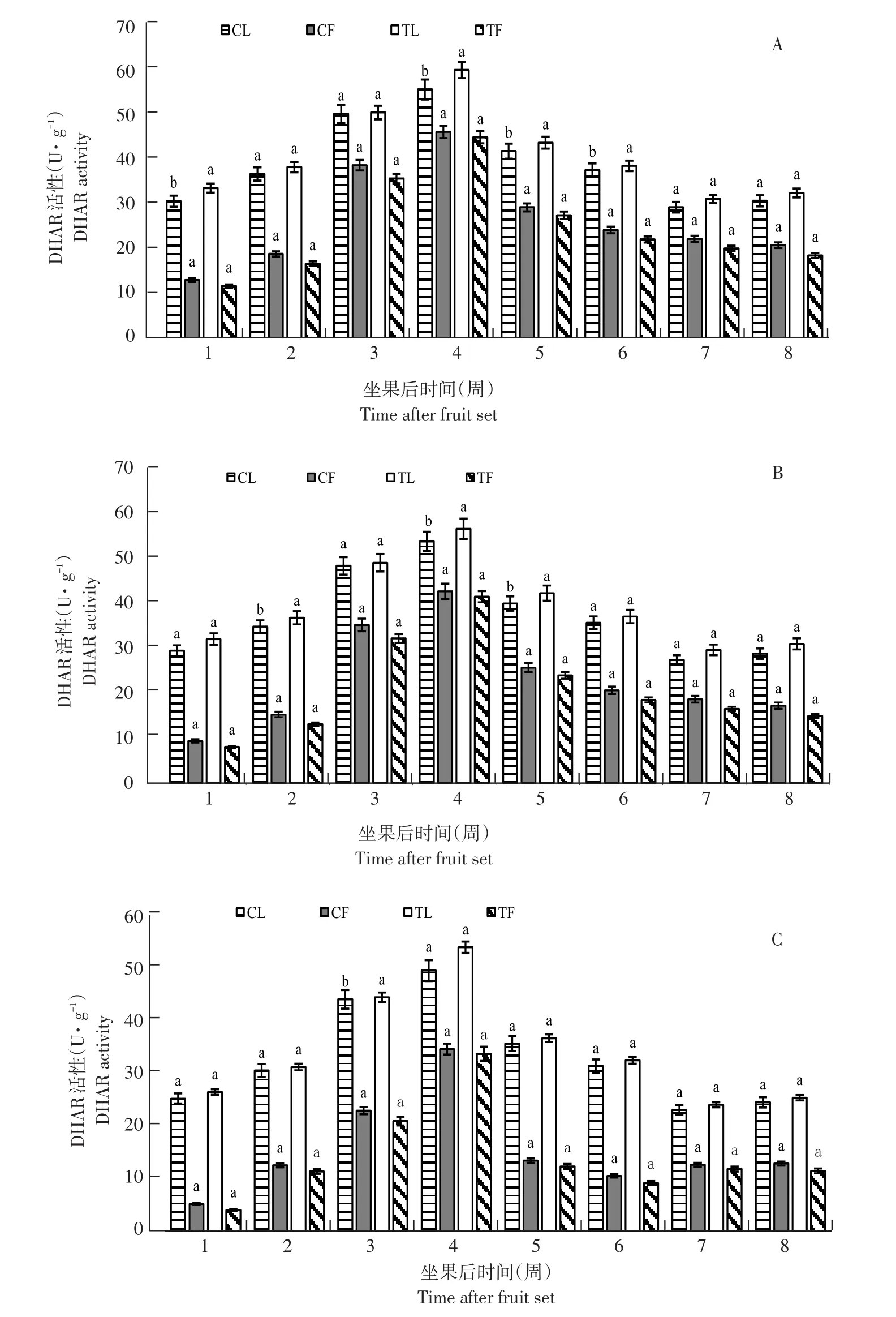
图4 3个黑穗醋栗品种摘叶处理与对照DHAR活性比较Fig.4 Comparison of DHAR activity between defoliation and control in three black currant varieties
3个品种MDHAR活性变化趋势相同(见图5),以布劳德为例,果实和叶片MDHAR活性均呈先升后降趋势,第4周达峰值,布劳德果实和叶片MDHAR活性分别为19.64和24.37 U·g-1。与未摘叶处理(对照)相比,处理组果实MDHAR活性降低,而处理组叶片MDHAR活性升高。
随果实发育,3个品种GR活性变化趋势相似,以布劳德为例。自坐果后,GR活性随果实发育呈下降趋势(见图6),1~3周下降幅度较大,4~8周酶活性变化较小,趋于稳定,与果实APX活性变化趋势相同。而叶片中,酶活性1~3周迅速上升至第3周达峰值(26.03 U·g-1),随后由于果实膨大而有所下降,但在果实着色期和成熟期(第5~8周)趋于稳定。
与未摘叶处理(对照)相比,摘叶处理后处理组果实GR活性降低,但差异不显著(P>0.05);而叶片中,摘叶处理明显增加处理组第3周叶片GR活性,且差异显著(p<0.05),第3周时处理组叶片GR活性是对照组1.1倍,而其他坐果时期差异不显著。
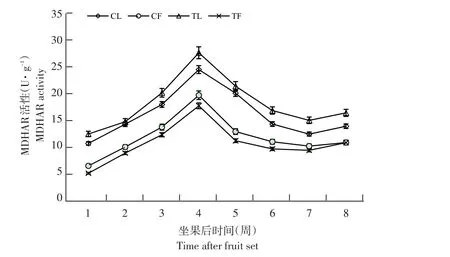
图5 布劳德摘叶处理与对照MDHAR活性比较Fig.5 Comparison of MDHAR activity between defoliation and control in Brodtrop
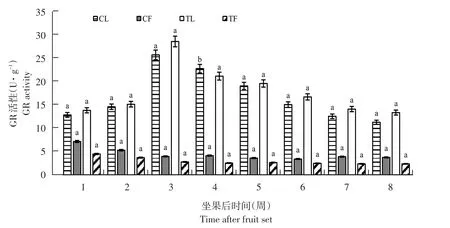
图6 布劳德摘叶处理与对照组GR活性比较Fig.6 Comparison of GR activity between defoliation and control in Brodtrup
3 讨论与结论
AsA是植物体内一种非酶抗氧化剂和氧化还原物质,在清除活性氧自由基及抗氧化方面具有重要作用。目前,猕猴桃[24]、刺梨[25]、葡萄[26]等园艺作物AsA生物合成和代谢途径已有深入研究,探讨高等植物抗坏血酸含量差异主要影响因素[27]。高等植物AsA生物合成和代谢途径,特别是明确AsA生物合成L-半乳糖途径和AsA-GSH循环再生途径后,通过研究AsA含量与AsA-GSH循环再生途径相关酶间关系,可为选育高含量AsA黑穗醋栗新品种提供理论依据。
本研究以AsA含量差异较大3个品种亚德、布劳德和利桑佳为试材,摘叶处理并测定3个品种相关酶活性,结果表明,3个品种间AsA含量变化趋势相似,均随坐果时间增加呈先升后降趋势,果实AsA迅速积累期主要在坐果第2~3周,第3周达最大值,与果实膨大期吻合,也可能与AsA参与果实初期细胞分裂有关,之后随果实膨大AsA含量逐渐下降,与苹果[28]、猕猴桃[24]AsA积累特点基本一致。摘叶处理后,处理组叶片AsA含量明显增加,而果实AsA含量明显低于对照,可能是随叶片相对减少,果实AsA含量相对减少,反之促进叶片AsA合成。
越橘[29]、草莓[30]、甜樱桃[31]、猕猴桃[32]、苹果[33]等研究表明,AsA含量与DHAR和MDHAR活性密切相关。本试验结果表明,与AsA-GSH循环再生途径相关的DHAR、MDHAR和GR酶活性先增后减,摘叶处理后叶片DHAR、MDHAR和GR活性增加,而果实酶活性降低,与AsA含量变化相似。3个品种MDHAR、GR活性变化趋势相似,但不同品种MDHAR和GR活性差异较大。APX活性变化与AsA含量变化相反,第1~3周迅速下降,第3周降至最低值,且与未摘叶处理(对照)相比,摘叶处理增加果实APX活性,而叶片降低,与AsA变化恰好相反,APX活性降低有助于确保AsA含量积累与稳定。可知,黑穗醋栗果实和叶片AsA再生能力在维持AsA含量中起重要作用,可能在特定条件和发育阶段调控AsA水平。
GSH/GSSG比值用来衡量谷胱甘肽氧化还原状态,表明AsA-GSH循环在AsA生成中起重要作用。GSH/GSSG越高代表GSH量越高,同时表明更多DHA可通过DHAR和GSH作用转化为AsA[34]。本研究结果表明,黑穗醋栗果实GSH/GSSG总是大于叶片,且叶片GSH/GSSG与AsA含量呈正相关。枝条摘叶处理后,叶片中无论GSH含量还是GSH/GSSG均有下降趋势,说明摘叶处理对叶片抗坏血酸AsA-GSH循环有影响,而果实无影响。摘叶处理后,对照组果实GR活性略大于处理组,但无显著差异,说明摘叶处理对果实GR活性影响较小。摘叶处理后第3周,叶片GR活性迅速升高,与同期对照组差异显著,其他坐果时期并无显著差异,与番茄研究结果一致[10],表明GSH和GR参与AsAGSH循环完成黑穗醋栗AsA积累。
目前研究发现植物细胞质、叶绿体和胞外环境中均含有AsA,且AsA浓度达毫克级,AsA在细胞内和细胞间均可自由移动,说明植物中存在高效AsA跨膜和长距离转运系统[35]。AsA长距离运输机制的提出,使植物库器官AsA形成机制复杂化。本试验摘叶处理对果实AsA含量产生影响,因此推测AsA在叶片和果实中存在长距离运输关系。Qin等通过摘果处理测试黑穗醋栗AsA是否存在长距离运输,发现摘果处理前叶片AsA含量较高,摘果处理后,叶片AsA含量立即下降,果实AsA水平高于叶片[12]。因此,这种现象可能是黑穗醋栗叶片和果实之间AsA长距离运输的间接证据,与本试验摘叶处理结果吻合。
此外,Hancock等通过多种试验证明黑穗醋栗叶片合成的AsA对果实AsA积累无影响,认为L-半乳糖是AsA合成途径,还发现树莓AsA主要取决于自身合成能力,不存在AsA运输,但叶片对果实糖供应能力可能对树莓AsA合成具有调控作用[36]。Hancock等研究指出,AsA从源叶到果实运输取决于果实生长阶段,如摘除黑穗醋栗花朵或番茄果实不影响其果实AsA积累[36-37]。刺梨在果实发育后期开始积累AsA,直至果实成熟,接近成熟时AsA积累速率最高,表明果实内AsA积累受不同生长发育阶段调控[9]。因此作物不同可能导致AsA积累不同,黑穗醋栗AsA长距离运输尚需进一步验证。
摘叶处理改变果实表面光照、温度等外部环境条件,影响黑穗醋栗果实AsA最终含量。黑穗醋栗摘叶处理后,叶片减少影响AsA含量及相关酶活性,果实和叶片存在差异。本试验结果表明,摘叶处理后,叶片AsA含量及其他酶活性均增加,而果实AsA含量、APX及MDHAR活性降低,GSH含量、DHAR和GR活性无变化。本试验初步推断黑穗醋栗果实和叶片AsA含量关系,可用同位素示踪法验证。黑穗醋栗AsA主要合成途径是L-半乳糖途径,其两种关键酶L-半乳糖脱氢酶和L-半乳糖-1,4-内酯脱氢酶如何在摘果或摘叶中调控叶片和果实AsA含量,需进一步研究。

