GM-CSF和FliC作为新型复合生物佐剂对猪圆环病毒疫苗的免疫增强效果
任桂萍,张 腾,吴 超,李德山
(东北农业大学生命科学学院,哈尔滨 150030)
猪圆环病毒是断奶仔猪和保育猪常见疾病,发病率可达50%,死亡率因猪场条件、继发感染情况而异,一般在5%~70%[1]。PCV-2疫苗可有效改善猪圆环病毒感染情况[2]。
目前国内外防治猪圆环病毒方法主要为疫苗注射,但免疫效果不明显,疫苗佐剂添加尤为重要[3]。铝盐佐剂最早应用于疫苗免疫,抗原吸附强度决定免疫效果,对机体有副作用、无法刺激细胞免疫[4];乳剂类佐剂包括弗氏不完全佐剂(IFA)、弗氏完全佐剂(CFA)[5-6],易造成局部炎症,注射部位形成肉芽肿及持续性溃烂,仅用于科研试验;此外还包括天然佐剂,但应用受限[7]。近年来,研究发现肽聚糖、脂多糖及霍乱毒素等微生物来源佐剂具有良好佐剂活性[8],细胞因子如干扰素、白细胞介素(IL)-1等免疫调节作用较强。
目前复合生物佐剂研究较少,施建东等研究复合佐剂对狂犬疫苗和乙肝疫苗的免疫增强效果[9-10]。本文选择巨噬细胞集落刺激因子GM-CSF和细菌鞭毛蛋白FliC作为复合生物佐剂,研究其对猪圆环病毒疫苗的免疫增强效果。
活化的T淋巴细胞、B淋巴细胞等多种细胞产生巨噬细胞集落刺激因子GM-CSF[11-12],具有多种生物学活性,可诱导造血细胞增殖和分化,维持粒细胞系存活[13];增强中性粒细胞和巨噬细胞吞噬与杀伤功能及嗜酸性粒细胞杀伤活性[14]。GM-CSF作为细胞因子,微量高效、作用迅速,与激素效果相似,又称免疫激素[15]。细菌鞭毛蛋白FliC可结合TLR家族受体[16]配体激活机体免疫应答。鞭毛为鼠伤寒沙门氏菌[17]一部分,细菌鞭毛蛋白作为特殊的炎性刺激分子,为TLR5和NLRC4配体,胞外鞭毛蛋白由TLR5识别,鞭毛细菌在胞内感染时,由IPAF和Naip5直接识别[18-19]。FliC可作为免疫佐剂,产生一系列传递信号,激活T淋巴细胞,调动免疫系统,使机体对抗原刺激产生反应,实现免疫佐剂作用[20-21]。细菌鞭毛蛋白作为最具潜力的候选疫苗佐剂,可诱导产生黏膜IgA,防止黏膜表面局部病原感染[22]。结合纳米粒子的细菌鞭毛蛋白佐剂可诱导更广泛的细胞因子谱[23]。
细胞巨噬细胞集落刺激因子GM-CSF可参与多种应答反应,细菌鞭毛蛋白FliC可刺激天然免疫应答,二者具有微量高效等特点,本试验选择GM-CSF和FliC作为研究对象,探究复合生物佐剂增强猪圆环疫苗免疫效果。
1 材料与方法
1.1 材料
1.1.1 工程菌
SUMO-GM-CSF和SUMO-FliC工程菌,由东北农业大学生命科学学院生物制药教研室保存。
1.1.2 试验动物
BALB/c小鼠,6周龄雌性,购自长春市亿斯实验动物有限公司。
1.1.3 生化试剂
IPTG、溶菌酶、氨苄青霉素(购自TaKaRa公司);亲和层析柱HisTrapTM FF crude colum购自GE公司;SUMO Protease-I(由本实验室纯化获得);蛋白Marker购自Fermenta公司。
1.1.4 疫苗
哈药猪圆环病毒2型灭活疫苗(灭活前每毫升含猪圆环病毒2型LG株不低于105.5TCID50)
1.2 方法
1.2.1 GM-CSF蛋白优化表达及制备
1.2.1.1 SUMO-GM-CSF融合蛋白诱导剂浓度确定
将-20℃保存SUMO-GM-CSF工程菌4℃融化,取上述菌液以1%含量接种于4个氨苄抗性液体培养基。接种后置于37℃恒温摇床培养2~3 h后,至OD600值约0.5时,分别加入终浓度为1、0.75、0.5、0.25 mmol·L-1IPTG,37℃诱导培养4 h,培养结束后,分别制备未诱导组,诱导后上清、沉淀蛋白样品,通过15%SDS-PAGE电泳分析,在相同诱导温度、时间,比较不同IPTG终浓度时SUMOGM-CSF蛋白表达量差异。
1.2.1.2 SUMO-GM-CSF融合蛋白诱导温度确定
将-20℃保存SUMO-GM-CSF工程菌4℃融化,取上述菌液以1%含量接种于3个氨苄抗性液体培养基中,置于37℃恒温摇床培养2~3 h后,至OD600值约0.5时,加入IPTG,分别37、25、16℃诱导培养4 h。培养结束后,制备未诱导组,诱导后上清,诱导后沉淀蛋白样品,通过15%SDSPAGE电泳分析,在相同IPTG终浓度、诱导时间,比较不同诱导温度时SUMO-GM-CSF蛋白表达量差异。
1.2.1.3 SUMO-GM-CSF融合蛋白诱导时间确定
将-20℃保存SUMO-GM-CSF工程菌4℃融化,取上述菌液以1%含量接种于3个氨苄抗性液体培养基中,置于37℃恒温摇床培养2~3 h后,至OD600值约0.5时,加入IPTG,分别诱导2、4和6 h,培养结束后,制备未诱导组,诱导后上清,诱导后沉淀蛋白样品,通过15%SDS-PAGE电泳分析,在相同诱导温度、IPTG终浓度,比较不同诱导时间SUMO-GM-CSF蛋白表达量差异。
1.2.1.4 SUMO-GM-CSF融合蛋白变性及复性
经大瓶培养的SUMO-GM-CSF菌液,离心弃上清,沉淀物用PBS(pH 7.4)溶液悬起,按照0.001 g·mL-1加入溶菌酶。冰上放置1 h后超声破碎,每次超声波破碎10 s,重复3~5次,直至菌液无粘稠物。破碎后收集破碎沉淀,PBS溶液洗涤沉淀,重复2次。洗涤后,用含有8 mol·L-1尿素变性液溶解沉淀,4℃冰箱中放置12 h后,10 000 r·min-1,4℃离心30 min,吸取上清液,将上清液缓慢滴加扩散至含2 mol·L-1尿素复性液中,滴加至蛋白浓度为0.8~1 mg·mL-1即可。复性完成后,蛋白经透析,置换到PBS(pH 7.0)以备纯化。
1.2.1.5 GM-CSF蛋白纯化
选择重组原核表达载体SUMO载体上含有6个组氨酸(His)标签,可通过Ni-NTA柱亲和层析,使用AKTA purifier100蛋白纯化系统纯化复性后的SUMO-GM-CSF蛋白。通过BCA计算浓度,按照质量比1∶10加入SUMO蛋白酶,置于4℃冰箱过夜。第2天,将酶切后产物经AKTA purifier 100蛋白层析系统,通过Ni-NTA柱二次亲和,流穿液即为目的蛋白GM-CSF。取样,作15%SDS-PAGE检测。
1.2.2 FliC蛋白发酵诱导条件优化及制备
1.2.2.1 SUMO-FliC工程菌发酵诱导时间确定
发酵鉴定正确的SUMO-FliC工程菌菌体,开始诱导后,诱导温度,IPTG浓度相同条件下,分别在诱导2、4、6、8 h时取发酵菌样,制备诱导后全菌,诱导后上清蛋白样品,通过15%SDS-PAGE电泳分析对比不同诱导时间对表达量影响。
1.2.2.2 SUMO-FliC工程菌发酵诱导IPTG浓度确定
发酵鉴定正确的SUMO-FliC工程菌菌体,开始诱导后诱导温度和时间相同条件下,分别加入终浓度为0.75、0.5、0.25 mmol·L-1IPTG。诱导放罐后取发酵菌样制备诱导后全菌,诱导后上清蛋白样品通过15%SDS-PAGE电泳分析,对比不同诱导剂终浓度对表达量影响。
1.2.2.3 SUMO-FliC工程菌发酵诱导温度确定
发酵鉴定正确的SUMO-FliC工程菌菌体,开始诱导后,诱导剂终浓度,诱导时间相同条件下,分别设置诱导温度20、25、30、37℃。诱导放罐后取发酵菌样,分别制备诱导后全菌,诱导后上清蛋白样品,通过15%SDS-PAGE电泳分析,对比不同诱导温度对表达量影响。
1.2.2.4 FliC蛋白纯化
收集发酵培养的SUMO-FliC菌液,超声破碎沉淀,纯化融合蛋白。流穿液即为目的蛋白FliC。
1.2.3 GM-CSF与FliC蛋白作为复合生物佐剂免疫增强效果检测
取5组BALB/c雌性小鼠,每组15只。
第1组为空白组,注射磷酸盐;
第2组为单独疫苗组,注射商品化猪圆环疫苗;
第3组为免疫佐剂①组,注射疫苗+GM-CSF(12.5 mg· kg-1);
第4组为免疫佐剂②组,注射疫苗+FliC(5 mg·kg-1);
第5组为GM-CSF与FliC混合疫苗组,注射疫苗+GM-CSF(12.5 mg·kg-1)+FliC(5 mg·kg-1)。
免疫程序:按照体重,采用皮下注射方法,五组分别注射磷酸盐,单独疫苗,疫苗+GM-CSF,疫苗+FliC及疫苗+GM-CSF+FliC。分别于D2、D4、D6、D8、D10眼球取血,每次每组取3只分离血清,通过ELISA方法检测血清中抗体效价。
2 结果与分析
2.1 SUMO-GM-CSF融合蛋白诱导条件优化及制备
2.1.1 诱导剂浓度
制备蛋白样品作SDS-PAGE分析,如图1所示,在约33 ku处有目的蛋白,且当IPTG终浓度为0.25 mmol·L-1时融合蛋白表达量最高。因此选择IPTG 0.25 mmol·L-1为此蛋白最佳诱导剂浓度。
2.1.2 诱导温度
制备蛋白样品作SDS-PAGE分析。如图2所示,在约33 ku处有目的蛋白,且当温度为37℃时融合蛋白表达量最高。故选择温度为37℃作为此蛋白最佳诱导温度。
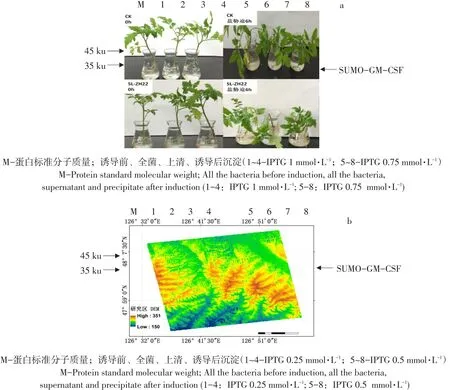
图1 诱导剂浓度确定Fig.1 Determination of inducer concentration
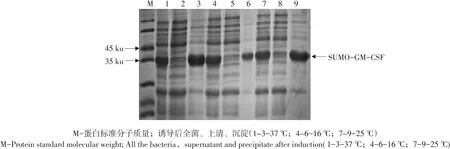
图3 诱导温度确定Fig.3 Determination of induced temperature
2.1.3 诱导时间
制备蛋白样品,作SDS-PAGE分析,结果如图3所示。
由图3可知,在约33 ku处有目的蛋白,且诱导4 h时融合蛋白表达量高。故选择诱导时间为4 h。根据SDS-PAGE分析,确定SUMO-GM-CSF蛋白最佳诱导条件为:IPTG终浓度0.25 mmol·L-1、温度37℃,诱导4 h。
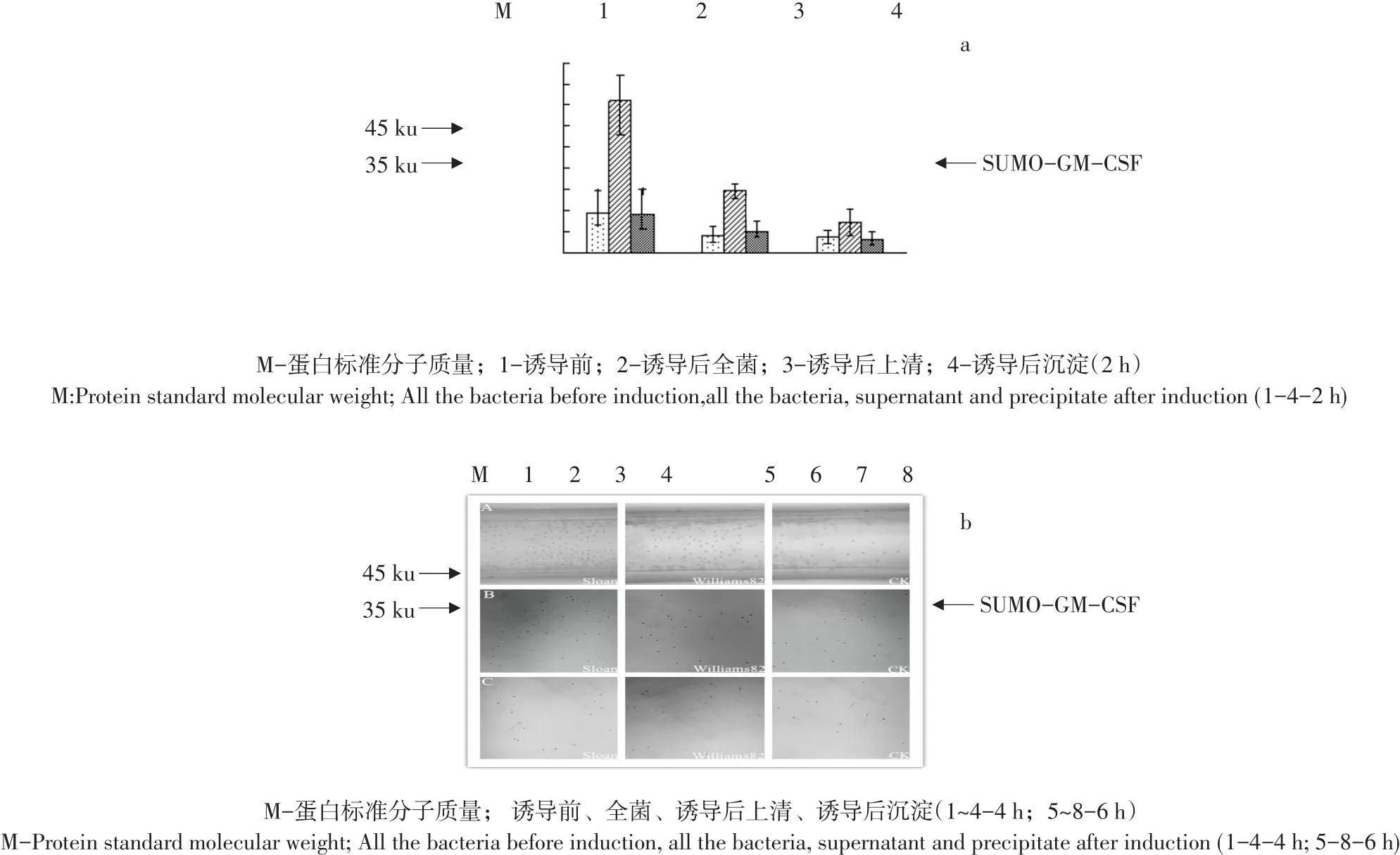
图3 诱导时间确定Fig.3 Determination of induction time
2.1.4 SUMO-GM-CSF融合蛋白纯化
将诱导后获得SUMO-GM-CSF阳性菌体破菌离心,变性液复性液处理沉淀物,离心收集上清,过AKTA purfier 100系统经Ni-NTA树脂亲和层析,得到纯化后SUMO-GM-CSF融合蛋白,结果见图4。将融合蛋白加入SUMO蛋白酶切除融合标签后,二次亲和层析得到最终GM-CSF蛋白。通过SDS-PAGE可知在约13 ku处有明显目的条带,如图5所示。根据SDS-PAGE分析,得到纯化后约13 ku GM-CSF蛋白。

图4 SUMO-GM-CSF一次亲和Fig.4 The first affinity of SUMO-GM-CSF

图5 二次亲和后GM-CSFFig.5 Obtained GM-CSF after the second affinity
2.2 SUMO-FliC融合蛋白发酵诱导条件优化及制备
2.2.1 发酵诱导时间
制备蛋白样品,15%SDS-PAGE电泳分析。由图6可知,SDS-PAGE在约65 ku处有明显目的条带,且诱导6 h时融合蛋白表达量最高。
2.2.2 发酵诱导剂浓度
制备蛋白样品,15%SDS-PAGE电泳分析。由图6可知,SDS-PAGE在约65 ku处有明显目的条带,表达量无明显差别,选择最低IPTG终浓度0.25 mmol·L-1。
2.2.3 发酵诱导温度
制备蛋白样品,15%SDS-PAGE电泳分析。由图7可知,SDS-PAGE在约65 ku处有明显目的条带,诱导温度25℃时表达量最高。根据SDS-PAGE分析,确定SUMO-FliC蛋白发酵最佳诱导条件为IPTG终浓度0.25 mmol·L-1、温度25℃,诱导6 h。
2.2.4 SUMO-FliC融合蛋白纯化
破碎发酵培养所获SUMO-FliC阳性菌体,将破碎后菌液置于中空纤维柱,收集澄清液体。将上清液通过AKTA purfier 100系统经Ni-NTA树脂亲和层析得到纯化后SUMO-FliC融合蛋白。将融合蛋白加入SUMO蛋白酶切除融合标签后,二次亲和层析得到最终FliC蛋白。通过SDS-PAGE可知在约46 ku处有明显目的条带,如图8所示。根据SDS-PAGE分析,得到纯化后约46 ku FliC蛋白。

图6 诱导时间和诱导剂浓度确定Fig.6 Determination of induction time and inducer concentration

图7 诱导温度确定Fig.7 Determination of induced temperature
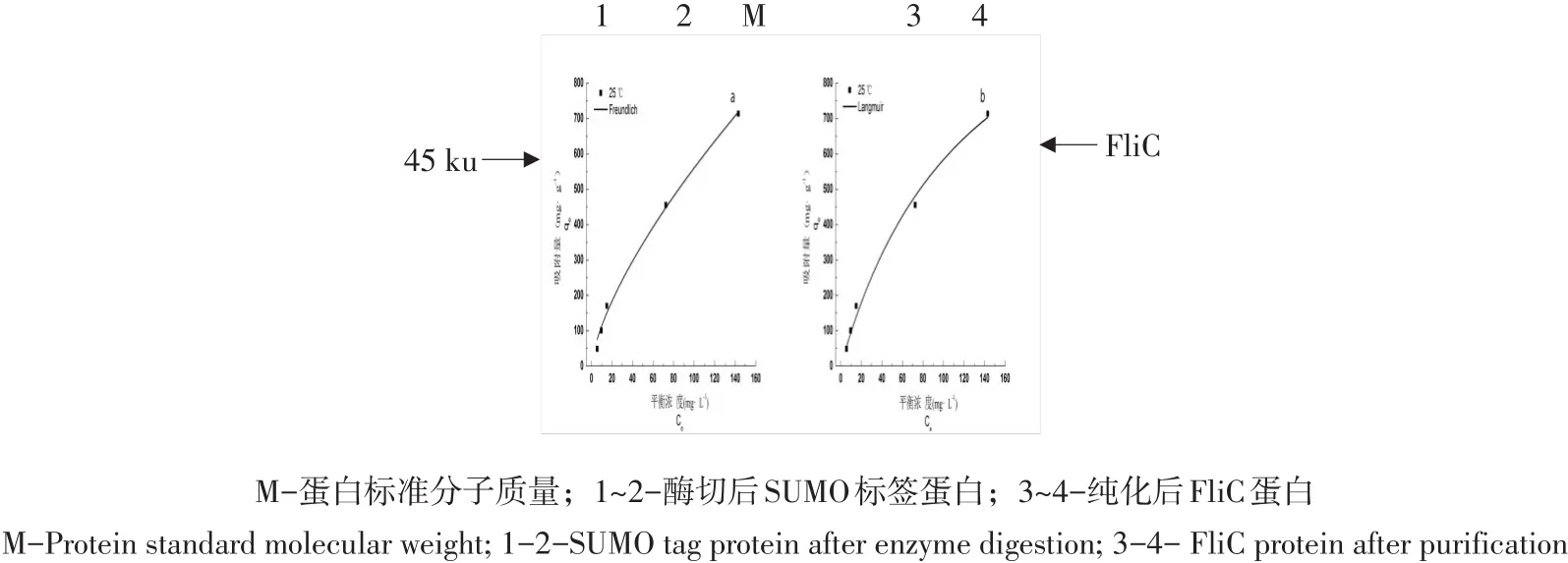
图8 FliC蛋白纯化SDS-PAGE电泳Fig.8 SDS-PAGE analysis of purfied FliC protein
2.3 GM-CSF与FliC蛋白作为复合生物佐剂免疫增强效果检测
在小鼠免疫后第2、4、6、8、10天眼球取血,离心得到血清。经ELISA测定不同组小鼠体内抗体水平,结果如图9所示。
由图9可知,免疫后第2天,与空白组相比,其他四组抗体效价均显著升高,但疫苗+GM-CSF+FliC组增幅明显大于单独疫苗组和单独佐剂组;第2~8天,单独疫苗组抗体效价逐渐下降,复合佐剂组和单独佐剂组稳步上升;第8天时,复合佐剂组抗体效价达峰值,显著高于其他各组;第10天,单独疫苗组已失去免疫效果,但复合佐剂组维持较高水平。由此可见,GM-CSF和FliC均具有增强免疫效果生物学活性,且GM-CSF与FliC共同注射组较其他各组效果更好,迅速刺激小鼠免疫系统。
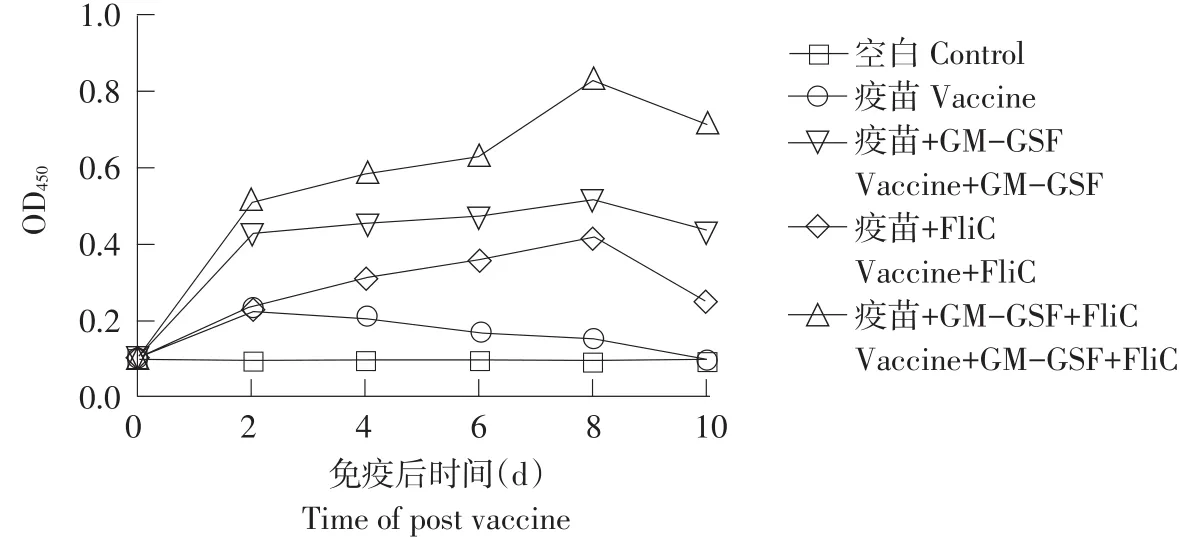
图9 GM-CSF与FliC蛋白免疫小鼠10 d内抗体变化Fig.9 Antibody titer after vaccination within 10 days
3 讨 论
3.1 生物免疫佐剂选择
兽用免疫佐剂包括铝盐佐剂、油乳佐剂、微生物类佐剂、中药类佐剂、细胞因子类佐剂、化学合成类等。细胞因子作为机体内重要因子,具有微量高效优点,调控固有免疫反应及获得性免疫反应效率高、副作用少。鞭毛蛋白作为免疫佐剂,不会对宿主产生超敏反应,可增强抗原呈递细胞对外来抗原摄取、加工和递呈能力;低剂量亦可发挥佐剂效应[24-25]。
本研究选择粒细胞巨噬细胞集落刺激因子(GM-CSF)与鼠伤寒沙门氏菌的鞭毛蛋白(FliC)作为生物免疫佐剂,与单独疫苗组相比,添加生物免疫佐剂有效增加疫苗免疫效果,提高抗体效价,起效迅速且延长免疫作用时间,在第8天至第10天单独疫苗组已失去作用时,GM-CSF+FliC作为生物佐剂仍保持相对较高水平。
3.2 复合免疫佐剂应用
本试验选用粒细胞巨噬细胞集落刺激因子(GM-CSF),鼠伤寒沙门氏菌的鞭毛蛋白(FliC),GM-CSF可有效促进抗原递呈,FliC可诱导产生细胞因子,作为复合生物佐剂联合使用时,免疫效果增强。本研究中,对比疫苗+GM-CSF组使用效果,GM-CSF+FliC复合生物佐剂对疫苗免疫效果更强;对比GM-CSF单独作为佐剂,GM-CSF+FliC具有免疫作用持久和高水平应答等优点。两种以上免疫佐剂混合成复合佐剂,可有效发挥疫苗增强作用。
防控猪圆环病毒关键是疫苗免疫,但全病毒灭活疫苗免疫效果不理想,难以获得高效价抗体水平[26]。本研究改良猪圆环病毒疫苗效果,复合生物佐剂可有效提高疫苗效果,到达预期目的,解决多数动物疫苗抗原性差、作用时间短等问题,为养殖动物疫苗改良应用提供新思路。
3.3 发酵工程应用
发酵工程作为产品产业化必要手段,其合理应用可节省人力物力。利用发酵罐扩大产品获取量,经发酵得到蛋白浓度高,避免后期烦琐浓缩过程及产品浪费。近年来,随着大肠杆菌基因重组技术与高密度发酵技术结合,天然蛋白可大量生产。重组大肠杆菌细胞高密度发酵培养是获得高外源性蛋白产率的重要方法,可减少培养体积,强化下游分离提取,缩短生产周期,降低生产成本,提高生产效率。
4 结论
本研究确定GM-CSF和FliC蛋白最佳表达条件,即GM-CSF在IPTG终浓度为0.25 mmol·L-1、温度为37℃时诱导4 h,FliC在IPTG终浓度0.25 mmol·L-1、温度为25℃时诱导6 h,成功制备具有生物活性的GM-CSF和FliC蛋白。GM-CSF+FliC作为复合生物佐剂与猪圆环病毒疫苗共同注射小鼠,有效增强体液免疫,可作为新型复合佐剂。

