Arthrobacter sp.JQ-1菌株胞外聚合物对DEHP吸附特性研究
张 颖,杨双双,王 蕾,付嘉伟,李 瑞,张 杏,薛越文,刘璐瑶
(东北农业大学资源与环境学院,哈尔滨 150030)
随着塑化制品需求增多,邻苯二甲酸酯类化合物(Phthalate ester,PAEs)应用广泛。其可源于生物自然合成和人工合成,环境中存在PAEs主要由人工合成途径产生[1-2]。长链烃邻苯二甲酸二(2-乙基己基)酯(DEHP)因强耐塑性而应用于工业领域,软质PVC产品中添加量高达40%,其产量占全球PAEs生产总量40%[3-4]。DEHP具有较强生物毒性及三致效应[5],为环境优先控制污染物[6-7]。DEHP与塑料通过氢键和范德华力连接,随时间和环境变化,PAEs易脱离[8],DEHP在生物体组织中积累,在大气-水体系、蒸汽相-大气悬浮颗粒物体系、水-沉积物土壤体系中迁移,造成环境污染[9]。常规处理DEHP方法有物理吸附、光解、水解、臭氧氧化和生物降解法,其中生物降解法研究较多。
生物吸附技术具有成本低、设备简单易操作、效率高等特点。Ruchhoft最早提出“生物吸附”,发现污泥可高效去除废水中239Pu,去除率达96%,原因是大量微生物繁殖形成较大面积凝胶网具有吸附作用[10]。研究发现,啤酒酵母可生物吸附大多数有毒重金属,吸附机理主要是离子交换、酶促机理、表面络合、无机微沉淀等[11]。曲娟娟等发现黑曲霉废弃菌丝体作吸附剂,废水中Pb2+吸附率高达91.5%[12]。生物吸附有机污染物研究起步相对较晚,主要研究廉价生物吸附材料及改性方法,探讨吸附机制及影响因素。Luo等发现洋葱伯克霍尔德菌活菌体和死菌体对邻苯二甲酸二乙酯具有生物吸附作用,在30 min内可达最大吸附量,吸附率超过80%[13]。生物吸附剂不仅包括藻酸钙、细菌、真菌、藻类以及细胞提取物,还包括壳聚糖、纤维素、荚膜多糖、植物多糖和细菌胞外多糖等物质,随着生物吸附研究深入,发现胞外聚合物,壳聚糖等物质对有机物、重金属等污染物均具有较强吸附能力。
胞外聚合物(Extracellular polymeric substances,EPS)由微生物分泌,包括大分子细胞裂解和水解产物及吸附在细胞壁上有机物质,包被在细菌外层的复杂高分子有机聚合物[14]。EPS表面有荷电官能团如羧基、羟基、硫酸基、磷酸基、氨基等,非极性官能团如芳烃,蛋白中脂肪族化合物及多糖中疏水区域,为吸附有机物提供有利条件[15]。Flemming等报道,60%以上苯、甲苯和间二甲苯均被EPS吸附,仅部分污染物被细菌细胞吸附[16]。Zhang等报道称原位接种PAHs细菌产生胞外聚合物可除去土壤中PAHs[17]。目前EPS吸附邻苯二甲酸酯类化合物研究较少,本研究通过提取DEHP降解菌Arthrobacter sp.JQ-1胞外聚合物吸附DEHP试验,探讨EPS与DEHP相互作用机制,为PAEs污染生物修复提供理论依据和技术支持。
1 材料与方法
1.1 材料
1.1.1 菌株
本试验菌株来自东北农业大学原香坊实习实验基地大棚,从土壤筛选出以DEHP为唯一碳源降解菌,命名为Arthrobacter sp.JQ-1。
1.1.2 无机盐液体培养基
K2HPO4·3H2O 1 g·L-1,NaCl 0.4 g·L-1,NH4NO30.5 g·L-1,FeCl3·6H2O 0.01 g·L-1,MgSO4·7H2O 0.4 g·L-1,CaCl2·2H2O 0.075 g·L-1。
1.1.3 试剂
DEHP(分析纯)购自天力化学试剂科技有限公司,正己烷、无水硫酸钠、浓硫酸、苯酚、葡萄糖、牛血清蛋白、腐殖酸、脱氧-D-核糖等,均为分析纯,购自天津化学试剂三厂。
1.1.4 主要仪器与设备
恒温振荡器购自上海市一恒科技有限公司;灭菌锅购自上海市博讯实业有限公司;UV-1800紫外可见分光光度计购自日本岛津公司;低温离心机购自德国Beckman公司;水浴锅购自上海予英仪器有限公司;冷冻干燥机购自上海比朗仪器制造有限公司;LC-20ADXR型液相色谱仪购自日本岛津公司。
1.2 方法
1.2.1 EPS提取
将冻存Arthrobacter sp.JQ-1菌种先活化培养,接入无机盐培养基中,在温度35℃,pH 7,125 r·min-1,DEHP 1 000 mg·L-1,接菌量4%最佳生长条件下,摇瓶培养72 h。达到培养时间后,将制备菌悬液分批倒入50 mL离心管中5 000 r·min-1离心10 min进一步浓缩,逐次累计菌体沉淀倒去上清液直至全部菌悬液离心结束,再将蒸馏水补充至40 mL,涡旋仪打匀后5 000 r·min-1离心10 min,重复3次,清洗菌体,然后将清洗过菌悬液60~70℃水浴加热,15 min后5 000 r·min-1离心15 min,取上清液,0.22 μm透析袋(3 500 DA),去离子水中透析48 h,每隔12 h换1次水,最后收集透析后液体冷冻干燥,配制得到0.5 g·L-1EPS纯样品溶液。
1.2.2 EPS组分测定
EPS组分主要包括多糖、蛋白质、腐殖酸、DNA等,多糖采用硫酸—苯酚法[18];蛋白质测定采用考马斯亮蓝法[19];腐殖酸测定采用修正Folin-Lowry法[20];DNA测定采用二苯胺法;总磷测定采用中性过硫酸钾消解-紫外分光光度法[21]。
1.2.3 EPS对DEHP吸附试验
向50 mL玻璃锥形瓶加入配制完成EPS纯样品溶液(0.5 g·L-1)30 mL,一定浓度DEHP,不同温度和pH下试验,在恒温振荡器中以125 r·min-1振荡72 h,收集样品8 000 r·min-1离心15 min,取上清液与正己烷(1∶1)加入比色管中,涡旋震荡,吸取上层液相,过无水Na2SO4测定DEHP含量,设置3个平行,空白样品不加吸附剂。
取0.5 g·L-1EPS溶液30 mL,加入不同浓度DEHP,在25℃恒温振荡器中以125 r·min-1振荡,分别在3、6、9、12、18、24、36、48、60、72 h取样,样品8 000 r·min-1离心15 min取上清液萃取,3个平行,空白样不加吸附剂。
1.2.4 吸附动力学与热力学
EPS吸附量和DEHP吸附率采用吸附前后液相中DEHP浓度计算得到:

其中,qt为t时刻EPS吸附量(mg·g-1);A为DEHP吸附率(%);C0为溶液初始DEHP浓度(mg·L-1);Ct为t时刻溶液中DEHP浓度(mg·L-1);V为溶液体积(mL);m为投加吸附剂EPS量(mg);达到吸附平衡时,Ct和qt分别表示为Ce和qe。
吸附动力学可描述吸附剂对吸附质吸附速率,该速率决定吸附平衡时间[23]。
准一级反应动力学模型为

准二级反应动力学模型为

其中,K1和K2为吸附速率常数(g·mg-1·min-1);qe为平衡时吸附量(mg·g-1);qt为 t时刻吸附量(mg·g-1)。
Freundlich和Langmuir等温吸附方程是应用最为广泛等温吸附方程[23-24]。
Freundlich吸附等温模型为

其中,qe为平衡时吸附量(mg·g-1);Ce为DEHP平衡浓度(mg·L-1);qmax为吸附剂EPS最大吸附量(mg·g-1);Kf和n为Freundlich等温吸附方程常数;Kl为Langmuir等温吸附方程常数。
动力学分析分别采用一级和二级吸附动力学模型拟合,热力学分析分别采用Langmuir和Freundlich等温吸附模型拟合。
1.3 分析方法
采用液相质谱(LC-MS)法测定各处理下DEHP含量,LC-MS具体条件为:色谱柱:Kinetex C18(150 mm×3.0 mm,2.6 μm,100 A);流动相:甲醇(0.1%FA);流速:200 μL·min-1;进样量10 μL[25]。将各处理样品冷冻干燥,与溴化钾粉末充分混合

Langmuir吸附等温模型为后压片,采用傅里叶红外光谱(FTIR)分析官能团。数据运用Microsoft Excel 2013、Origin Pro 8统计分析及绘图。
2 结果与分析
2.1 EPS成分分析
经加热提取法提取EPS,配制纯样品溶液(0.5 g·L-1)测定组分,其主要成分含量见表1。
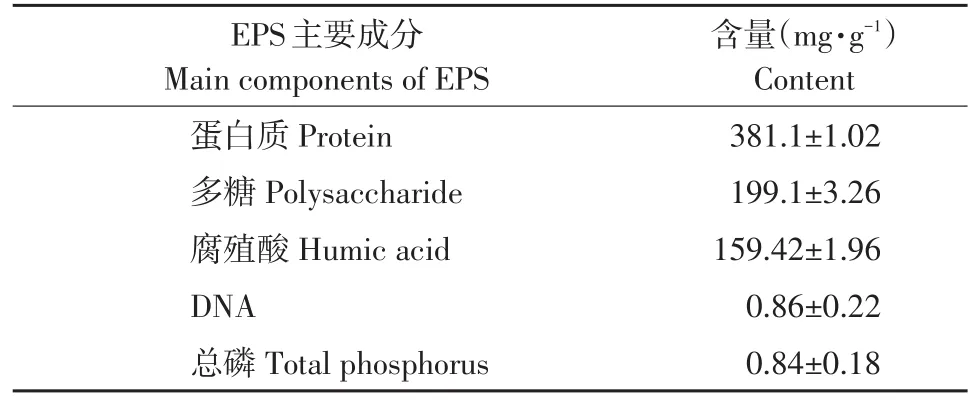
表1 EPS主要成分含量Table 1 Main components of EPS
由表1可知,测定EPS 5种成分中,蛋白质含量最高,约占EPS总量40%,原因是EPS上官能团为DEHP提供吸附位点,用DEHP培养Arthrobacter sp.JQ-1菌株时刺激蛋白质产生,多糖和腐殖酸含量较蛋白质含量稍低,约为EPS总量20%和16%,说明3种成分是EPS主要组分。这些大分子物质产生黏性力形成三维带电絮体基质,带有非极性官能团,有利于有机污染物吸附。EPS中DNA含量可间接反映EPS提取过程中细胞溶胞程度,当DNA含量占总提取EPS比例极低时,EPS提取过程无严重溶胞现象。Arthrobacter sp.JQ-1提取EPS中,DNA含量极低,说明加热提取法未使细胞过多裂解,是提取EPS有效法。
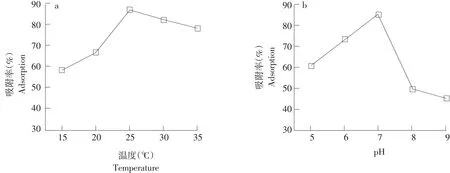
图1 温度和pH对DEHP吸附率的影响Fig.1 Effect of temperature and pH on the adsorption of DEHP
2.2 温度和pH对EPS吸附DEHP影响
不同温度EPS对100 mg·L-1DEHP吸附情况见图1a。可见在15~25℃时EPS对DEHP吸附率随温度增加而增加,25、30、35℃吸附率均超过75%,但25℃时吸附率高达85%,效果最好。这是由于温度升高加快粒子扩散和碰撞,更有利于吸附[26];当温度>30℃,EPS上活性吸附位点减少,因此常温处理DEHP效果较好。
在25℃,DEHP质量浓度100 mg·L-1,EPS浓度0.5 g·L-1,125 r·min-1,不同pH条件下试验结果见图1b。pH 5~7时,DEHP吸附率从45%增至85%,pH为7时吸附率达到最高,在85%左右。推测是pH较低情况下,EPS上原本DEHP吸附位点被溶液中大量H+争夺,EPS表面质子化,表面斥力增加,吸附率较低[27]。pH较高时吸附率较低,并非有利吸附条件,原因是随溶液中碱性增强,表面静电引力吸附被削弱。中性和弱酸条件下,EPS与DEHP作用最强,吸附量达到最大。
2.3 EPS对DEHP吸附动力学与热力学分析
温度25℃,DEHP浓度100 mg·L-1,pH 7条件下随时间改变,EPS对DEHP吸附量变化,结果见图2。EPS对DEHP吸附过程大致分为极快、快、慢3个阶段,在最初12 h内吸附量增加速度快,随时间延长吸附量由缓慢增加至达到平衡,最大吸附量达到170.14 mg·g-1,平衡时间36 h,为确保试验结果可靠性,选取48 h作为吸附平衡时间。
拟合不同浓度DEHP吸附动力学方程,探讨吸附过程基本机制结果见图3。由图3b可知,EPS对DEHP吸附动力学拟合曲线呈线性,更符合准二级动力学模型。准一级反应动力学模型依据吸附量与非吸附量比例建立;准二级反应动力学模型则以化学反应机制为基础,设定吸附率被吸附剂与吸附质间共享和交换电子化学反应控制。
由表2可知,一级动力学模拟决定系数较低,各浓度下拟合方程决定系数均未达到0.90;而二级动力学模拟结果更好,各浓度下拟合方程决定系数在0.98以上,随DEHP初始浓度增加K2减小,qe增加,说明EPS吸附DEHP过程符合二级动力学模型。产生化学机制是EPS上存在活性官能团(羧基、羟基)与DEHP分子结合,但EPS、DEHP含有高负电性含氧有机官能团也可通过物理作用(范德华力、氢键)使EPS与DEHP相互作用。
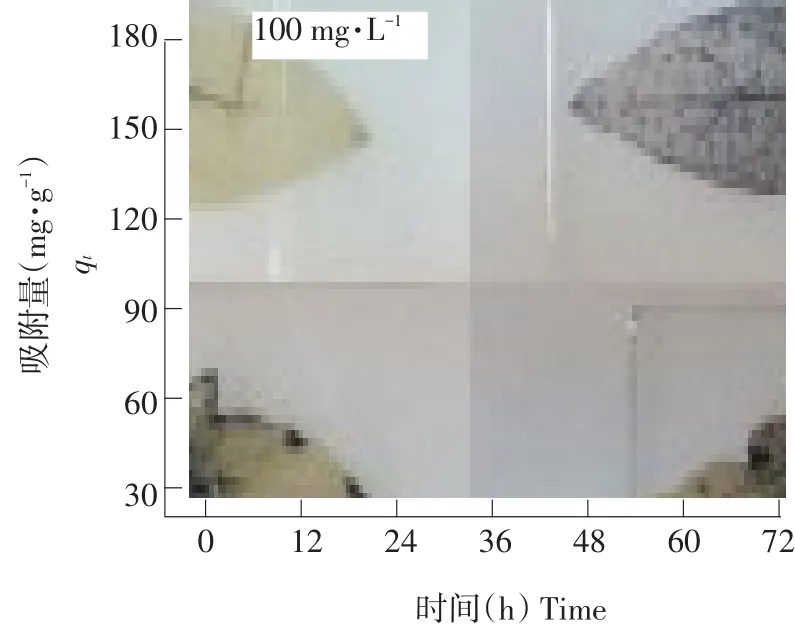
图2 DEHP在EPS中吸附动力学特性Fig.2 Adsorption dynamic characteristic of DEHP
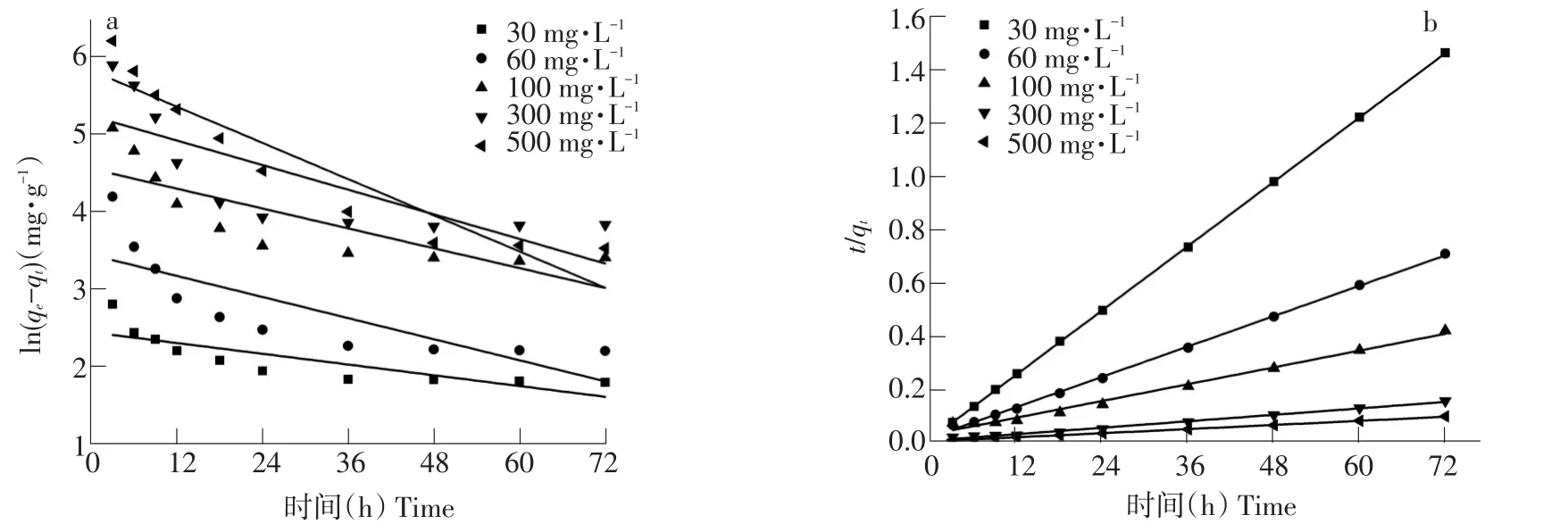
图3 准一级和准二级吸附动力学模型Fig.3 Pseudo-first order and Pseudo-second order kinetics model of adsorption
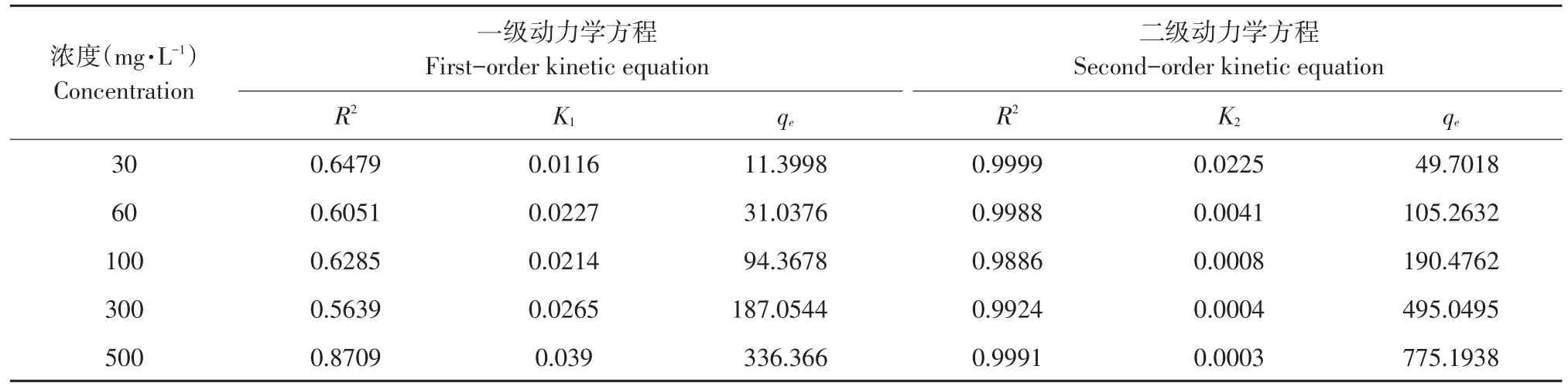
表2 吸附速率方程拟合参数Table 2 Fitting values by kinetic models
25℃下EPS在吸附DEHP达平衡浓度时吸附等温线见图4。
由图4可知,Freundlich和Langmuir等温模型中Freundlich拟合效果较好。其中,Langmuir模型以等温条件下吸附剂质地均匀且与吸附质无任何作用力,属于单层分子吸附,可以化学吸附和物理吸附;Freundlich等温模型用于非理想条件下表面吸附及多分子层吸附,可用于物理吸附和化学吸附。各模拟方程及决定系数见表3。Langmuir等温模型模拟方程决定系数为0.9921,相对较差,Freundlich模拟方程决定系数为0.9945,EPS吸附DEHP等温模型更符合Freundlich。说明EPS对DEHP吸附并非单层吸附。Kf值常代表吸附剂对吸附质亲和力,表中Kf值较高,说明EPS对DEHP具有很强亲和力;n值>1说明DEHP在EPS上吸附向有利方向发展。
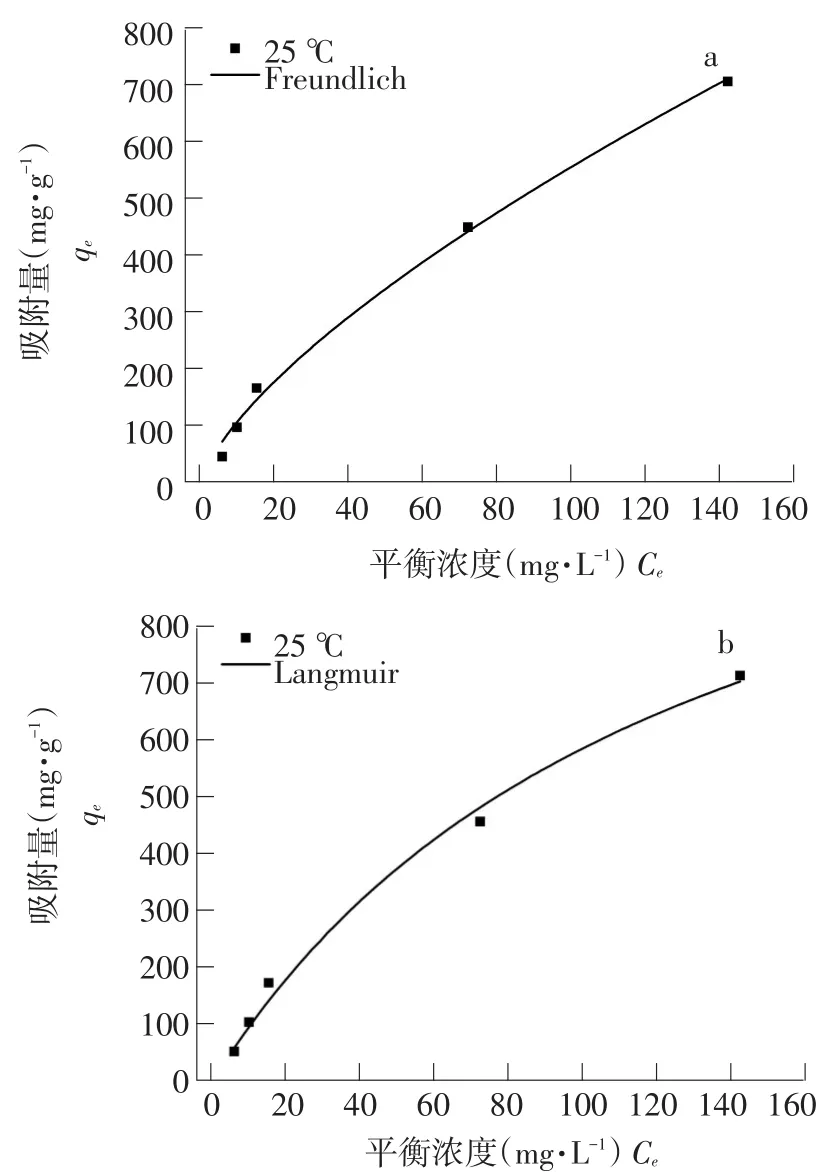
图4 Freundlich和Langmuir等温方程拟合结果Fig.4 Fitting results of Freundlich and Langmuir isotherm equation

表3 不同吸附模型拟合EPS对DEHP吸附热力学参数Table 3 Isotherm constants of various models of biosorption
2.4 DEHP对EPS红外光谱分析
EPS吸附DEHP红外光谱图(500~4 000 cm-1)见图5。FTIR观察到主要波峰对应EPS基团见表4。由图5和表4可知,不同DEHP浓度下EPS在3 500~3 200 cm-1时出现较宽吸收带,宽峰来自-OH伸缩振动,来自蛋白质、多糖、脂肪酸等组分。2 917~2 931 cm-1是-CH2-振动,来自于脂类。典型酰胺Ⅰ带(C=O伸展振动)和酰胺Ⅱ带(-NH弯曲振动与-CN伸展振动叠加)分别出现1 660~1 600和1 520~1 550 cm-1处,1 385 cm-1是蛋白质中C=O对称振动,1 047~1 123 cm-1为多糖C-O-C伸缩振动和C-O伸缩振动峰。在FTIR光谱指纹区存在含磷或含硫基团,是EPS中少量脂类和核酸。当EPS吸附不同浓度DEHP时,光谱图峰域,存在漂移,说明DEHP存在使EPS上各类基团与其相互作用,其中羟基、羧基和羰基等基团起主要作用,这些基团主要位于蛋白质和多糖等组分中,吸附过程较重要。
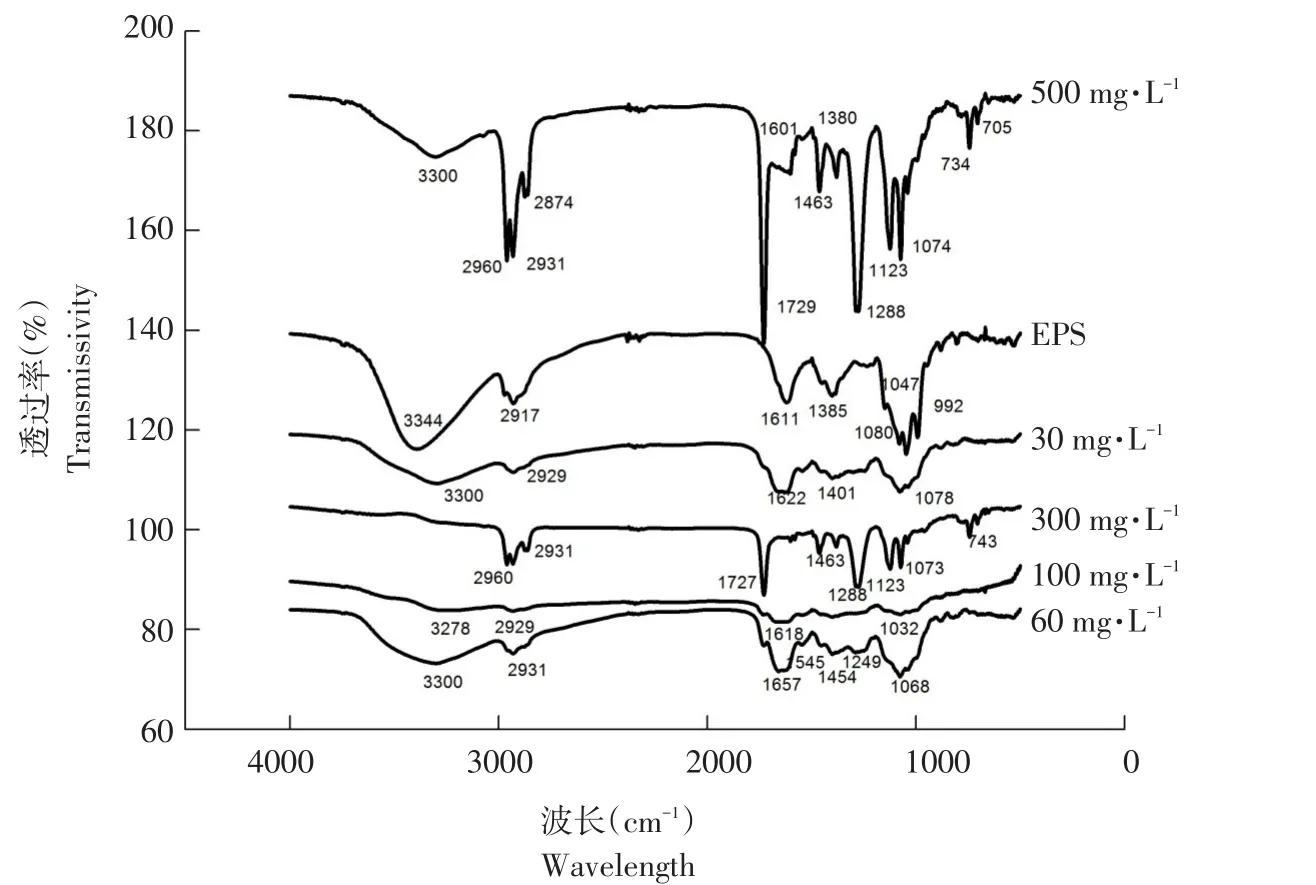
图5 EPS吸附DEHP红外光谱Fig.5 FTIR image of EPS adsorption DEHP
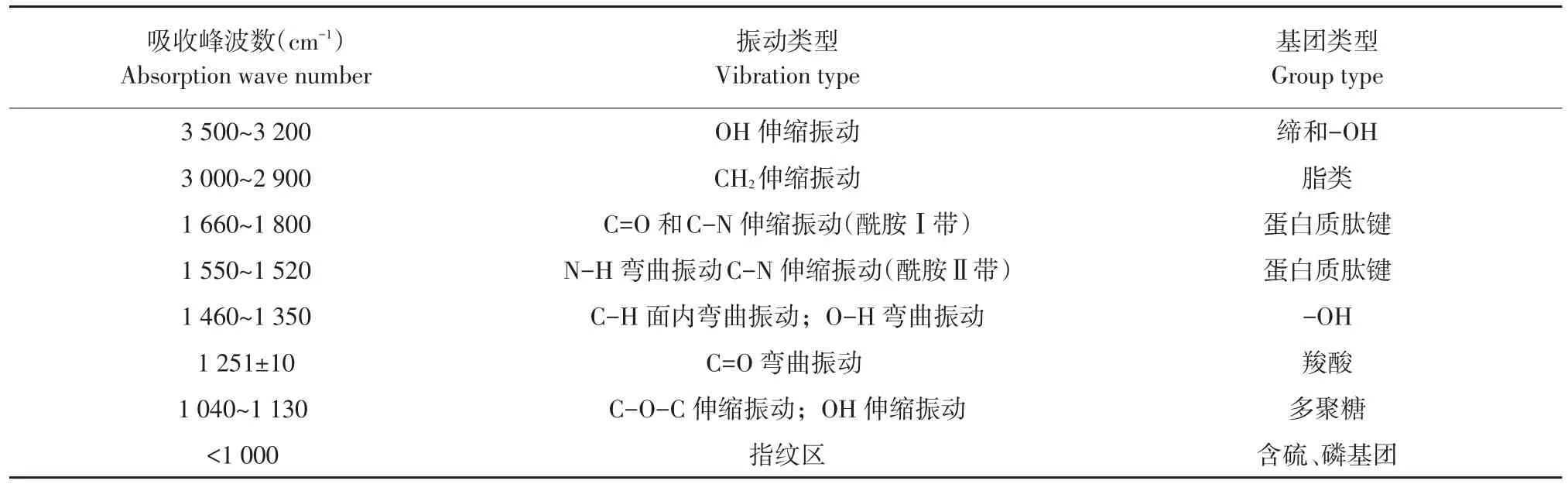
表4 FTIR图观察到EPS主要基团Table 4 The main functional groups of EPS observed in FTIR spectra
3 讨 论
通过加热提取DEHP高效降解菌Arthrobacter sp.JQ-1胞外聚合物,发现EPS组分中蛋白质>多糖>腐殖酸,蛋白质含量高达40%,与张燕等[28]研究Ca2+对生物膜组分影响中,蛋白质含量高于多糖结果相似。与Wen等测定生物膜成分时发现蛋白质含量总是高于多糖一致[29]。张俊珂等发现,受四环素影响活性污泥胞外聚合物组分中,EPS中蛋白质和多糖含量均高于IPS,蛋白质较多糖含量高[30]。EPS主要成分有多糖、蛋白质、腐殖酸,其中蛋白质成分均具有带负电荷氨基酸、疏水性氨基酸和少量亲水性电中性氨基酸,多糖中带阴离子特性基团,与多价阳离子间相互作用显著增强EPS分子间稳定性。EPS表面带多荷电基团,有助于吸附有机污染物。
环境因素中温度和pH影响EPS吸附DEHP。过高或过低温度条件吸附率较低,原因是EPS上活性位点减少,不利于吸附DEHP,室温下则达到最大吸附率最适温度。初始pH是生物吸附研究重要因素,因其影响细菌表面化学性质和溶液中吸附质溶解度,改变DEHP对生物吸附剂亲和力。EPS由多糖、蛋白质和含有许多官能团脂质组成,包括羟基、羧基、磷酸酯和氨基,对pH依赖性较强。DEHP是非离子化合物,在中型条件下较稳定,但在低或高pH条件下可发生酸或碱性水解,使EPS上吸附位点被抢占,吸附率降低。研究表明PAEs吸附可用疏水和分散作用解释[31]。根据Moreno-Castilla中性条件下对DBP吸附主要归因于疏水作用,其特征在于吸附剂表面疏水性位点和DBP非极性烷基间异常强吸引力[32]。本试验发现,pH中性条件下,EPS对DEHP吸附率最高,因EPS表面非极性官能团,包括芳香族化合物、蛋白质中脂肪族、多糖疏水区域与DEHP主要通过疏水作用结合。Pan等报道EPS与菲之间相互作用是自发放热,结合主要是疏水作用[33]。EPS亲疏水性影响有机物吸附,本文中EPS蛋白质含量高,其中疏水区域占较大比重,因此更利于DEHP吸附。
本文通过研究EPS对DEHP吸附动力学和热力学发现,EPS对DEHP吸附符合拟二级动力学和Freundlich等温模型,化学和物理机制共同作用,对DEHP吸附并非单层吸附。较大Kf值代表EPS对DEHP具有很强亲和力,是吸附剂和吸附质共同作用结果,主要是疏水键力、氢键力和范德华力之间作用。王士东等研究好氧污泥胞外聚合物对玫瑰红B染色剂吸附发现,其过程符合二级动力学和Freundlich等温模型,与本文结果一致[34]。
根据傅里叶红外光谱峰值振动,说明EPS和DEHP之间起主要作用的是羟基、羧基和羰基等基团,这些基团主要位于蛋白质、多糖等组分中,进一步证明EPS组分与DEHP发生作用,参与吸附过程。
4 结 论
DEHP高效降解菌Arthrobacter sp.JQ-1提取EPS组分主要为蛋白质、多糖、腐殖酸,这些组分含有许多官能团,有利于吸附有机污染物。EPS吸附DEHP最佳条件为pH 7,25℃。EPS对DEHP吸附动力学和热力学符合拟二级动力学和Freundlich等温模型,化学和物理机制共同作用,主要是疏水键力、氢键力和范德华力之间作用。本试验结果表明,EPS对处理酞酸酯类化合物效果良好,可作为邻苯二甲酸酯类有机污染物生物吸附剂。

