VIGS诱导SL-ZH22基因沉默下番茄耐盐性研究
李景富,张晓春,姜景彬,杨欢欢,赵婷婷,许向阳
(东北农业大学园艺园林学院,哈尔滨 150030)
番茄生长受多种环境因素调控。温度较低、土壤水分匮乏、土壤高盐高碱等逆境影响番茄产量和品质。研究植物抗逆应答机制,明确植物基因调控机制,挖掘可供利用抗逆基因资源在农作物抗逆品种选育工作中具有重要意义。
VIGS(Virus-induced gene silencing)是高等植物转录后的一种基因沉默现象,当宿主细胞遇到外源病毒入侵与外源产生斥性时可引发[1]。RNA介导的基因沉默技术(RNA-mediated gene silencing)发生在RNA水平上,广泛存在各类生物体中,该技术以核酸序列特异性降解机制为理论依据,在真菌中被称为基因消除(Gene quelling),在植物中则被称为转录后基因沉默(Post-transcriptional gene silencing,PTGS)[2]。病毒诱导的基因沉默技术(VIGS)应用广泛。目前,VIGS已应用于水稻、番茄、拟南芥等[3]。传统鉴定植物基因功能方法涉及植物遗传转化和转基因后代鉴定筛选,周期相对较长[4]。病毒诱导基因沉默技术(VIGS)相比于传统基因功能分析方法,具有高效率、高通量等特点,在较大范围基因功能鉴定分析中应用广泛。此外,VIGS技术易于操作,沉默后可在短时间内观察功能缺失表型[5]。近年来,在植物抗病抗逆、代谢调控等相关基因功能鉴定中,VIGS应用广泛[6]。
在恶劣环境因素影响下,植株果实品质降低、产量减少。植物生长和发育过程中,ZF-HD转录因子家族基因在帮助调控植物应对复杂逆境胁迫时占据主导地位。ZF-HD家族基因在多种作物中进化、分类和功能研究较多,但与番茄ZF-HD转录因子相关功能研究相对较少,逆境胁迫方面研究更少。因此本试验研究番茄ZF-HD家族基因中SL-ZH22基因功能及非生物胁迫下表达模式,确定该基因在番茄植株应对逆境胁迫中的作用。
通过VIGS技术可有效抑制特定基因表达,为明确植物特定基因控制的植物性状,当目的基因表达受抑制时,根据植物表型变化确定该基因功能,为确定基因功能提供便捷高效方法。为研究SL-ZH22基因在番茄植株耐盐性中的功能,本试验从番茄植株中提取目的基因并作VIGS处理,验证分析沉默基因耐盐性功能。利用VIGS基因沉默原理,通过对比观察植株表型变化、测定植株抗性相关生理生化指标,确定目的基因与植株抗性关系,进一步分析目的基因调控机制,为番茄抗逆品种选育研究提供理论依据。
1 材料与方法
1.1 材料
本试验材料为番茄栽培品种Moneymaker,2018年1月种植于东北农业大学园艺试验站连栋温室中,播种时使用草炭蛭石混合物(3∶1),摹拟自然环境光温。
1.2 方法
待Moneymaker长至四叶一心时,取18株长势良好番茄幼苗,其中9株作基因沉默处理,其余为对照。用无菌水将四叶期番茄幼苗根部冲洗干净,在装有Hoagland's营养液的100 mL锥形瓶中预培养2 d,非生物胁迫处理沉默后番茄植株。分别在0、3、6、12、24 h观察,对比植株表型变化。各时间点取样,用于后续试验分析。
1.2.1 目标片段扩增和载体构建
提取番茄叶片总RNA并合成cDNA。利用SLZH22基因mRNA序列,结合Primer5设计特异的含有双酶切位点(Eco R I和Bam H I)及保护碱基的引物,琼脂糖凝胶电泳分析得到PCR产物,PCR产物胶回收,回收产物测序验证分析,PCR纯化试剂盒(TaKaRa)纯化,纯化产物克隆到TRV2载体并测序。
从含TRV2菌液中提取质粒,利用Eco R I和Bam H I酶切TRV2质粒和目的片段,将酶切后质粒与目的片段经T4DNA连接酶连接,连接成功的载体命名为CM22。将CM22载体导入大肠杆菌DH5α感受态中,鉴定菌液PCR。并将含有CM22重组载体的大肠杆菌DH5α菌液与TRV2-PDS重组载体导入农杆菌中,命名为N22。八氢番茄红素脱氢酶(Phytoene desaturase,PDS),是一种类胡萝卜素合成关键酶,如果该基因在植株内被成功沉默,植株会出现白化现象。故本试验将其作为指示基因,待接种TRV2-PDS载体植株叶片出现褪绿白化后,开展后续研究[7]。
1.2.2 番茄幼苗侵染方法
待Moneymaker番茄幼苗长至四叶一心时,移取长势良好、尺寸相近番茄幼苗至营养钵中,用于后续农杆菌接种。
取1 mL注射器将混合菌液注射至番茄幼苗叶片与嫩茎中,每次接种均3次生物学重复。
按条件培养侵染番茄植株后,侵染17 d后番茄幼苗出现白化现象。从顶部生长点开始向底部逐渐扩散呈整体白化现象,番茄叶片由叶柄开始向叶脉扩散逐渐出现白化现象。2个月后白化现象仍显著存在。证明指示基因PDS在番茄幼苗中沉默成功且效果稳定。
1.2.3 基因沉默效率确定方法
分别从沉默处理25 d后植株和对照植株摘取叶片,提取RNA并合成cDNA,并作qRT-PCR确定基因沉默效率。
1.2.4 基因沉默植株非生物胁迫下表达量分析
综合SL-ZH22基因表达模式对比效果与逆境处理效果,选择高盐胁迫开展后续试验。待接种含TRV-PDS农杆菌的植株白化比较完全时,按时间点高盐胁迫处理接种含重组质粒农杆菌植株并取样,在样品中提取RNA并合成cDNA,通过qRTPCR(实时荧光定量PCR)确定基因沉默效率。
1.3 生理生化指标测定
1.3.1 SOD、POD、PRO和MDA测定
本试验所有生理生化指标测定均使用苏州科铭生物技术有限公司生产试剂盒。生理生化指标测定前,预测定3个预期差异较大样本。通过试验测定后与预测一致,证明试剂盒与操作可信。
1.3.2 DAB与NBT植物组织染色
DAB与植物组织中H2O2反应生成棕红色沉淀,NBT与植物组织中O2-反应生成深蓝色沉淀[8]。根据该化学反应原理,通过DAB和NBT染色方法观察番茄叶片H2O2和O2-积累情况,具体染色步骤参照文献[9]。
1.4 数据分析
根据试验结果利用Graph Pad6软件处理数据并制作图表。
2 结果与分析
2.1 农杆菌转化侵染番茄植株侵染效果
侵染番茄植株并按条件培养,17 d后被侵染番茄幼苗逐渐白化,叶片白化现象由叶柄向叶脉扩散,整体白化现象从番茄顶部生长点开始向底部扩散,2个月后再次观察,发现植株仍存在白化现象,证明指示基因PDS在番茄幼苗中沉默成功,且效果稳定。将N22侵染过的番茄植株取材,分析表达量。
2.2 沉默效果初步验证与分析
分别初步验证正常植株、TRV2空载、SLZH22沉默后植株。结果显示,正常植株和TRV2空载植株表达量无明显变化,SL-ZH22表达量显著降低,证明植株沉默成功。
2.3 沉默植株盐胁迫表型观察结果
因0、3、12、24 h时盐胁迫下植株变化不明显,6 h时最明显,故将SL-ZH22基因沉默植株选取在6 h下观察。由图1可知,盐胁迫处理6 h时,发现基因沉默后植株比对照植株萎蔫严重。

图1 盐处理下CK植株和SL-ZH22基因沉默植株表型变化Fig.1 Phenotype change of CK and SL-ZH22 gene silencing plants under salt stress
2.4 沉默前后番茄植株表达量对比结果
由图2可知,在0、3、6、12 h时T2空载和未沉默植株SL-ZH22基因表达量无明显变化,沉默处理后植株各时间点表达量均较低。
2.5 沉默前后非生物胁迫生理生化指标测定结果
2.5.1 超氧化物歧化酶SOD活性检测结果
研究表明,高盐胁迫下,番茄生理代谢中抗氧化系统遭到破坏,高盐逆境环境导致番茄植株中抗氧化酶SOD活性增强。
试验结果如图3所示。未沉默植株经盐胁迫处理后SOD酶活性升高,SL-ZH22基因沉默后未胁迫植株SOD酶活性无明显变化,高盐胁迫后植株SOD酶活性降低,由此推测SL-ZH22基因可能参与SOD酶形成。
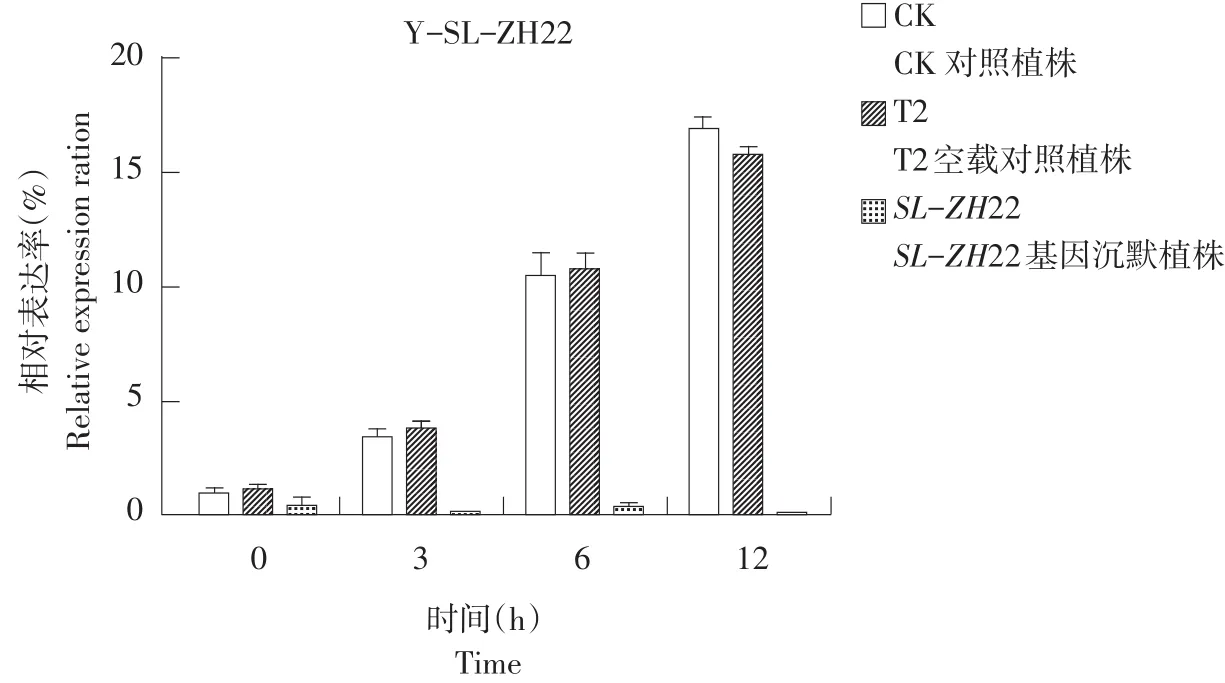
图2 盐处理下沉默SL-ZH22前后对比结果Fig.2 Comparison result before/after silencing SL-ZH22 under salt stress

图3 逆境下沉默前后SOD酶活对比结果Fig.3 Comparison result of SOD enzyme activity before/after silencing under salt stress
2.5.2 过氧化物酶POD活性检测结果
由图4可知,基因沉默前盐胁迫番茄植株POD酶活性高于对照,而沉默SL-ZH22基因后发现未胁迫处理植株POD酶活并无显著变化,而盐胁迫处理后POD酶活性低于对照植株。由此可推测SLZH22基因可能参与番茄植株POD酶形成。
2.5.3 脯氨酸PRO测定结果
由图5可知,在SL-ZH22基因沉默前盐胁迫处理番茄植株PRO表达率高于对照,SL-ZH22基因沉默后正常植株PRO表达率无明显变化,盐胁迫处理后植株PRO表达率显著升高。
2.5.4 丙二醛MDA测定结果
由图6可知,基因沉默前,盐胁迫处理番茄植株MDA表达率高于对照。SL-ZH22基因沉默后未盐胁迫处理番茄植株MDA表达率无显著差异,胁迫处理后植株MDA表达率明显低于对照。
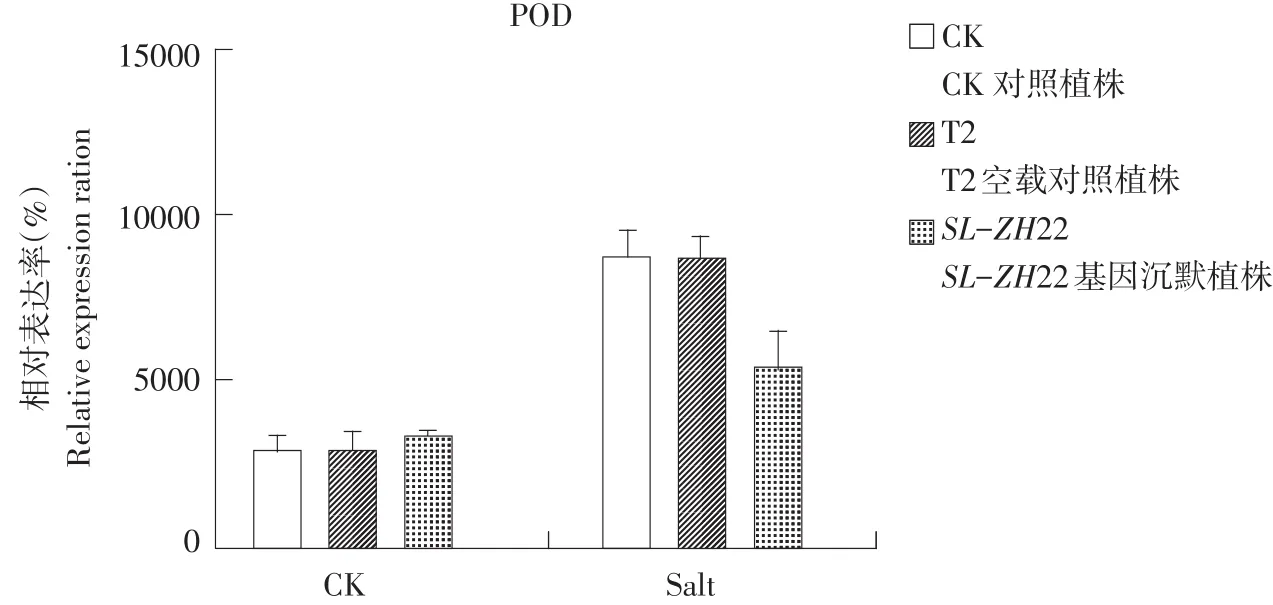
图4 逆境下沉默前后POD酶活对比结果Fig.4 Comparison result of POD enzyme activity before/after silencing under salt stress
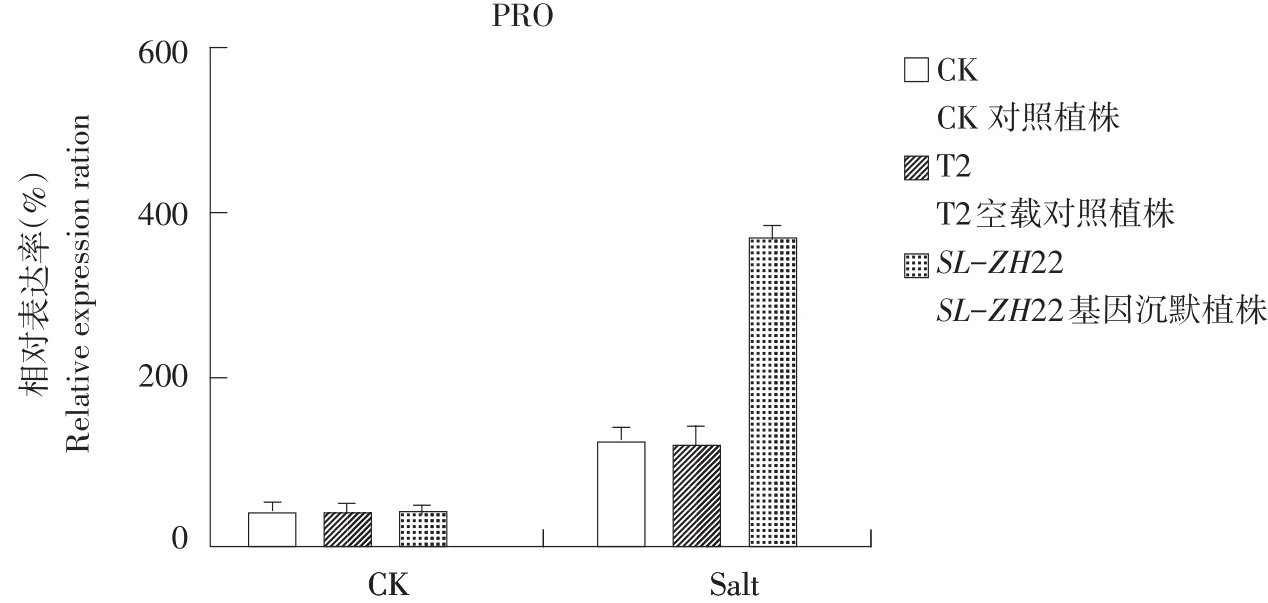
图5 逆境下沉默前后PRO对比结果Fig.5 Comparison result of PRO activity before/after silencing under salt stress
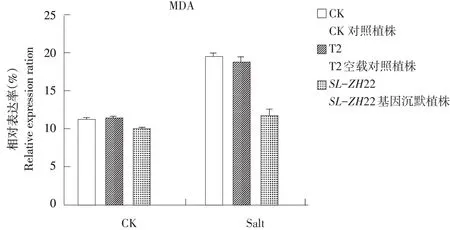
图6 逆境下沉默前后MDA对比结果Fig.6 Comparison result of MDA content before/aftersilencing under salt stress
2.5.5 活性氧测定结果
由图7、8可知,DAB染色后,未沉默前盐胁迫处理植株叶片颜色比正常植株深,SL-ZH22基因沉默后,盐胁迫处理后植株叶片基部染色相对较深。NBT试剂染色后,未胁迫处理基因沉默植株叶片与正常叶片相比颜色较深,基因沉默叶片在盐胁迫下差别明显,基因沉默处理叶片盐胁迫下着色比正常叶片深。

图7 DAB染色组Fig.7 DAB colored team

图8 NBT染色组Fig.8 NBT colored team
3 讨论与结论
本研究通过分析沉默SL-ZH22前后盐胁迫处理基因表达量,结果表明基因沉默植株盐胁迫处理后表达量差异显著,初步明确SL-ZH22基因可能与番茄耐盐性有关。植物体细胞内存在各种抗氧化物质,如抗氧化分子和抗氧化酶等,抗氧化物质通过直接或间接方式清除植物体内活性氧,避免细胞膜损伤,也可保护生物大分子,如蛋白质、核酸等免受自由基氧化损害。其在植物应对逆境胁迫,维持生长发育过程中有重要作用[10]。
植物遭遇逆境环境时,体内会积累大量活性氧(ROS),严重损伤植物机体。但植物体经过漫长进化后,可形成复杂的抗氧化酶体系减少植物体内ROS积累,抗氧化体系中不仅含维生素C(Vtiamin C)、β-胡萝卜素(β-carotene)等非酶类抗氧化物质,还包括超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)等酶类抗氧化剂[11]。在植物抗氧化系统中,SOD首先发挥作用,在氧化酶系统中处于核心位置。SOD在抗氧化体系中催化O2-·发生岐化反应,O2-·被分解成过氧化氢(H2O2)和氧气(O2),抗坏血酸和过氧化氢酶又可将H2O2分解为H2O和O2,消除O2-·对细胞的氧化胁迫作用。该氧化酶在维持植物体自由基产生与消除的动态平衡过程中发挥重要作用[12]。但不同植物品种对逆境抵抗存在差异,SOD酶活性不同[13]。本试验番茄品种Moneymaker在盐胁迫条件下未沉默植株SOD酶活性明显高于正常植株,沉默后未胁迫处理植株SOD酶活性无明显变化,但高盐胁迫处理植株SOD酶活性却低于对照,推测SL-ZH22基因参与SOD酶形成;POD酶是膜保护系统重要组成部分,结合其他酶减少植物体内自由基及过氧化氢等造成的损害[14]。
本研究中正常番茄植株在逆境处理后POD酶活性比对照植株高,沉默SL-ZH22基因后,正常植株无明显变化,盐胁迫处理后植株POD酶活低于对照,说明植物抗盐系统中SL-ZH22基因可能参与POD酶形成;PRO是植物中常见渗透物质,植物在胁迫条件下可在体内积累大量脯氨酸,调节细胞内渗透压,保持胞内渗透平衡,有效避免渗透胁迫造成伤害,还有清理自由基作用,保护细胞结构,对植物抵抗逆境具有重要意义[15]。PRO在基因沉默前后有无盐胁迫处理植株中均无显著变化,而沉默SL-ZH22基因盐胁迫处理后,植株中PRO含量增多,可证明SL-ZH22基因与植物抗逆系统中PRO形成无关;MDA是植物细胞在逆境环境中发生过氧化反应产物,常作为膜质过氧化指标[16],本研究通过沉默SL-ZH22基因盐胁迫处理后发现植株MDA活性低于对照,因此推测SL-ZH22基因与植物逆境胁迫中MDA产生无关。
番茄器官中叶片表面积最大,而气孔与番茄水分控制与气体交换密切相关,外部环境极易影响植株体气孔闭合,改变植株形态和结构[17]。气孔观察结果显示,番茄植株在盐胁迫环境中部分气孔处于关闭状态,与齐红岩番茄叶片气孔在水分胁迫下易闭合结论一致[18]。本研究沉默SL-ZH22基因后植株在盐胁迫下气孔通度增大,证明SLZH22基因可能提高番茄耐盐能力。植物细胞在有氧代谢过程中有活性氧(ROS)产生,ROS中包括很多含氧自由基和含氧分子,如超氧阴离子(O2-)、羟自由基(·OH)等含氧自由基;过氧化氢(H2O2)、单线态氧(O2-)等非自由基形成的含氧分子[19]。外界环境中逆境胁迫打破植物体中自由基产生与消除动态平衡,由此造成的活性氧积累会导致有害膜脂过氧化反应等,伤害植物[20]。本试验检测两种重要ROS分别为过氧化氢(H2O2)和超氧阴离子(O2-)。使用二氨基联苯胺(DAB)和氯化硝基四氮唑(NBT)检测H2O2和O2-,DAB遇H2O2会产生淡红棕色沉淀物质,NBT遇O2-产生深蓝色不溶性甲醛化合物。沉默SL-ZH22基因植株叶片颜色较沉默前更深,沉默后盐处理叶片颜色较沉默前更深,说明SL-ZH22基因减少番茄活性氧产生,证明SLZH22基因可增强番茄植株耐盐能力。
本研究开展SL-ZH22基因VIGS功能验证,通过植株沉默后表型观察、基因表达量、组织学观察及生理生化指标测定表明SL-ZH22基因沉默后番茄植株耐盐能力明显下降。因此,推测SLZH22基因可能提高番茄耐盐能力。

