Bacillus sp.肌氨酸氧化酶的脱辅基与重构
王 庆, 辛 瑜, 杨海麟, 仝艳军, 王 武
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
肌氨酸氧化酶 (Sarcosine oxidase,EC.1.5.3.1,SOX)属于黄素蛋白氧化酶类,以FAD为辅因子,催化肌氨酸中N-甲基的氧化还原[1]。检测血清或尿液中肌酐的含量,是判断肾功能的一项重要指标,而SOX则是此项检测的关键诊断用酶之一[2],在酶法测定中,肌酐转化为肌氨酸,然后在肌氨酸氧化酶(SOX)的作用下分解成甘氨酸、甲醛和H2O2[3],催化机理见图1。
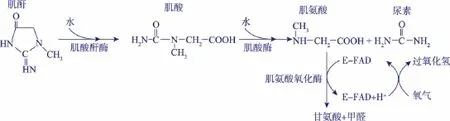
图1 肌酐降解酶系的催化机理Fig.1 Catalysis in creatinine degradation enzyme system
现代临床检测肌酐的方法主要是基于上述酶促反应机理。SOX的酶学性质将在很大程度上影响它的应用价值[4]。作为典型的、以共价结合FAD为辅因子的SOX,其辅基与酶蛋白的复合状态直接影响到此类酶的活性与特异性[5]。为SOX脱去辅基再复合的研究并不多见,解决共价结合型辅基的脱除尤为困难[6-7]。本研究探索出采用不含辅因子FAD的SOX包涵体复性的方法,对肌氨酸氧化酶进行脱辅基以及与天然辅基的复合,探究如何在复性的过程中添加辅因子[8],促使酶蛋白本体在正确折叠的过程中螯合辅因子,并呈现出酶学活性[9]。研究SOX酶蛋白与不同的、潜在的辅基之间存在着什么样的关系,对改造乃至提高此类黄素酶的催化特性,将提供有意义的参考价值[10]。
1 材料与方法
1.1 菌种
E.coli BL21(DE3)/pET28a-soxopB:由作者所在实验室保存[11]。
1.2 培养基
1.2.1 种子培养基(g/L)胰蛋白胨10,酵母提取物 5,氯化钠 10,琼脂 20;pH 7.5。
1.2.2 发酵培养基(g/L)胰蛋白胨10,酵母膏5,KH2PO42,K2HPO4·3H2O 4,NH4Cl 0.2, (NH4)2SO41.2,Na2HPO4·12H2O 7,MgSO4·7H2O 1, 葡萄糖 0.5;甘油10 mL/L。121℃下灭菌20min。
1.2.3 乳糖诱导液(g/L) 乳糖200;115℃灭菌30 min。
1.3 主要试剂
β-巯基乙醇、FAD (黄素腺嘌呤二核苷酸)、FMN(黄素腺嘌呤单核苷酸)、肌氨酸氧化酶、FMN(黄素腺嘌呤单核苷酸):Sigma 公司;Tryptone、Yeast Extract、GSH、GSSG、核黄素、卡那霉素、牛血清蛋白(BSA)、辣根过氧化物酶:上海Sangon公司;尿素等其他试剂均为国产分析纯。
1.4 方法
1.4.1 SOX包涵体的制备粗提取将新鲜活化菌种接种于LB发酵培养基(含1%卡那霉素),在 37℃、200 r/min的摇床中振荡培养8 h后,加入终浓度为5%的乳糖诱导剂诱导 16 h,然后离心去上清液,在20 mmol/L Tris-HCl(pH值8.0)缓冲液中进行冰浴超声波破碎,破碎完成后于8 000 r/min离心15 min,弃去上清液,得到肌氨酸氧化酶包涵体。
1.4.2 SOX包涵体的溶解将洗涤后的包涵体加入到 20 mmol/L Tris-HCl(pH 值 8.0,含 8 mol/L尿素,15 mmol/L β-巯基乙醇)配制的溶解液中,在200 r/min的摇床中过夜,过夜后10 000 r/min离心15 min,取离心后的上清液即为肌氨酸氧化酶包涵体溶解液。
1.4.3 SOX包涵体的透析复性将SOX包涵体变性溶解液置入透析袋中进行复性,通过预实验先探究复性的基本条件:如蛋白质质量浓度、温度、氧化还原态、pH、时间等,确定SOX透析复性的最适条件后,加入辅基FAD复性,并按一定的时间间隔取样测酶活性。
1.4.4 SOX脱辅基蛋白与辅酶复合的条件将SOX包涵体变性溶解液置入透析袋中,按照实验前期探索的最佳复性条件进行,如蛋白质质量浓度0.3 g/L,透析液pH 8.5,温度4℃,氧化还原值(GSH/GSSG)为2,复性时间为24 h等,加入的辅因子换为FMN、核黄素(均为4 mg),另外设置不添加任何辅因子的作为对照,比较不同天然辅基与SOX蛋白复合后酶活、结构与热稳定性的变化。
1.5 分析测定方法
1.5.1 蛋白质质量浓度采用考马斯亮蓝法测定质量浓度,以牛血清白蛋白为标准物,按照标准方法进行测定。
1.5.2 酶偶联分光光度法测定SOX酶活力以肌氨酸为底物,按照文献[12]进行测定。
2 结果与讨论
2.1 不同因素对SOX包涵体复性的影响
2.1.1 变性可溶蛋白质质量浓度对SOX后期复性的影响用变性液将包涵体的蛋白质质量浓度调制为 0.05、0.1、0.2、0.3、0.5、0.8 mg/mL, 要使溶解液中尿素的浓度不能改变,否则会导致复性过程中蛋白质的沉淀。在室温下(15℃)透析开始时透析外液中加入6 mol/L的尿素,并添加过量的FAD,加入氧化还原态(GSH/GSSG)比值为 3的GSH与GSSG,以后每隔4小时将透析外液中尿素的浓度递减2 mol/L(每次换液时都需要添加4 mg的FAD),复性结束后取样测定SOX的比酶活,见图2。
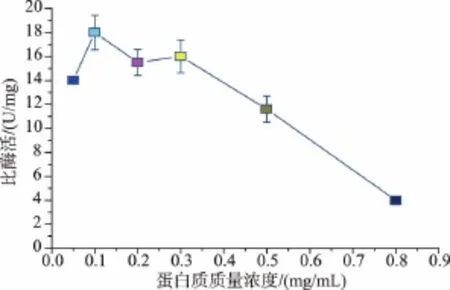
图2 蛋白质质量浓度对复性后SOX比酶活的影响Fig.2 Effects of protein concentration on the specific activity of refolded SOX
从图2可以看出,在蛋白质质量浓度为0.1mg/mL时复性后的酶比活性最高,变性蛋白质的质量浓度越低,越有利于复性。但初始蛋白质质量浓度太低,复性后的蛋白质质量浓度也比较低,不利于活性蛋白质的回收。且在蛋白质质量浓度为0.8 mg/mL时蛋白质产生部分沉淀,所以蛋白质质量浓度不宜过高,但考虑到后期工作的复杂性,复性时蛋白质质量浓度不能过低,所以取0.3 mg/mL。
2.1.2 复性时间对SOX比酶活的影响使包涵体的蛋白质质量浓度为0.3 mg/mL,室温下(15℃)首次透析时在透析外液中加入6 mol/L的尿素,以后每隔不同时间(1、2、4、6、8 h)将透析外液中尿素的浓度递减2 mol/L(每次换液时都需要添加2 mg的FAD),加入氧化还原态 (GSH/GSSG)比值为3的GSH与GSSG,复性结束后取样测定SOX的比酶活,见图3。
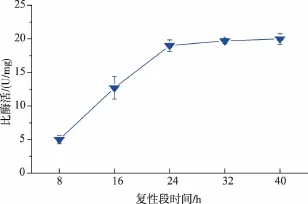
图3 复性时间与复性后SOX比酶活的关系Fig.3 Relation of renaturation time to the specific activity of refolding SOX
由图3可知,复性时间为24 h比酶活比较高,到了32 h,比酶活虽然还在增长但幅度比较小,而且酶复性时间太久,SOX蛋白质分子之间聚集,活性容易下降,故应选择复性时间为24 h为宜,即每隔6小时更换不同浓度的复性缓冲液。
2.1.3 复性温度对SOX比酶活的影响使包涵体的蛋白质质量浓度为0.3 mg/mL,首次透析时在透析外液中加入6 mol/L的尿素,以后每隔6小时将透析外液中尿素的浓度递减2 mol/L(每次换液时都需要添加2 mg的FAD),加入氧化还原态(GSH/GSSG)比值为3的GSH与GSSG,透析24 h后取样测定SOX的比酶活,研究3个复性温度对SOX重折叠的影响,见图4。

图4 不同温度对复性后SOX比酶活的影响Fig.4 Effect of different temperatures on the specific activity after refolding of SOX
由图4可知,在4℃条件下复性的SOX的活性和质量回收率均高于在15℃和25℃下复性的SOX。导致这种现象出现的原因是SOX变性溶解液在重折叠的过程中,分子内部的疏水基团有机会暴露在外界环境中,分子内部或者不同分子之间的疏水基团时时刻刻都在发生布朗运动,温度升高时布朗运动加剧,导致暴露在外的水基团互相碰撞形成了不正确的折叠造成聚集的产生。而低温时布朗运动速度慢,疏水基团就不容易发生接触形成聚集体。
2.1.4 透析液pH对SOX比酶活的影响复性透析液的pH值必须在7.0以上,可以促进二硫键的正确形成[13],在前面的研究条件下,使透析液的pH分别为 7.0、7.5、8.0、8.5 和 9.0,加入氧化还原态(GSH/GSSG)比值为3的GSH与GSSG,在4℃下复性24 h(每次换液时都需要添加2 mg的FAD),结束后测定蛋白质质量浓度和活性,考察透析液pH值对蛋白质复性的影响,见图5。
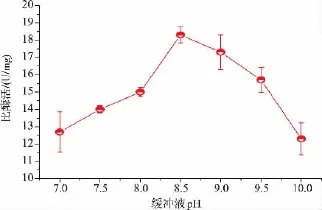
图5 透析液pH对复性后SOX比酶活的影响Fig.5 Effect of dialysis pH on the specific activity of refolding SOX
研究显示,透析液pH为8.5的条件下复性效果最好,而导致这种现象的原因是SOX变性溶解液在重折叠的过程中,分子内部的二硫键的正确折叠起着非常重要的作用,而过高或过低的pH会影响二硫键的状态,二硫键复性时最适宜的复性pH值一般为8.0~9.0,结合实验结果选择pH为8.5较为适宜。
2.1.5 透析液氧化还原态(GSH/GSSG)对复性SOX的影响氧化还原电势对于形成正确的二硫键非常必要。氧化还原电势过小,二硫键不会产生;氧化还原电势过高,二硫键的形成容易出问题。首先确定GSSG浓度为1 mmol/L,分别加入GSH,使其与GSSG 摩尔比为 0.25、0.5、1、2、3、5, 考 察 GSH 与GSSG比例对SOX复性的影响,见图6。
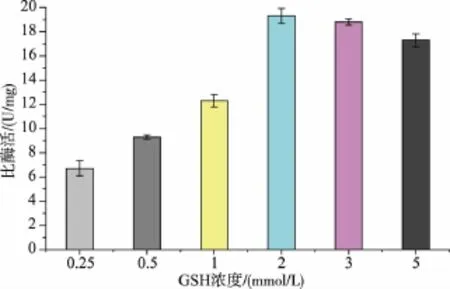
图6 氧化还原环境对复性后SOX比酶活的影响Fig.6 Redox environment after refolding SOX specific activity
图6显示,在添加2 mmol/L的GSH条件下复性效果有明显提高,因此选择GSH/GSSG为2。
2.2 不同天然辅基与SOX脱辅基蛋白复合的研究
2.2.1 圆二色谱检测不同辅基与脱辅基SOX的复合通过上述透析复性得知,在复性的过程中添加2 mg的FAD作为辅基可以使酶结构正确折叠,使得315位的Cys与FAD辅因子通过二硫键结合。为了判断不同天然辅基与脱辅基蛋白的复合是否成功[14],在透析复性过程中分别加入4 mg不同的辅基,如FAD、FMN、核黄素,不加任何黄素辅基的设为空白,采用CD分析不同天然辅基与肌氨酸氧化酶脱辅基蛋白复合前后二级结构的变化,不同天然辅基与酶复合的圆二色谱见图7。

图7 不同天然辅基与肌氨酸氧化酶脱辅基蛋白复合的CD分析Fig.7 CD analysis on SOX protein complexed with different natural cofactors
圆二色谱分析脱辅酶蛋白与天然辅基复合后的二级结构特征峰与游离酶相比完整性降低,酶分子内部α-螺旋和β-折叠比例降低,二级结构有所变化,其中添加类似物为FAD与FMN的二级结构峰的完整性没有太大变化,酶活相差不大;而核黄素和未加任何天然辅基的二级结构峰的完整性发生巨大变化,α螺旋和β-折叠比例大幅度降低,酶活相差比较大,说明酶的二级结构遭到破坏,SOX酶分子处于变性状态。
2.2.2 FTIR分析SOX复合度的变化采用FTIR分析不同天然辅基与肌氨酸氧化酶脱辅基蛋白复合前后其官能团的变化,判断不同天然辅基与脱辅基蛋白的复合是否成功。不同天然辅基与酶复合的红外光谱图谱见图8。
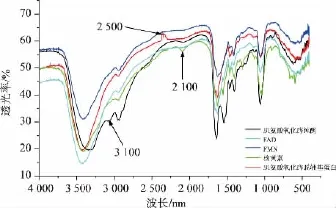
图8 不同天然辅基与肌氨酸氧化酶脱辅基蛋白复合的FTIR分析Fig.8 FTIR analysisofdifferentnaturalcofactor complexed with SOX apoprotein
由图8,未添加任何配体的SOX分子中2 500 cm-1左右处出现巯基(-SH)伸缩振动峰,该特征峰在经过复性后明显增强,说明无辅基酶分子中可能生成另一个二硫键,使酶分子结构发生改变,复性未成功[15];添加FAD与FMN作为配体的酶分子波峰结构未发生比较大的变化,辅基的加入促进了酶的正确折叠,结合酶活可证明FAD作为辅基与SOX复性成功,而FMN与脱辅基蛋白不能很好的结合,复性不完全。核黄素在2 100 cm-1左右处出现羧基(—COO—)中C=O伸缩振动峰,此特征峰强度在复合酶中明显降低,说明羧基载体中羧基含量降低,稳定性下降。3 100 cm-1是NH伸缩振动,此特征峰强度在复合酶中明显降低,说明氨基载体中氨基含量降低,结合酶活显示只能少部分复性成功。
2.2.3 DSC分析比较SOX游离酶与复性酶的热变性利用DSC技术,分析SOX游离酶与复性酶其热变性温度Tm的变化,分析两者的结构稳定性。
如图9所示,游离酶和复性酶出现了单一的吸热峰,该吸热峰则表示分子在升温过程中构象改变伴随着能量变化。游离酶和修饰酶的热变性温度Tm分别为64.03℃和44.6℃,相同的升温速率,复性酶的Tm值比游离酶大约降低20℃;与游离酶相比,瓦解复性酶的天然结构要花费更少的能量;两者数据表示,复性后的SOX酶分子变得不稳定,容易受外界影响。

图9 游离酶与重构酶的DSC分析Fig.9 DSC thermograms of SOX without cofactor and SOX refolded
3 结 语
作者利用不含辅因子的肌氨酸氧化酶(SOX)包涵体,通过透析复性处理,确定了较为合适的条件:酶蛋白质质量浓度为0.3 g/L,透析液pH为8.5时,温度 4℃,最佳的氧化还原态(GSH/GSSG)GSH/GSSG值为2,以及复性时间为24 h时,SOX酶蛋白的复性效果相对较好。
研究进一步比较了各种天然辅基与SOX酶蛋白的复合,发现外加FAD(非共价的情况下)与脱辅酶蛋白复合后,酶活性高;二级结构与原酶接近,酶活是原酶的50%;与原酶的α-螺旋与β-折叠的二级结构相似度达80%。FMN的效果次之,酶活是原酶的30%,α-螺旋与β-折叠的二级结构相似度为50%;而加入核黄素后SOX酶分子处于变性状态,其对SOX酶的复性和酶活皆为负影响。

