结直肠癌中GLUT-1、HIF-1α表达的临床意义
武雪亮,王立坤,周海丰,郭 飞,杨永江,刘 博,杨东东,屈 明,薛 军
据GLOBOCAN 2012统计中国人群结直肠癌目前排位死因顺位从第7位上升到第5位,男女死亡率分别为9.0/10万和6.1/10万,严重威胁国民健康[1]。尽管近年来结直肠癌的普查力度不断加强、手术方式不断改进、靶向药物大力推广,并取得了一系列的突破,但其5年生存率不足60%,仍是公共卫生的关键问题[2]。因此,对结肠直肠癌的深入研究尤对其分子生物学研究具有很高的临床价值。GLUT-1(glucose transporter,GLUT-1)是葡萄糖转运蛋白家族中最重要的成员,广泛存在于真核生物和原核生物中,在肿瘤早期生长,癌症转移和侵袭等方面均具有重要作用。相关报道证实,在乳腺癌、食管癌、肝癌等肿瘤细胞内均发现GLUT-1的高表达,GLUT-1的活性和表达水平与肿瘤的恶性生物学行为密切相关[3-5]。目前,GLUT-1在结直肠癌方面的研究鲜有报道,该研究通过对结直肠癌和正常结直肠组织行免疫组织化学染色分析检测,旨在探讨GLUT-1在结直肠癌中的表达情况及与相关临床病理因素间的关系,为结直肠癌靶向诊疗提供科学参考。
1 材料与方法
1.1病例资料收集河北北方学院附属第一医院普通外科2016年9月~2017年1月手术切除的结直肠癌组织50例和正常结直肠的组织50例,结直肠的癌组织自癌灶中心处取得,另外取经病理证实为正常肠组织的标本切缘。所有病例为原发性肿瘤,术前没有行针对性治疗,如新辅助放化疗等,术后标本均在1 h内获得,并存于液氮中。
1.2主要试剂和实验方法
1.2.1主要试剂 兔抗GLUT-1多克隆抗体、鼠抗人HIF-1α(hypoxia inducible factor-1α,HIF-1α)单克隆抗体购自美国Abeam公司;免疫组化试剂盒、DAB显色剂购自上海Gene Tech公司。
1.2.2免疫组织化学染色 10%的甲醛溶液固定,石蜡包埋,切片厚度4 μm,应用苏木精-伊红染色,行病理诊断。用80 ℃烤箱对切片进行烘烤30 min,再用乙醇进行脱水,并使内源性过氧化物酶灭活,应用枸橼酸缓冲液行高温高压水化修复过程;之后PBS洗3次,加入一抗(1 ∶100)50 μl,温度控制于4 ℃一夜;再用PBS洗3次,加入二抗50 μl。室温下DAB显色,PBS洗3次,苏木精轻度复染,盐酸乙醇分化后流动清水冲洗10 min,梯度乙醇脱水,松节油透明和树胶行封片处理,PBS代替一抗作为阴性对照,光镜下观察。
1.2.3阳性结果判定标准[6]GLUT-1阳性染色主要集中于细胞质中,少量表达于细胞核,HIF-1α阳性染色主要集中于细胞核,少量表达于细胞质,均为棕黄色或褐色颗粒,计算阳性细胞百分比并评分,≤5%为0分,6%~25%为1分,26%~50%时为2分,51%~75%时为3分,>75%时为4分;同理,无着色为0分,浅黄色为1分,黄色为2分,深黄色为3分。然后两组相乘,0分:-,1~4分:+,5~8分:,9~12分:,阳性包含+~。
1.3统计学处理应用SPSS 17.0软件进行分析,计数资料以百分率表示,GLUT-1和HIF-1α的表达与临床病理参数的关系应用χ2检验进行分析,采用Pearson法进行相关性分析,检验水准设α=0.05。
2 结果
2.1结直肠癌、正常组织中GLUT-1和HIF-1α表达情况癌组和正常组织中GLUT-1阳性表达率分别为68.00%(34/50)、16.00%(8/50),组间差异有统计学意义(P<0.05);癌组和正常组织中HIF-1α阳性表达率分别为72.00%(36/50)、20.00%(10/50),组间差异有统计学意义(P<0.001),见图1、表1。
2.2GLUT-1和HIF-1α表达与结直肠癌临床病理特征的关系GLUT-1和HIF-1α的表达都和肿瘤的浸润深度、分化程度、TNM分期、淋巴转移、肝转移和脉管浸润有关(P<0.05)。TNM分期高、分化程度越低、伴淋巴结转移、肝转移和脉管浸润的患者GLUT-1和HIF-1α的表达均增强,而GLUT-1和HIF-1α的阳性表达与患者肿瘤大小无相关性(P>0.05),见表2。
2.3GLUT-1和HIF-1α在结直肠癌中表达的相互关系GLUT-1和HIF-1α在结直肠癌中的表达明显相关(r=0.508,P<0.001)。GLUT-1在HIF-1α阳性组中的表达(阳性率80.56%)明显高于在HIF-1α阴性组中的表达(阳性率35.71%),差异有统计学意义(P<0.001),见表3。
3 讨论
结直肠癌的发生、发展是多个基因调控的多步骤、多因素、多阶段的复杂过程,其中失控性生长和不断侵袭增殖是恶性肿瘤细胞的最主要特征,这种特征的维系主要靠葡萄糖的无氧酵解为其提供能量,该过程即使在氧充足的环境下仍可持续进行[7]。由于肿瘤的高消耗、高代谢,需要较普通细胞成倍的能量。而正常情况下,葡萄糖无法独立通过细胞膜的双分子层结构,必须依赖跨膜分布的葡萄糖转运蛋白作为载体,因而这类载体的活性及表达量对肿瘤细胞的恶性增殖具有极其重要的意义[8]。
GLUT-1是葡萄糖转运蛋白最重要的成员,GLUT-1内含492个氨基酸,由12个疏水性的跨膜α螺旋结构域、两个电荷的膜内区及膜外区构成[9]。Deng et al[10]解析的人源GLUT-1的晶体结构显示其经典的协助转运超家族的折叠方式:12个跨膜螺旋组成NH2-端和-OOH端2个结构域,其中的腔孔呈向胞内区展开,这即是其转运的基础框架。
肿瘤细胞膜上的GLUT-1的表达受多种途径调节,目前研究较多的有磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(AKT)/雷帕霉素靶蛋白(mTOR)途径和HIF-1α和p53途径,PI3K/AKT/mTOR与癌细胞的增殖、微血管形成和转移蛋白的合成关系密切,且需要大量能量供应,在肝癌、胃癌、子宫癌等肿瘤细胞中均证实能上调GLUT-1的表达[11]。
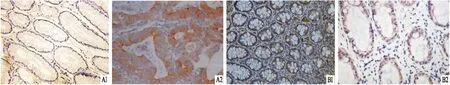
图1 结直肠正常组织和癌组织中GLUT-1、HIF-1α蛋白的表达 SP×200 A:GLUT-1;B:HIF-1α;1:正常组织;2:结直肠癌组织

组别nGLUT-1/HIF-1α (n)-+阳性率(%)χ2值P值结直肠癌5016/149/811/1214/1668.00/72.0016.386/14.438<0.001/<0.001正常5042/404/62/32/116.00/20.00
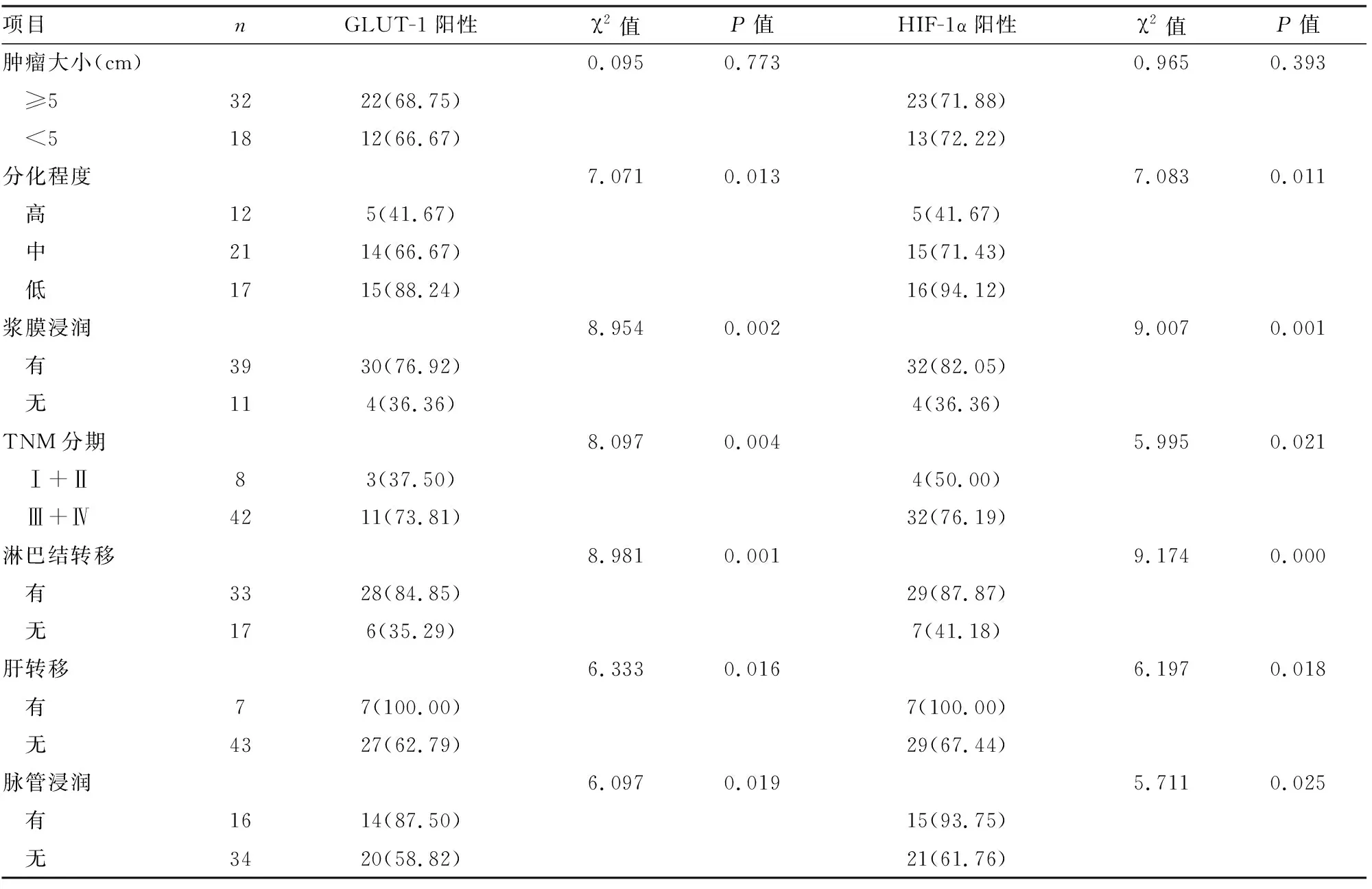
表2 GLUT-1和HIF-1α在结直肠癌组织中的表达及与临床病理因素的关系[n(%)]

表3 GLUT-1和HIF-1α在结直肠癌组织中表达的相关性(n)
本研究显示GLUT-1和HIF-1α在正常肠黏膜和腺癌中的表达水平逐步上升,差异有统计学意义,表明在肠黏膜癌变的过程中,细胞膜上的GLUT-1和HIF-1α水平不断上调,从而确保肿瘤对能量的摄取。进一步研究显示,GLUT-1和HIF-1α表达水平与结直肠癌的病理分期、浸润深度、分化程度、淋巴结转移、肝转移和脉管浸润均明显相关,且二者存在明显相关性。HIF-1α是调控癌细胞对低氧耐受的关键蛋白,研究[12]表明,在肝癌细胞内,HIF-1α能直接激活GLUT-1等糖酵解相关因子活性,从而满足肝癌细胞的能量摄取,增强其对低氧的耐受力。在胃肿瘤体外培养的细胞内,低氧条件下应用HIF-1α抑制剂处理后,癌细胞内活性氧比例更高,凋亡更显著[13]。杨通印 等[14]对142结直肠癌组织标本行免疫组化检测发现GLUT-1和HIF-1α表达明显高于正常肠黏膜,且二者存在协同作用,在低氧环境下,HIF-1α表达上调能诱导GLUT-1高表达,加速癌细胞糖酵解,促进癌细胞浸润和转移。
综上,GLUT-1异常表达对结直肠癌的发生和进展有重要作用,深入探究GLUT-1和HIF-1α的作用机制有望为结直肠癌精确治疗提供重要的理论依据。

