人参皂苷CK活化糖皮质激素受体抑制佐剂型关节炎大鼠T细胞活化
司 敏,陈镜宇,马 旸,常 艳,魏 伟
类风湿性关节炎(rheumatoid arthritis,RA)是以关节的滑膜炎症为特征的慢性全身性自身免疫性疾病[1]。T细胞与RA的发生密切相关,大量的研究[2-5]表明活化的T细胞是RA免疫紊乱和关节损伤的主要诱导因子。大量过度激活的T细胞浸润关节滑膜,与滑膜细胞、免疫细胞相互活化,引起关节滑膜炎症和关节软骨和骨质破坏。人参皂苷CK为人参皂苷在人肠道内的主要降解产物,是人参皂苷在体内吸收和发挥活性作用的主要形式[6]。前期研究[7-9]显示CK对佐剂性关节炎(adjuvant-induced arthritis,AA)大鼠和胶原性关节炎(collagen-induced arthritis,CIA)小鼠T细胞异常的活化有抑制作用,CK可以下调共刺激分子CD28和T细胞受体(T cell receptor,TCR),上调共抑制分子细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)和程序性死亡受体1 (programmed cell death protein1,PD-1),上调初始T细胞数量;减少T细胞表面CD25的表达和IL-2的分泌,下调活化T细胞数量;抑制活化的T细胞增殖与效应T细胞分化,同时上调Treg的数量;CK可以减少T细胞活化的共刺激信号,抑制T细胞的活化。但是这种抑制作用的作用机制和作用靶点仍不清楚。有文献[10]报道CK具有与甾体类激素相似的化学结构,CK可与地塞米松竞争性结合激动糖皮质激素受体(glucocorticoid receptor,GR),CK对免疫细胞的作用是否与活化GR有关仍不清楚。该研究采用GR拮抗剂,对CK抑制AA大鼠T细胞过度活化的作用机制进行探讨。
1 材料与方法
1.1材料
1.1.1实验动物 雄性Sprague-Dawley (SD)大鼠,体质量(150±20) g,购自安徽省实验动物中心,许可证编号:SCXK(皖)2011-002。实验中涉及的动物实验方案均经安徽医科大学临床药理研究所动物伦理委员会批准。
1.1.2药物和试剂 人参皂苷CK(分子量622.18,批号:S141001)购自浙江海正药业有限公司;糖皮质激素受体拮抗剂(RU486)、地塞米松(Dexamethasone)购自美国Sigma公司;DMEM、1640培养基购自美国BI公司;抗CD25、CD40、CD80、CD86、MHCⅡ流式抗体(美国BD公司);IL-4、GM-CSF(美国Peprotech公司);CCK8试剂盒(日本同仁公司)。
1.1.3主要实验仪器 IX-40倒置显微镜(日本OLYMPUS公司);Tecan Infinite M1000 PRO酶标仪(瑞士Tecan公司);SW-CJ-1F超净工作台(苏州苏净集团安泰公司);KDC-40超速离心机(科大创新中佳公司);2306-2型CO2培养箱(美国SHEL LAB公司);GL20A全自动高速冷冻离心机(湖南仪器仪表总厂离心机厂);-80 ℃超低温冰箱(美国Advantage公司)。
1.2实验方法
1.2.1制备AA大鼠模型 将10 mg/ml完全弗氏佐剂(Freund's complete adjuvant,CFA)充分混匀,于每只大鼠右后足跖皮内注射CFA 0.1 ml致炎,得AA大鼠模型。正常组同法注射生理盐水。
1.2.2T细胞增殖检测 无菌取大鼠胸腺,常规方法制备正常和AA大鼠T淋巴细胞悬液(1×107/ml),分别将细胞铺于96孔板中,每孔加入50 μl细胞悬液,AA大鼠的T淋巴细胞用不同浓度的CK(1 nmol/L、10 nmol/L、100 nmol/L、1 μmol/L、10 μmol/L)以及糖皮质激素受体(GR)拮抗剂(RU486 10 μmol/L)预处理后加ConA(终浓度5 mg/L),终体积为100 μl,设复孔,37 ℃、5% CO2培养箱中培养48 h,诱导T淋巴细胞增殖。终止培养前3 h,每孔加入10 μl CCK,酶标仪检测450 nm吸光度值。
1.2.3T细胞的纯化 正常大鼠和AA大鼠处死后,剪下大鼠的脾脏,进行破碎处理并使用 70 μm的尼龙网获得脾脏的单细胞悬液,室温静置2 min以除去其中的血红细胞。细胞用磷酸盐缓冲液(phosphate buffer saline,PBS)洗2遍并离心(1 500 r/min,8 min)。弃去上清液并重悬于10%胎牛血清(FBS)RPMI-1640中以调节细胞浓度至2×108/ml。细胞通过尼龙柱分选T淋巴细胞。将超净台内垂直固定的尼龙柱下端连接变速开关,加20 ml预热的无血清RPMI-1640平衡,之后加预热的15 ml含5%FBS的RPMI-1640平衡。关闭开关,加入2 ml以上制备好的细胞悬液,慢慢打开开关,待细胞悬液全部进入尼龙柱,关闭开关,加入1 ml含5%FBS的RPMI-1640,盖上无菌容器,37 ℃孵育60 min。温育结束后,打开开关,加入20 ml预热的5%FBS的RPMI-1640,通过重力作用洗脱柱中的细胞,收集流出的细胞即为T细胞(回收率约为20%)。用含20%胎牛血清的DMEM培养液制备细胞悬液(1×106细胞/ml),备用。
1.2.4成纤维细胞样滑膜细胞(fibroblast-like synoviocytes,FLS)的培养 AA大鼠处死,在0.1%苯扎溴铵溶液中浸泡5 min灭菌。在膝关节纵行切开皮肤,肌肉、关节囊滑膜和纤维层分离,暴露出滑膜组织。无菌取双侧膝关节滑膜组织,剔除脂肪和纤维,用含双抗(100 IU/ml青霉素,100 IU/ml链霉素)的PBS反复冲洗后切成1~2 mm3小块,均匀排列在细胞培养瓶底壁(用含有20% FBS的DMEM培养基预先润湿),将培养瓶底部向上在5% CO2培养箱中于37 ℃温育3 h。待细胞黏附在壁上后,轻轻将培养瓶翻正(底部向下),培养基刚刚覆盖组织块,每隔2~3 d换1次培养基,观察培养基颜色和细胞形态的变化,得到大量的成纤维细胞后轻轻去除组织块,继续培养至细胞生长至80%左右,用含乙二胺四乙酸(EDTA)的0.25%胰蛋白酶消化细胞并传代培养,取第3代FLS进行实验。
1.2.5树突状细胞(dendritic cell,DC)培养 取正常大鼠和AA大鼠股骨及胫骨,在超净台中将两端骨骺剪去暴露出骨髓腔,RPMI-1640培养基洗涤骨髓腔,过200目纱网,离心收集骨髓细胞,接种于6孔板(2×106个细胞/孔),将6孔板在培养箱温育2~3 h后弃去上清液。沿着壁缓慢加入2 ml含10%FBS的RPMI-1640培养基,AA大鼠骨髓细胞中加入细胞因子GM-CSF和IL-4终浓度均为20 ng/ml,置于培养箱中继续培养; 48 h后半量换液,并加入足量的细胞因子。第6天收集悬浮细胞作为未成熟DC,并用脂多糖(LPS)(终浓度100 ng/ml)刺激24 h。第7天收集的细胞为成熟的DC。
1.2.6DC成熟试验 AADC中加入CK(1 μmol/L)和RU486(10 μmol/L),在培养箱中培养24 h后,加入抗CD40、CD80、CD86和MHCⅡ荧光抗体,并设同型对照组。贝克曼(Beckman)流式细胞仪检测这些分子的表达以反映DC的成熟。
1.2.7T细胞与FLS共培养 AA大鼠FLS加入CK(1 μmol/L)以及RU486(10 μmol/L)预处理6 h,收集细胞,离心(2 000 r/min,10 min),以300 μl DMEM培养液重悬,与正常大鼠T细胞共培养,FLS ∶T细胞的数量为1 ∶20,Beckman流式细胞仪检测T细胞表面CD25的表达,并设同型对照组。
1.2.8T细胞和DC共培养 用CK(1 μmol/L)和RU486(10 μmol/L)预处理AA大鼠的DC,与正常大鼠T细胞共培养,按DC ∶T细胞的数量为1 ∶20。Beckman流式细胞仪检测T细胞表面CD25的表达,反映DC活化T细胞能力,并设同型对照组。
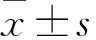
2 结果
2.1CK对ConA诱导的AA大鼠T细胞增殖的影响ConA诱导的AA大鼠T细胞增殖反应(0.636±0.175)较正常大鼠T细胞增殖反应(0.477±0.042)明显增高。CK(10 nmol/L、100 nmol/L、1 μmol/L、10 μmol/L)体外给药能明显抑制AA大鼠T细胞的增殖,GR拮抗剂RU486(10 μmol/L)可以阻断CK(10 、100 nmol/L)的作用,各组间差异有统计学意义(F=2.19,P<0.05),提示CK对T细胞增殖的抑制作用可能与GR的活化有关;然而,GR拮抗剂RU486(1、10 μmol/L)对CK(1、10 μmol/L)引起的T细胞的增殖的抑制作用没有影响,提示除了活化GR以外,高浓度的CK可能还通过其他途径抑制T细胞的增殖(图1)。
2.2CK对AA大鼠FLS诱导T细胞活化的影响AA大鼠FLS与分离纯化的正常T细胞进行共培养,流式结果显示T细胞表面CD25的表达增加(3 396.5±144.957),AA大鼠FLS加入CK(1 μmol/L)后与分离纯化的T细胞进行共培养,结果显示T细胞表面CD25的表达明显减少(2 889.6±214.183),而GR拮抗剂RU486(10 μmol/L)可以阻断CK对T细胞活化的抑制作用(3 435.3±271.482),各组间差异有统计学意义(F=2.19,P<0.05)(图2)。
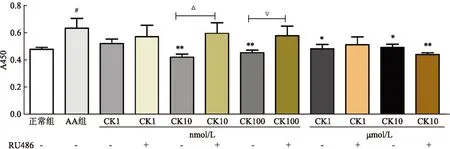
图1 CK对AA大鼠T细胞增殖的影响
与正常组比较:#P<0.05;与AA组比较:*P<0.05,**P<0.01;与CK 10 nmol/L组比较:ΔP<0.05;与CK 100 nmol/L组比较:▽P<0.05
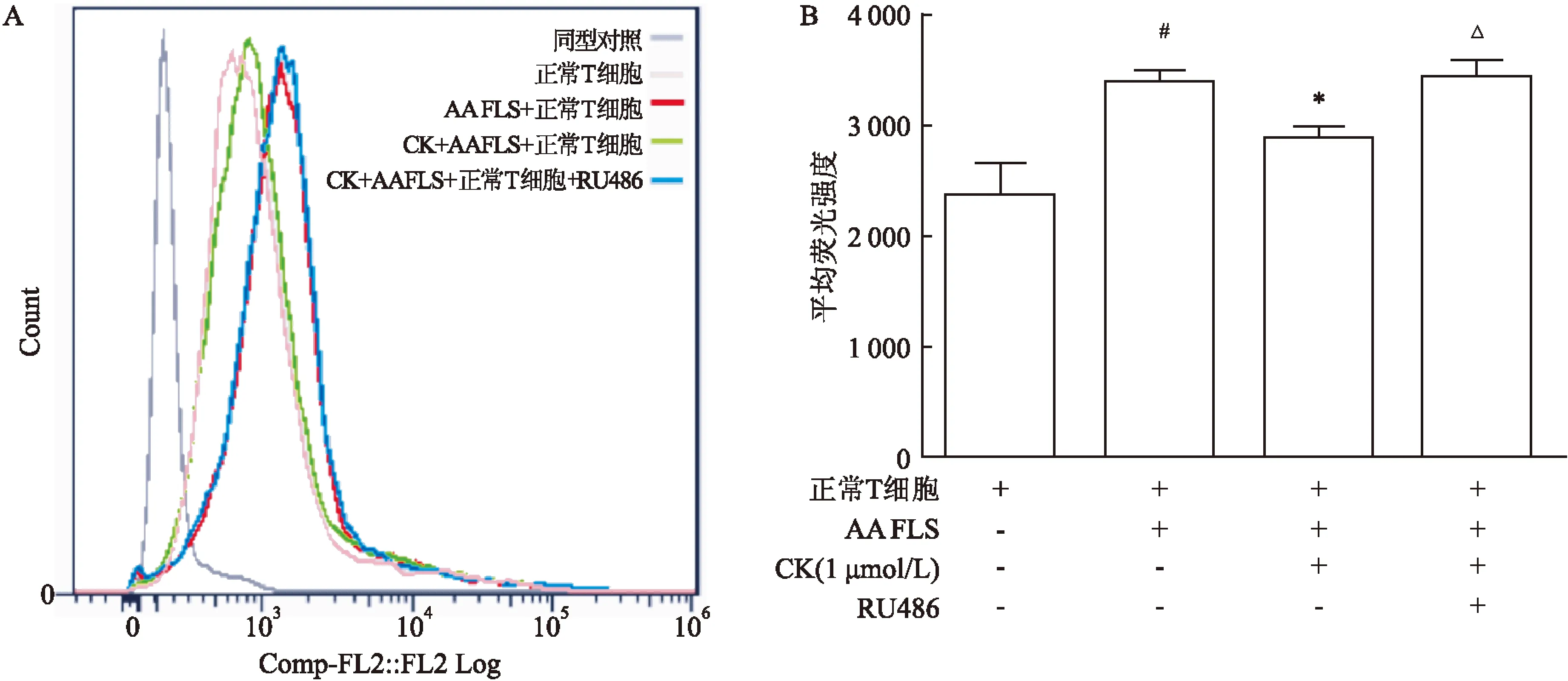
图2 CK对AA大鼠滑膜细胞诱导正常T细胞活化的影响
A:流式细胞术测定T细胞表面CD25;B:各组平均荧光强度;与正常T细胞比较:#P<0.05;与AA FLS+正常T细胞比较:*P<0.05;与CK+AA FLS+正常T细胞比较:ΔP<0.05
图3CK对AA大鼠DC细胞诱导正常大鼠T细胞活化的影响
A:CK对DC诱导的T细胞增殖作用的影响;B:流式细胞术测定T细胞表面CD25;C:各组平均荧光强度;与正常T细胞比较:#P<0.05,##P<0.01;与AA DC+正常T细胞比较:*P<0.05;与CK+AA DC +正常T细胞比较:ΔP<0.05
2.3CK对AA大鼠DC细胞诱导的大鼠T细胞活化的影响AA大鼠的DC可以明显促进正常T细胞的增殖,诱导T细胞表面CD25的表达增加(1.317±0.108),CK(1 μmol/L)体外作用于AA大鼠DC后与正常T细胞共培养,可以显著抑制DC诱导的T细胞的增殖作用(1.050 4±0.399),各组间差异有统计学意义(F=7.958,P<0.05),减少DC诱导的T细胞表面CD25的表达,GR拮抗剂RU486(10 μmol/L)可以阻断CK(1 μmol/L)对DC诱导的T细胞的抑制作用(1.317±0.137),各组间差异有统计学意义(F=8.311,P<0.05)(图3)。CK(1 μmol/L)体外给药能明显抑制AA大鼠DC细胞表面分子(CD40、CD80、CD86、MHCⅡ)的表达,GR拮抗剂RU486(10 μmol/L)可以阻断CK(1 μmol/L)对上述分子(CD40、CD86)表达的抑制作用,各组间差异有统计学意义(CD40:F=15.123,P<0.05;CD86:F=22.624,P<0.05)(图4)。
3 讨论
人参皂苷是人参成分中最有效的药用成分,按照骨架类型可分达玛烷型(包括原人参二醇型和原人参三醇型皂苷)和齐墩果型皂苷(R0、Rh3)两种。研究[11-14]显示这些人参皂苷单体的抗炎作用与核受体及其介导的信号有关,包括过氧化物酶体增殖物激活受体、雌激素受体、GR、肝X受体、孤儿受体等,这些核受体与炎症和免疫密切相关,已经成为治疗炎症免疫性疾病的靶点。
糖皮质激素具有广泛的免疫抑制作用,可以通过多种免疫细胞发挥其免疫抑制作用,抑制效应T细胞的分化活化;提高Treg的数量,促进其功能;减少粒细胞数量;抑制树突细胞的分化以及炎性细胞因子的分泌;抑制巨噬细胞分泌;抑制B细胞分泌抗体。糖皮质激素具有强大的抗炎作用而被用于治疗炎症性疾病,也包括用于RA的治疗[15]。糖皮质激素通过与GR结合、激活GR,GR进入细胞核内,通过结合靶基因序列,调节基因转录,还可以与胞质蛋白发生相互作用,发挥信号转导功能。CK在结构上具有类似糖皮质激素样的甾环结构,其抗炎免疫调节作用是否与核受体及其介导的信号有关?有文献报道[10],CK可以与GR结合,诱导GR的活化。为了验证GR是否是CK作用的靶点,本研究利用GR的拮抗剂RU486对滑膜细胞、T细胞、DC细胞进行了探讨。
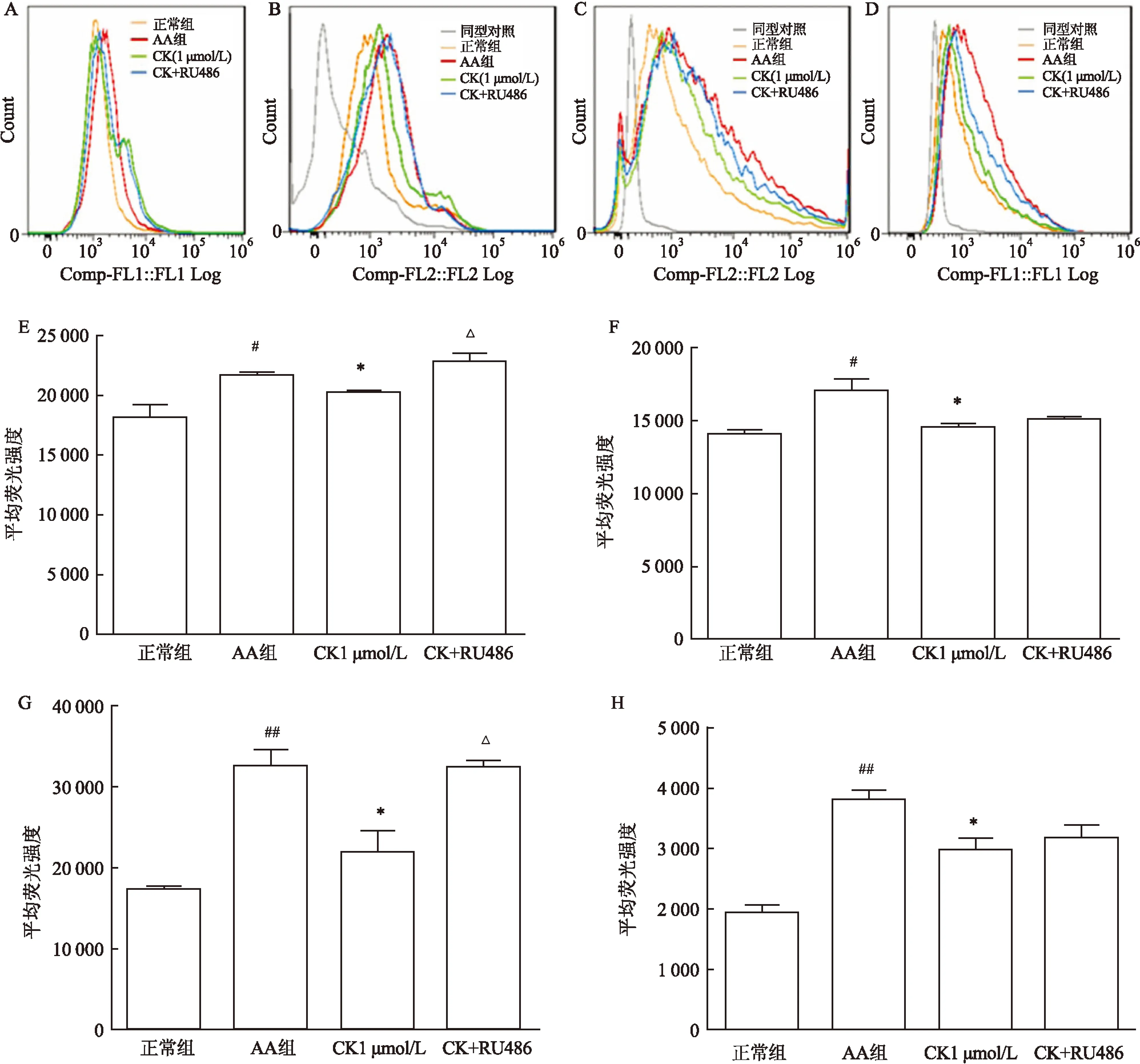
图4 CK对DC细胞成熟的影响
A、B、C、D:分别为流式细胞术测定DC细胞表面分子CD40、CD80、CD86、MHCⅡ的表达; E、F、G、H:分别为CD40、CD80、CD86、MHCⅡ平均荧光强度;与正常组比较:#P<0.05,##P<0.01;与AA组比较:*P<0.05;与CK 1 μmol/L组比较:ΔP<0.05
T细胞的异常激活是RA免疫异常的关键环节。T细胞活化、分化成效应T细胞,导致滑膜细胞的增殖以及骨质破坏。前期研究[7-9]已经显示CK对AA和CIA异常的T细胞增殖和活化有抑制作用,CK可以下调共刺激分子CD28和TCR,上调共抑制分子CTLA4和PD1,减少T细胞表面CD25的表达和IL2的分泌;上调初始T细胞数量,下调活化T细胞数量,同时上调Treg的数量。而且CK可以减少CCL21/CCR7介导的DC向淋巴结的迁移,减少DC提供的T细胞活化的共刺激信号,抑制T细胞的活化。本研究表明CK对AA异常的T细胞增殖的抑制作用,对T细胞表面活化分子CD25的表达的抑制作用,都可以被GR拮抗剂RU486阻断,这些结果提示CK对T细胞活化的抑制作用与活化GR有关,可能是GR依赖的。而且CK可以通过抑制FLS与T细胞的相互作用以及DC与T细胞的相互作用,从而抑制FLS或者DC诱导的T细胞活化,而且此作用与活化FLS以及DC的GR有关。
综上所述,CK可能通过多个环节发挥对T细胞活化的抑制作用,包括直接抑制T细胞的活化,以及抑制FLS和DC对T细胞的活化,CK的这些作用与GR的活化有关,GR可能是CK发挥作用的靶点。本研究显示GR拮抗剂RU486对高浓度CK(10 μmol/L)引起的T细胞的增殖的抑制作用没有影响,提示除了活化GR以外,高浓度的CK可能还通过其他途径抑制T细胞的增殖。除GR以外,许多核受体与炎症和免疫的密切相关,已经成为治疗炎症免疫性疾病的靶点。这些核受体包括过氧化物增殖酶激活受体、肝X受体、雌激素受体、孤儿受体等。研究[11-14]显示一些人参皂苷单体Rb1、Re、Rf、Rg1、Rh1、Rh2、Rg3的抗炎作用与过氧化物酶体增殖物激活受体、雌激素受体、GR相关。CK作为人参人肠道内的主要降解产物,除了活化GR之外,是否也能通过其他核受体发挥作用,仍需要进一步的研究。

