阿托伐他汀与人血清白蛋白相互作用机制的研究
董 哲,李 阳,谢立娟,刘宗瑞
阿托伐他汀(atorvastatin)通用商品名为立普妥(Lipitor),是由美国辉瑞公司研发的降脂药[1]。分子内的3-羟基己内酯与HMG-CoA还原酶的底物具有类似的结构,可以作为高选择性和竞争性的抑制剂[2]。其进入体内无需代谢即可发挥作用,具有见效快、消除半衰期长、代谢慢和降脂作用强等特点[3]。众所周知,药物从给药部位吸收进入人体,通过血液由循环系统运送至体内各脏器组织中,经过不同酶的代谢后排出体外,那么血液就成为体内药物转运的枢纽[4]。血液中含量约占60%的蛋白质是人血清白蛋白(human serum albumin,HSA),有助于携带、转化和转运多种内源或外源性物质,如调节血浆中的血渗值和pH值,减少体内自由基等生理功能[5]。一般来说,血清白蛋白和药物之间的结合作用较强,血浆中游离药物浓度就会较低;而血清白蛋白与药物的结合作用较弱,则可能会导致药物在体内消除时间较快和停留时间较短[6]。药物在体内的转运、分布和代谢过程中血清白蛋白都起着关键的生理作用,通过了解它们之间的相互作用机制对探讨药代动力学和药效学也是非常重要的[7-9]。该研究以圆二色谱、荧光光谱、等温滴定量热法以及分子对接模拟方法,详细研究了atorvastatin同HSA相互作用的过程,希望能为进一步阐明小分子他汀类药物在体内的转运过程以及作用机制提供基础研究数据。
1 材料与方法
1.1仪器与试剂圆二色谱仪(Jasco J-810,日本分光株式会社);荧光分光光度计(970CRT,上海精科);等温量热滴定仪(Micro CalTMITC200,美国马尔文公司);集热式恒温加热磁力搅拌器(DF-101,金坛区岸头林丰实验仪器厂);超声波清洗器(KQ-500B型,昆山超声仪器有限公司)。HSA(纯度大于98.0%)购自长春鼎国生物技术有限责任公司;atorvastatin购自阿拉丁(aladdin)试剂中国有限公司;实验用水均为二次蒸馏水。
1.2实验方法
1.2.1圆二色谱的测定 在25 ℃下,以Tris-HCl缓冲溶液为参比溶液,测定HSA和atorvastatin溶液的圆二色谱,扫描范围190~250 nm,分辨率为0.5 nm,响应时间为0.25 s。蛋白质的二级结构含量是通过CD pro软件计算得到。
1.2.2荧光光谱的测定 在Tris-HCl缓冲溶液中配制一系列含有不同atorvastatin浓度的HSA溶液于石英比色皿中(其中HSA浓度为1.5×10-6mol/L),摇匀,静置5 min后,25 ℃下扫描荧光光谱,激发波长280 nm,扫描范围300~500 nm处的荧光强度。在测定时,以0.02 mol/L 的Tris-HCl缓冲溶液进行荧光校正。
1.2.3等温滴定量热的测定 在仪器达到设定温度后,将经过超声处理后的atorvastatin药品溶液作为配体装入到注射器(syringe)中,将HSA 溶液装入到样品池(sample cell)中,搅拌器的转速为1 000 r/min。实验开始后,每间隔3 s会把等量的1.5 μl配体溶液滴入到样品池中,参比池中加入蒸馏水作为样品池的热平衡参照。以马尔文公司提供的oirgin7.0软件并根据热力学方程(公式1和2)进行数据处理[10]。在Tris-HCl缓冲溶液中将HSA配制成浓度为10×10-3mol/L的溶液而Catorvastatin=200×10-6mol/L。
ΔG=-RT lnKa
(公式1)
ΔG=ΔH-TΔS
(公式2)
1.2.4分子模拟 HSA晶体三维结构数据(4K2C)文件从Protein Data Bank获取(http://www.rcsb.org/pdb),并使用Autodock Tools 为晶体结构加氢加电荷并确定活性位点残基的质子化状态。atorvastatin 的3D结构数据从PubChem数据库获取(http://pubchem.ncbi.nlm.nih.gov)。使用Sybyl-x2.0软件对蛋白受体和药物配体进行刚性分子对接和收集,选取打分最高的对接结果导入至Ligplot+软件中,进而分析复合物中相关氨基酸残基的信息[11]。
1.3统计学处理实验数据均重复3次,取其平均值。采用Origin 8.5软件进行处理和作图,采用SPSS 15.0统计软件进行Duncan显著性分析,以P<0.05 表示差异有统计学意义。
2 结果
2.1圆二色谱法实验考察了atorvastatin加入对HSA的二级结构的影响。HSA(浓度为1.0×10-6mol/L)在195 nm处为正峰,208 nm和220 nm处为负峰显示了典型α-螺旋的结构,见图1。在温度为25 ℃且pH为7.4的缓冲体系下,随着药物逐渐加入到HSA中,HSA的α-螺旋含量从58.34%(Catorvastatin/CHSA=0)逐渐减少到28.13%(Catorvastatin/CHSA=10.0)。
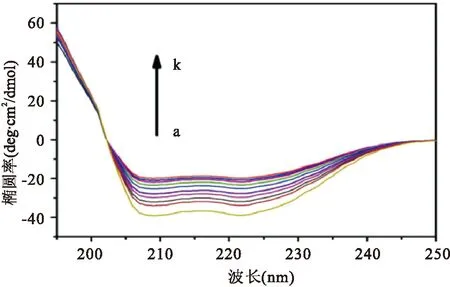
图1 atorvastatin与HSA相互作用的CD光谱图a:Catorvastatin/CHSA=0;k:Catorvastatin/CHSA=10.0
2.2荧光光谱实验HSA中包含色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基可以发射较强的内源性荧光。在温度为25 ℃且pH为7.4的Tris-HCl缓冲体系下,随着atorvastatin逐渐加入到HSA中,发生了显著地荧光淬灭,见图2。在此过程中,最大发射峰位于346 nm且保持不变。
动态淬灭和静态淬灭是造成蛋白质荧光淬灭两种不同方式,根据Stern-Volmer 方程可以确定其荧光淬灭的类型。
F0/F = 1+Kqτ0[Q]=1+Ksv[Q]
(公式3)
τ0为不存在淬灭剂分子时蛋白质分子的平均寿命,约为 5 ns,而各类淬灭剂对生物大分子的最大碰撞淬灭常数为2.0×1010L/(mol·s)。通过 F0/F对加入的atorvastatin总浓度[Q]来作图可获得 atorvastatin与HSA的Stern-Volmer淬灭曲线,见图3;依照公式3进行分析,得到的淬灭常数见表1。
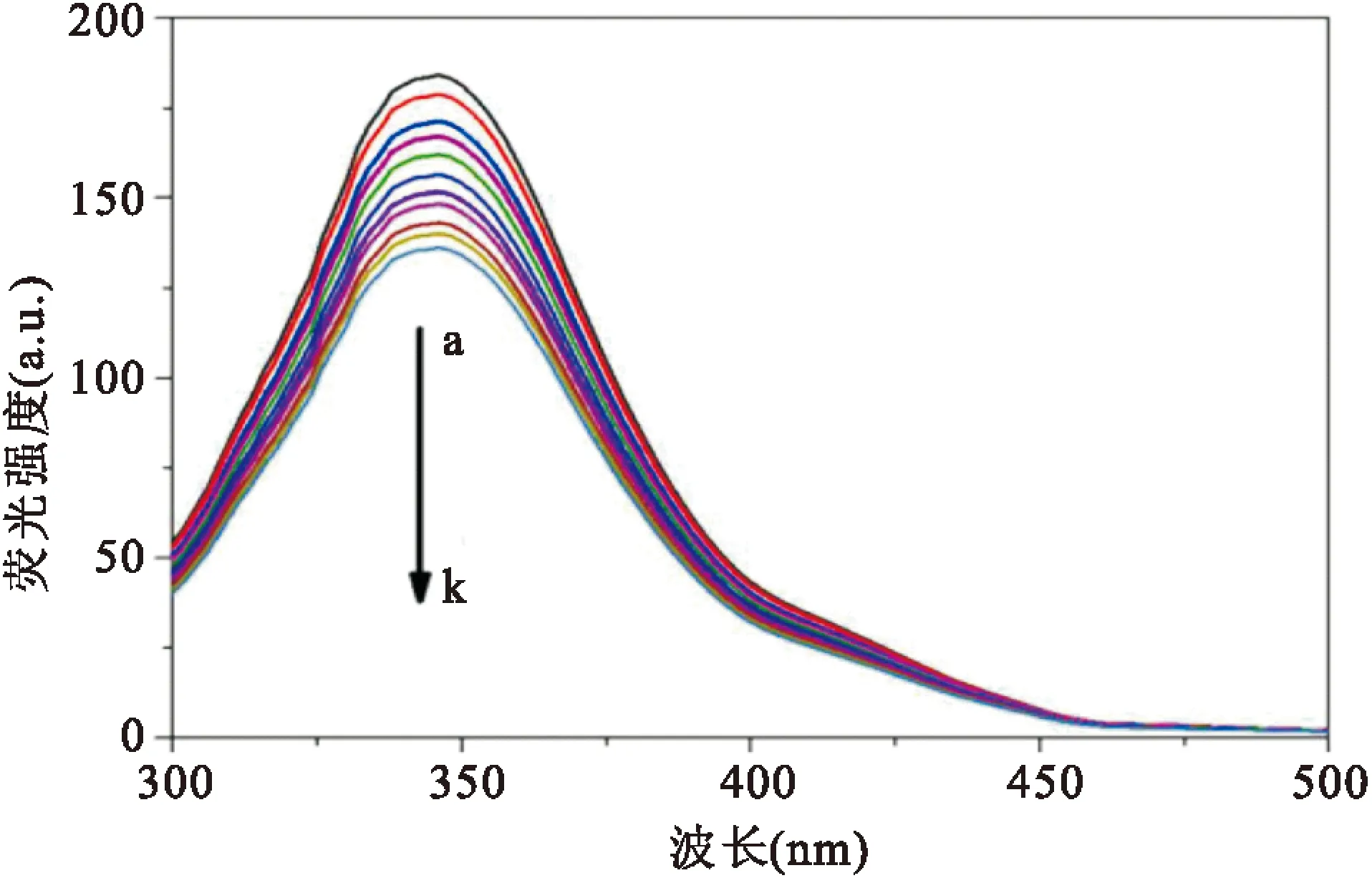
图2 atorvastatin与HSA相互作用的荧光光谱图a:Catorvastatin/CHSA=0;k:Catorvastatin/CHSA=10.0
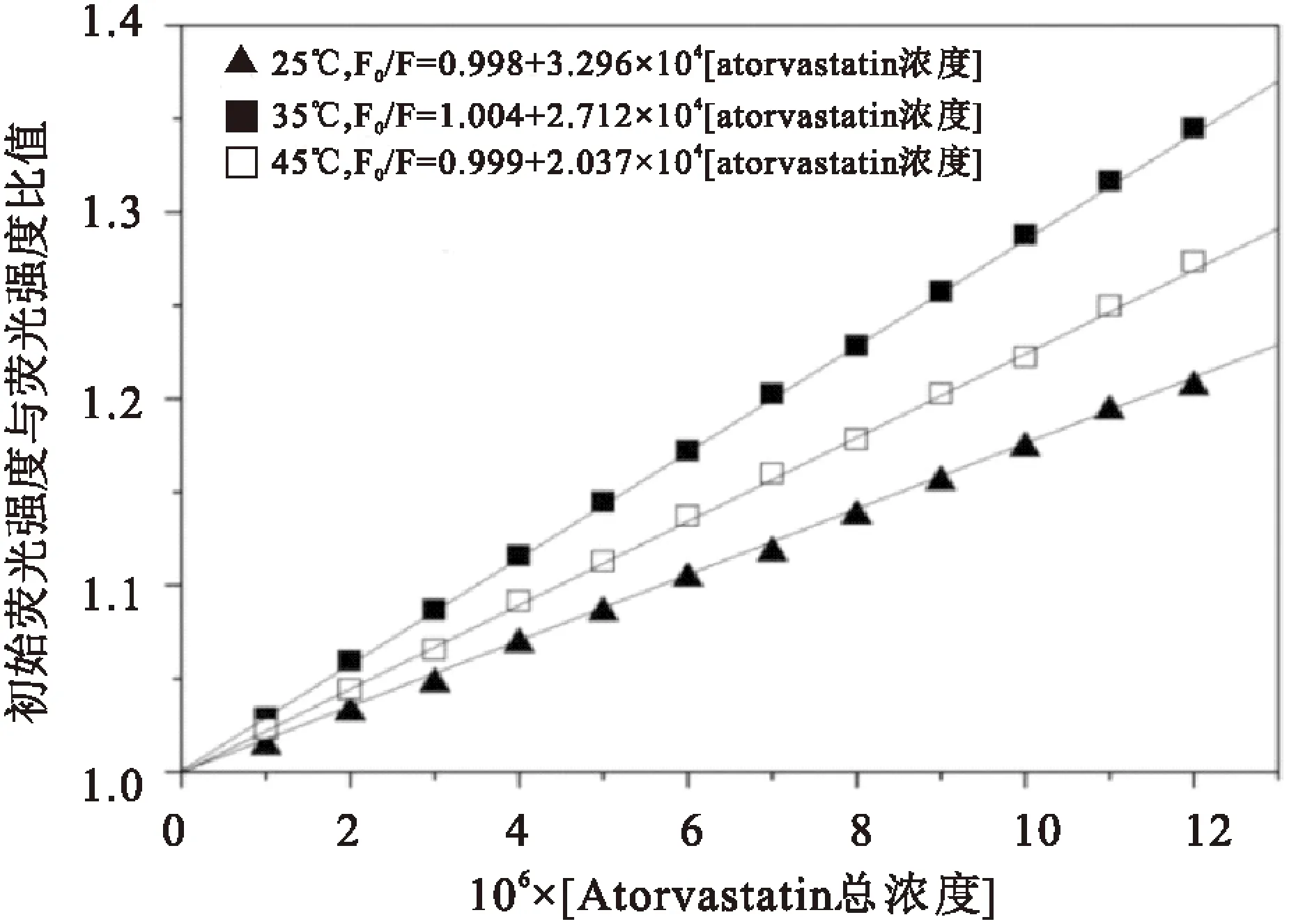
图3 不同温度下atorvastatin与HSA的Stem-Volmer曲线
对于动态淬灭过程属于分子扩散,体系温度升高KSV相应地增大;反之静态淬灭过程随着体系温度升高,基态复合物稳定性下降造成KSV相应地减小。本研究数据显示随着温度由25 ℃升高到45 ℃,然而KSV由3.296降到2.03。另外,Kq值远远大于生物大分子最大的Kq值为2.0×1010L/(mol·s),表明了atorvastatin与HSA不是分子碰撞过程,而是静态淬灭过程生成了不发射荧光的复合物。见表1。
2.3ITC实验在Tris-HCl (20×10-3mol/L,pH 7.4)缓冲液体系中温度为25 ℃时,atorvastatin (200×10-6mol/L)与HSA溶液(10×10-3mol/L)相互作用的情况进行了研究,见图4。通过数据拟合计算,得到了结合位点数(n),结合常数(Ka)和结合过程的焓变ΔH,还通过热力学公式(1和2)计算得到的吉布斯自由能变ΔG和TΔS,见表2。
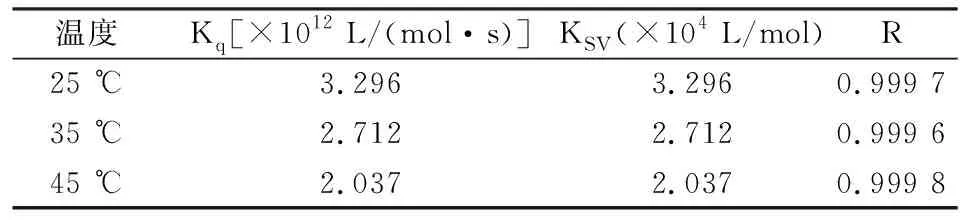
表1 不同温度下atorvastatin与HSA的Stem-Volmer淬灭常数

图4 atorvastatin与HSA的等温滴定量热反应实验
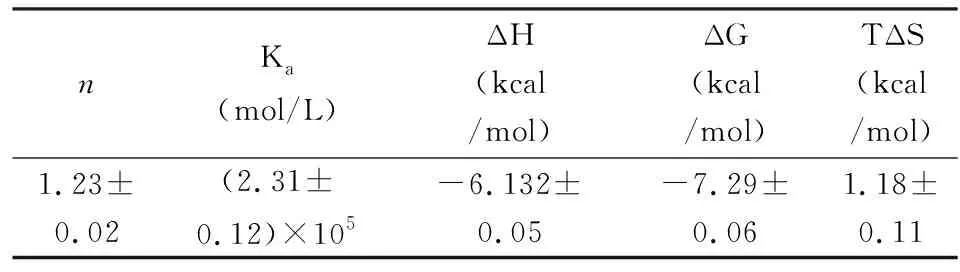
nKa (mol/L)ΔH(kcal/mol)ΔG(kcal/mol)TΔS(kcal/mol)1.23±0.02 (2.31±0.12)×105-6.132±0.05-7.29±0.061.18±0.11
由表2,得到ΔG<0, ΔH<0, TΔS>0,atorvastatin与HSA的结合是自发的熵驱动放热过程。它们间结合常数Ka为2.31×105mol/L,结合位点数为1.18。
2.4分子对接研究为了获得更多的关于atorvastatin与HSA相互作用的信息,采用SYBYL软件对配合物与受体蛋白的识别进行了分子对接研究。HSA是由585氨基酸残基组成,含有3个相似的结构域,分别是Domain Ⅰ (1~195)、Domain Ⅱ(196~383)、Domain Ⅲ (384~585),每个结构域又可分为两个不同的亚结构域(A、B),3个亚结构域构成了疏水性的圆筒状结构。分子对接分析表明药物主要结合在HSA的亚结构域Ⅱ A的表面疏水性空腔中,所拥有的最低能量的优化分子结构图,见图5。
atorvastatin与HSA结合形成复合物后,与周围环境中Lys199、Ala209、Phe211、Trp214、Ala215、Arg218、Leu219、Lys221和Ile233等疏水性氨基酸残基存在氢键作用形成了一个疏水性活性口袋。atorvastatin与Lys199残基间距离为3.12 nm,与Arg218之间距离为2.91 nm,并且与这两个残基之间存在氢键作用。atorvastatin在进入这个疏水口袋后,引起了Trp213残基周围的微环境受到了影响,从而淬灭HSA的荧光发射。见图6。
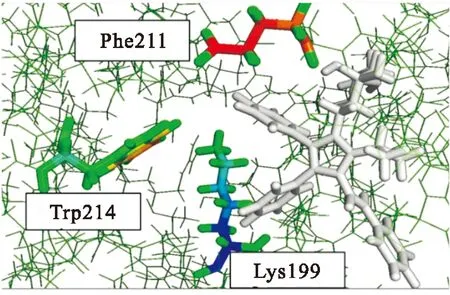
图5 atorvastatin与HSA相互作用的分子模拟对接图
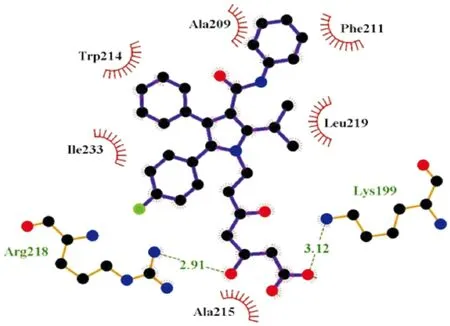
图6 atorvastatin与HSA分子间相互作用网二维图分析
3 讨论
本文采用圆二色谱、荧光光谱、等温滴定微量热法以及分子对接相结合的方法,系统地研究了在模拟人体生理条件(pH 7.4)中HSA与药物小分子(atorvastatin)的相互作用。圆二色谱结果表明在atorvastatin的作用使得血清白蛋白微环境中的某些疏水性氨基酸残基暴露出来,会改变HSA的二级结构,进而影响其生理功能;荧光光谱的结果表明atorvastatin与HSA 的主客体间相互作用为静态猝灭并形成了不产生荧光的复合物;量热学实验表明由 atorvastatin进入到HSA的表面疏水空腔后,通过自发的熵驱动放热作用进行的小分子药物和血清蛋白结合过程,还通过疏水-疏水作用和氢键作用进而改变蛋白的折叠状态并将水分子从空腔中释放到周围环境中。它们间的结合常数可以表明是中等偏弱强度的结合,形成较为稳定的配合物,同时在一定条件下又便于解离,从药代动力学来讲,合适的结合常数有利于血清白蛋白将药物运送到目标位置。结合位点数可近似看为1,说明1个药物分子只是结合1个血清白蛋白;分子对接计算结果表明药物结合在HSA的Trp214附近且处于疏水口袋中,同时也证实了主客体之间存在较强的疏水及氢键作用。本文可能会为高通量研究药物小分子与蛋白相互作用以及药物快速筛选、药代动力学等方面提供一定的科学依据。

