氯硝柳胺磷酸酯通过抑制Wnt/β-catenin通路抑制肾脏组织纤维化
常晓燕, 吴启美, 江 肖,吴永贵
现阶段慢性肾脏病(chronic kidney disease,CKD)已经成为全球性公共健康问题,其患病率和病死率极高,其中很大一部分患者可进展至终末期肾脏病(end stage renal disease,ESRD)。肾脏纤维化是各种慢性肾脏病进展至ESRD的共同途径;肾脏纤维化是一个动态进展过程,包括启动、活化、持续、进展等,在此过程中涉及多种信号通路及细胞因子的活化,其中Wnt/β-Catenin信号通路是被证实参与肾脏组织纤维化的重要信号通路[1]。
该研究所涉及到的一种药物氯硝柳胺,商品名:灭绦灵、荡绦灵、硝硫苯酯、育米生等,为美国 FDA已批准用药,既往主要用于肠道寄生虫感染,哺乳动物低毒性。氯硝柳胺难溶于水,肠道中很难吸收,前期的研究[2-3]在其原有的侧链上加一磷酸基团,即氯硝柳胺磷酸酯(phosphate niclosamide,P-NICLO),该衍生物可明显增加药物水溶性而不明显影响其化学效应,大大扩展了其研究应用范围[2-3]。该文中所提及的用药均为氯硝柳胺的水溶性衍生物即P-NICLO。既往研究[2-3]显示,氯硝柳胺在肿瘤细胞中可以通过显著抑制Wnt/β-Catenin信号通路的活化而抑制肿瘤细胞的增殖。肾脏纤维化进展过程中,Wnt/β-Catenin信号通路也处于活化状态,P-NICLO在肾脏组织纤维化过程中是否有类似抑制Wnt/β-Catenin信号通路的作用尚未可知。该研究旨在探讨P-NICLO是否通过抑制Wnt/β-Catenin信号通路的活化而抑制肾脏组织纤维化。
1 材料与方法
1.1实验动物与细胞雄性BALB/c小鼠,20~25 g,购自并饲养于安徽医科大学实验动物中心。大鼠肾小管上皮细胞株NRK-52E美国ATCC来源细胞株。该研究动物实验经安徽医科大学实验动物中心伦理委员会批准(批准号:20170371)。
1.2主要试剂与仪器Wnt/β-Catenin信号通路相关抗体anti-β-Catenin、anti-active-β-Catenin (即anti-ABC)购自美国Millipore公司;抗纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAL1)即anti-PALI购自美国Santa Cruz公司;抗基质金属蛋白酶-7(matrix metalloproteinase-7,MMP7)即anti-MMP7购自美国GeneTex公司;anti-Snai购自美国Cell signaling公司;Real-Time PCR仪(7500Fast)购自美国ABI公司;Bio-Rad电泳仪购自美国BIO-RAD公司;TRIzol 试剂及TaKaRa试剂盒(Cat.No:RR047A)购自美国Invitrogen公司。
1.3实验动物及细胞模型建立
1.3.1动物模型及分组 雄性BALB/c小鼠20~25 g,行左侧输尿管结扎术后,随机分为3组:Sham组、单侧输尿管梗阻模型(unilateral ureteral obstruction,UUO)组、UUO+P-NICLO组,每组5只。用药组P-NICLO用0.9%氯化钠注射液溶解,术天第7天开始30 mg/kg剂量腹腔注射,每日1次;UUO阳性对照组予以相应剂量的生理盐水腹腔注射,术后第14天处死小鼠取组织。
1.3.2细胞模型及分组 大鼠肾小管上皮细胞NRK52E传代分皿后,分组如下:① CTRL(Control)组:无血清DMEM/F12培养液培养24 h;② TGFβ1组:含10 ng/ml TGFβ1无血清DMEM/F12培养液培养24 h收取蛋白;③ P-NICLO药物干预组:P-NICLO按照浓度梯度预处理细胞1 h后加TGFβ1 10 ng/ml继续无血清DMEM/F12培养液培养24 h后收细胞。所有实验重复3次。
1.4样本制备
1.4.1动物实验标本制备 所有小鼠术后第14天处死,处死小鼠时,左心室抽血,右心房切一小口,予以约20 ml冰PBS灌注左心室至肾脏苍白色,收集两侧肾脏备用。取左侧病变肾脏上极置于10%福尔马林溶液中固定,4 ℃至少放置24 h后,脱水,石蜡包埋,做常规病理检测。收集其余左侧病变肾脏皮质部分,用液氮冷冻,转移至-80 ℃保存备蛋白及组织RNA的提取。
1.4.2细胞实验标本收集 Western及IP细胞裂解液裂解细胞,提取细胞蛋白,行Western blot检测纤维化相关指标:α-SMA、Fibronectin(FN)、CollagenI(COL1)以及β-Catenin信号通路相关指标:β-Catenin 、active-β-Catenin以及β-Catenin信号通路靶蛋白PAL1、MMP7、Snail等的表达。
1.5实验方法
1.5.1光镜 标本取出后 ,进行脱水,包埋,切片, Masson染色。肾脏皮质部位显微镜400×视野下随机选取至少15个视野,然后应用Image pro-Plus6.0软件,计算阳性染色区域的积分光密度(integrated option density,IOD)值,阳性染色区域的IOD/图片总面积所得出的数值再进行统计学分析。
1.5.2Western blot 超声震荡打碎的肾脏组织或收集的细胞,用Western或IP裂解液冰上裂解30 min(裂解液中需加入一定比例的蛋白酶抑制剂),提取总蛋白,经聚丙烯酰胺凝胶电泳分离,后转印至PVDF膜,5%BSA 室温封闭2 h,按照说明书分别加入一定浓度的一抗及二抗封闭,加DAB 显色液,曝光显影并拍照保存,以GAPDH 为内参验证蛋白含量。
1.5.3Real-time PCR 根据TRIzol试剂说明书及TaKaRa试剂盒说明书进行操用,具体步骤如下: TRIzol裂解液裂解组织或细胞,然后提取RNA并逆转录成CDNA,最后按照说明书依次将反应体系加入7500 Fast Real-time PCR的反应体系中,行PCR扩增检测。动物实验Real-time PCR引物:GADPH F:5′-GGTGAAGGTCGGTGTGAACG-3′;R:5′-CTC GCTCCTGGAAGATGGTG-3′;MMP7 F :5′-TAGGCGG AGATGCTCACTTT-3′;R:5′-TTCTGAATGCCTGCAA TGTC-3′;PAL1 F:5′-GTTCATCGCTGCACCCTTTG-3′;R:5′-CTGCTCTTGGTCGGAAAGACT-3′;Snail F :5′-ATTCTCCTGCTCCCACTGC-3′;R:5′-GACTCTTG GTGCTTGTGGAG-3′。
2 结果
2.1P-NICLO对肾脏纤维化的干预作用实验过程中,小鼠无明显厌食,腹泻,活动度下降等不良反应,无发生死亡,提示P-NICO毒性相对较低。MASSON染色显示UUO+P-NICLO组肾脏组织胶原纤维沉积明显减轻,与UUO组比较差异有统计学意义。Western blot结果也表明,动物模型中UUO+P-NICLO组纤维化指标α-SMA、Fibronectin、CollagenI表达均显著降低,与UUO组比较差异有统计学意义(图1、表1)。细胞实验进一步证实了上述论点,TGFβ1体外刺激NRK52E细胞,使其活化产生促纤维化因子,P-NICLO预处理细胞可以明显下调纤维化相关蛋白的表达水平,与TGFβ1组比较差异有统计学意义(图2、表2)。
A、B:各组小鼠肾脏皮质(MASSON染色×400)及其胶原纤维沉积的定量分析;C、D: Western blot检测各组小鼠纤维化蛋白表达及其定量分析;与Sham组比较:*P<0.05;与UUO组比较:#P<0.05
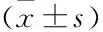
表1 Western blot检测各组动物肾脏组织纤维化蛋白的表达
与Sham组比较:*P<0.05;与UUO组比较:#P<0.05
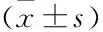
表2 Western blot检测各组NRK52E细胞促纤维化因子的表达
与CTRL组比较:*P<0.05;与TGFβ1组比较:#P<0.05
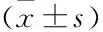
表3 Western blot检测各组动物肾脏组织β-Catenin信号通路相关蛋白的表达
与Sham组比较:*P<0.05;与UUO组比较:#P<0.05
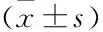
表4 Western blot检测各组NRK52E细胞β-Catenin信号通路相关蛋白的表达
与CTRL组比较:*P<0.05;与TGFβ1组比较:#P<0.05
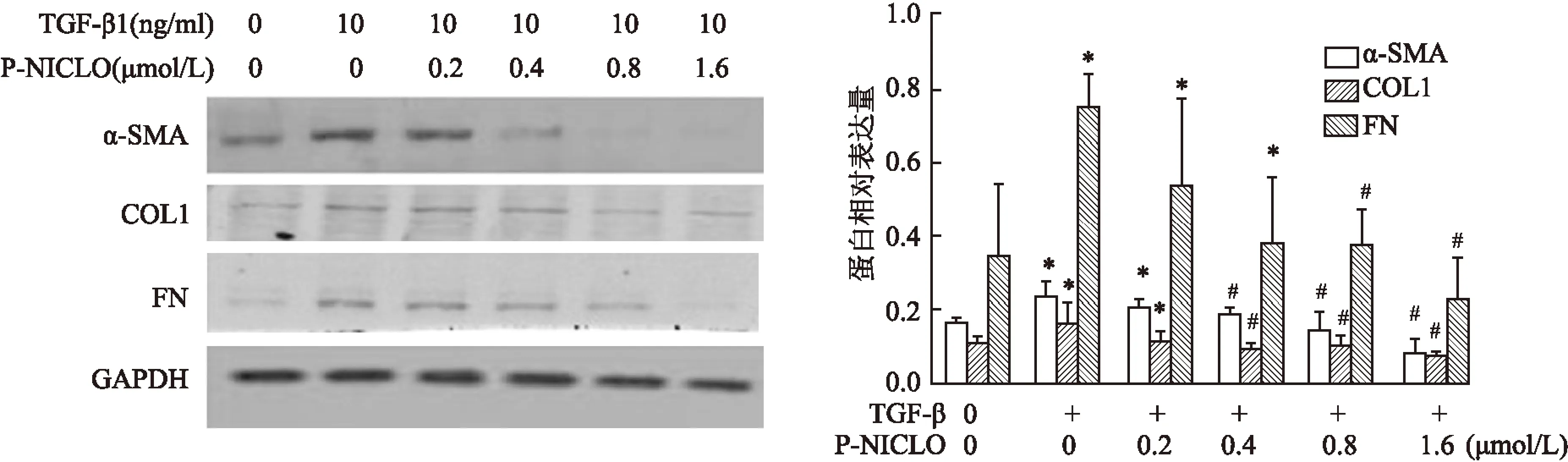
图2 P-NICLO对 NRK52E细胞促纤维化因子表达的影响
2.2P-NICLO对肾脏纤维化β-Catenin信号通路的干预作用体内实验(图3、表3)及体外实验(图4、表4)都证实P-NICLO可以使总β-Catenin及活化的β-Catenin表达均显著下调,进而抑制其下游信号通路的活化,使其靶基因(PALI1、MMP7、Snail)表达水平均显著下调,与UUO组比较差异有统计学意义。
3 讨论
肾脏纤维化是各种慢性肾脏病进展至ESRD的共同途径,但目前临床上尚缺乏有效抑制肾脏组织纤维化的药物,如何更有效地抑制肾脏组织纤维化,延缓CKD进展至ESRD需要肾脏替代治疗的时间无疑是当前肾脏病卫生战略重点之一。
图3 P-NICLO对UUO模型β-Catenin信号通路活化的影响
A、B:Western blots示各组小鼠β-Catenin信号通路相关蛋白的表达及其定量分析;C~E:Real-time PCR示各组小鼠β-Catenin信号通路靶基因PAL1(C)、MMP7(D)、Snail(E) mRNA水平的表达;与Sham组比较:*P<0.05;与UUO模型组比较:#P<0.05
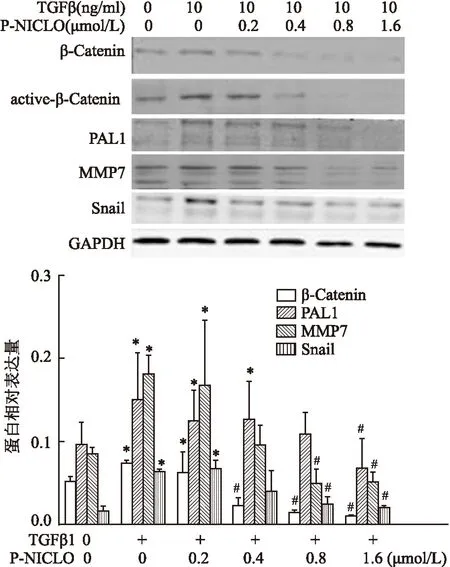
图4 P-NICLO对NRK52E细胞β-Catenin信号通路活化的影响
与CTRL组比较:*P<0.05;与TGFβ1组比较:#P<0.05
研究[4]显示肾脏组织纤维化发生及进展涉及肾脏组织的所有细胞成分,如小管、小管间质、肾小球、血管内及募集到肾脏组织的骨髓源性细胞(如单核细胞、纤维细胞)等。肾脏组织纤维化是一个动态进展过程,包括启动、活化、持续、进展等,在此过程中涉及多条信号通路及细胞因子的活化[1]。目前研究比较多的与肾脏组织纤维化相关的信号通路包括TGFβ/Smad信号通路、Wnt/β-Catenin信号通路、NF-κB信号通路、RASS信号通路等。这些信号通路在肾脏组织纤维化的发生及进展过程中均有不同程度的活化,参与调节肾脏组织纤维化发生及发展,且各条信号通路并不是孤立存在而是相互关联相互影响,存在“串话”效应[1,5],大量基础实验及临床研究通过制备靶向抑制上述信号通路的药物,用于抗肾脏纤维化治疗,并已取得一定成效[6-7]。
该研究所涉及的Wnt/β-Catenin信号通路是一种经典的信号通路,在动物的生长发育及病理生理变化中发挥重要作用。在此信号通路中,β-Catenin是一种细胞骨架蛋白,与E-钙黏蛋白(E-cadherin)、α-连环蛋白(α-catenin)等形成黏附复合体,在细胞-细胞黏附中起重要作用[8-9]。β-Catenin除形成复合体外,还是Wnt/β-Catenin信号转导通路中关键调节因子。Wnt蛋白同时与跨膜卷曲蛋白受体Frizzled(Fzd)和低密度脂蛋白受体相关蛋白(LRP)结合,然后激活下游disheveled(Dsh)蛋白,Dsh活化后,进一步激活ZW3/GSK3,使β-Catenin磷酸化减少,无法及时降解而在胞质内堆积,过度堆积的β-Catenin可转位入核,与核转录因子即T 细胞因子(TCF)/淋巴增强结合因子(LEF)结合组成复合物,再募集共活化因子环磷酸腺苷(cAMP)效应元件结合蛋白(cAMP-response element binding protein,CREB)结合蛋白(CBP),从而激活Wnt/β-Catenin靶基因的转录,包括常见的Snail、PAL1、MMP7等[8]。细胞内β-Catenin水平是Wnt信号通路中的重要调节靶点。β-Catenin在细胞内的水平受正性调节因子和负性调节因子的竞争性调节,负性调节因子是由GSK/ZW3、Axin及APC一组蛋白组成的复合体,主要作用是破坏β-Catenin的稳定性,使β-Catenin在细胞内降解处于高水平,从而关闭Wnt途径。正性调节因子包括另一类拮抗类的蛋白,包括Disheveled及TCF-Grouch-CBP等,在对Wnt信号反应时被活化,起拮抗破坏复合物的作用,使细胞内的β-Catenin水平升高,从而启动Wnt信号[8-9]。
Wnt/β-Catenin信号通路在肾脏发育过程中处于活化状态,肾脏发育成熟后处于静止状态,肾脏疾病时重新活化[8-9]。在很多肾纤维化模型中均可以发现Wnt/β-Catenin信号通路的激活,而选择性的抑制这一通路可以明显减轻肾脏纤维化。如近年来研究[9-10]显示小分子肽类化合物ICG-001,可特异性的干扰Wnt/β-Catenin信号通路。ICG-001通过结合CBP从而干扰β-Catenin/CBP的相互作用,已经证明其在小鼠模型上能够逆转甚至阻断肾脏纤维化,但只处于临床前研究,需进一步验证。Wnt/β-Catenin信号通路还可以直接调控RASS相关蛋白基因而影响肾脏病的进展。研究[10-11]表明选择性抑制Wnt/β-Catenin信号通路的活化是肾脏纤维化治疗的另一个重要靶点。
既往研究Wnt/β-Catenin信号通路特异性抑制物大多为新合成化合物,其性能及安全性还有待进一步验证。本研究所涉及的药物P-NICLO是FDA已批准用药即氯硝柳胺的水溶性衍生物,该药物在肾脏组织纤维化防治中的作用尚无相关研究。既往研究[12-13]氯硝柳胺药理作用时显示,在肿瘤细胞中,氯硝柳胺可以通过抑制β-Catenin信号通路的活性抑制肿瘤细胞的增生。Chen et al[12]发现在人类骨肉瘤U2OS细胞中,氯硝柳胺主要通过促进Wnt受体Fzd1内吞,抑制Wnt信号调节蛋白 Dsh的表达等多方面抑制β-Catenin信号通路;在人类结肠癌细胞系中,也发现类似作用[13];但是在人类前列腺癌和乳腺癌细胞中,氯硝柳胺主要通过促进Wnt共受体LRP6的降解而抑制β-Catenin信号通路的活化,而对Dsh蛋白表达无影响;表明氯硝柳胺抑制β-Catenin信号通路的作用机制具有细胞特异性[13-14]。
该研究通过设计体内体外实验证实肾脏纤维化模型中,P-NICLO可特异性抑制β-Catenin总蛋白及活化β-Catenin蛋白形成,进而抑制下游靶蛋白PALI1、MMP7、Snail等表达,最终抑制肾脏组织纤维化,为肾脏纤维化的防治提供新的思路。但P-NICLO如何抑制β-Catenin总蛋白及活化β-Catenin蛋白的形成,其抑制Wnt/β-Catenin信号通路的活化是否还有其他机制参与尚未可知,有待进一步研究证实。

