柑橘采后病害生防木霉的筛选与鉴定
罗红霞,栾丰刚,张 扬,李 冬*
柑橘采后病害生防木霉的筛选与鉴定
罗红霞1,栾丰刚2,张 扬2,李 冬2*
(1. 江西省九江市林业有害生物防治检疫局,江西 九江 332000;2. 江西农业大学 林学院,江西 南昌 330045)
从毛竹林土壤中分离得到9株木霉菌株,采用平板对峙法评估了9株木霉菌对4种柑橘产后病害病原菌的抑制效果,并利用ITS及2基因序列分析鉴定木霉菌株。结果发现:(1)9株木霉对柑橘青霉病菌具有较好的抑制效果,对峙培养7 d的抑制率均达到100%;9株木霉对其它3种柑橘产后病害的抑制率不同,其中菌株T2对柑橘黑腐病抑菌效果最好,抑制率达85.84%;菌株T3和T8对柑橘酸腐病菌抑制效果最好,抑制率达100%;菌株T3、T5和T6对柑橘绿霉病菌抑制效果最好,抑制率达80%。(2)共鉴定木霉菌3种,其中哈茨木霉()6株(T1、T3、T5、T7、T8和T9),为优势种;绿木霉()2株(T2和T4);绿色木霉()1株(T6)。
生物防治;木霉菌;拮抗;柑橘采后病害
木霉属是土壤微生物的重要类群,广泛分布于世界各地。由于木霉可以产生纤维素酶及其它水解酶和多种次生代谢产物,具有重要的经济价值。同时,木霉具有显著的植物病原菌拮抗活性和生物防治潜力,国内外学者对其拮抗作用及机制作了较为系统深入的研究,并开发了多种商业化生防菌剂及生物菌肥用于农作物保护[1-4],该属真菌已经成为研究和应用最多的植物病害生防菌。
自Persoon(1794)建立了木霉菌属(Pers.)以来,关于该属的分类经历了较大的变化,如e的有性型为[5]、9个集合种(species aggregate)分类体系[6]、5个组(section)分类系统[7]以及将Saturnisporum组并入到Longibrachiatum组的4个组分类体系[8]。随着分子系统学应用于木霉属分类研究,为开展木霉属的鉴定提供了有效的技术参考。如Druzhinina等[9]建立了木霉属与肉座菌属物种的DNA条形码序列(ITS1和ITS2)鉴别系统OKey v. 1.0。Kopchinskiy等[10]建立了专门用于木霉属与肉座菌属物种序列检索的BLAST数据库。Zhu等[11]比较了基于、2和1基因的种内与种间序列差异及序列获取难易程度,认为2最小种间差异大于最大种内差异,且PCR扩增与测序成功率较高(94.4%),可作为木霉属的补充条形码。
随着木霉分子系统学研究加速,新的物种不断被发现。截至2015年,木霉属包括254个种及2个变种[11]。我国学者也在木霉属资源与系统分类研究方面做了大量工作,迄今我国已报道的木霉属真菌有118种[12-19],体现出了较高的物种多样性。然而,我国目前对木霉菌属的研究多集中在华东、西南和东北地区,而其他地区的研究相对较少。
柑橘是世界第一大果[20],也是我国南方栽培的主要水果之一,具有重要的经济价值[21]。目前,我国柑橘仍以鲜果销售为主,为满足长期供应,柑橘需要在采收后经过较长时间的贮藏与运输。由于柑橘果实含水率高、营养丰富,在采收、贮藏及运输过程中极易受到各种病原真菌感染[22]。目前,常见且发生严重的柑橘产后病害主要有绿霉病()、青霉病()、酸腐病()[22]及黑腐病(),其中绿霉病与青霉病引起的损失占所有采后病害90%以上[23]。据统计,我国每年柑橘因采后病害而造成的损失一般为10%左右,个别年份高达30%以上[24]。因此,如何预防及降低柑橘采后病害的发生已成为国内外开发研究的热点之一。
迄今为止,国内外控制柑橘采后病害主要措施仍是化学杀菌剂处理,常见药剂有多菌灵、甲基托布津、苯莱特等。由于化学农药的长期使用,除了农药残留给人们健康带来隐患外,还导致病原菌对杀菌剂产生抗药性,降低了化学杀菌剂的防治效果。因此,本研究拟重点解决以下问题:(1)分离筛选柑橘主要产后病害病原菌拮抗木霉;(2)明确拮抗木霉的分类地位。通过试验研究,以期为木霉菌在柑橘采后病害生物防治中的应用提供菌种资源及参考依据。
1 材料与方法
1.1 供试菌株和材料
供试菌株:4种柑橘采后病害病原菌由江西农业大学农学院植物保护系向妙莲老师惠赠;木霉菌(T1-T9)由江西农业大学园林与艺术学院森林保护实验室分离和保存。

表1 供试木霉菌株信息
1.2 拮抗木霉菌的筛选
参考Dennis & Webster(1971)[25]的平板对峙法并稍作修改。将已初筛具有拮抗活性的木霉菌株与病原菌平板培养后,使用打孔器将病原菌和木霉切成直径6 mm的菌丝块,木霉接种至PDA平板中央,病原菌接种至距离平板边缘约2 cm处,每皿放4块病原菌,置放入25 ℃恒温培养,每个菌株设置3个重复,以仅接种病原菌纯培养为对照。168 h后观察并测量病原菌的菌落半径,按以下公式计算木霉菌的抑制率:
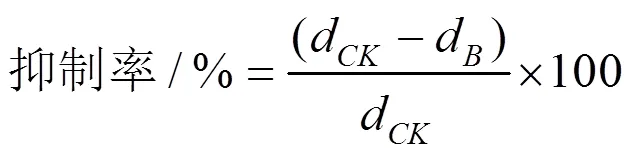
其中:d为对照组接种植物病原菌后168 h的直线生长距离;d为对峙培养组接种植物病原菌后168 h的直线生长距离。
1.3 拮抗木霉菌的鉴定
采用CTAB法提取木霉菌株总DNA,采用引物ITS4和ITS5对ITS序列进行扩增[26],用引物983F和2218R对RPB2序列进行扩增[27]。双向测序后采用DNAstar中的Seqman 7.1.0软件包[28]进行序列拼接,并采用人工校正个别位点的错误信息。将测得ITS及RPB2序列提交至GenBank获得登录号,并分别在ISTH(International Subcommission on Trichoderma and Hypocrea Taxonomy)的OKEY v. 2.0[8]和BLAST v. 1.0[9]进行Blast比对鉴定其分类地位。
2 结果与分析
2.1 拮抗菌对几种植物病原菌的拮抗效果
由表2可看出:9株木霉菌对柑橘青霉病菌抑制效果较好,抑制率均为100%;对柑橘黑腐病拮抗效果最好的是菌株T2,菌株T6次之;对柑橘酸腐病菌拮抗效果最好的是菌株T3和T8,抑制率为100%;对柑橘绿霉病菌抑制效果较好的木霉菌株是T3、T5和T6,抑制率为80%。

图1 不同木霉菌株对柑桔酸腐病菌的拮抗作用
从木霉菌株来看,除菌株T9对柑橘黑腐病抑制率(35.39%)较低外,其余8株木霉对4种柑橘产后病害病原菌的抑制率均超过了60%,即8株木霉对4种柑橘产后病害病原菌有一定的抑菌活性。
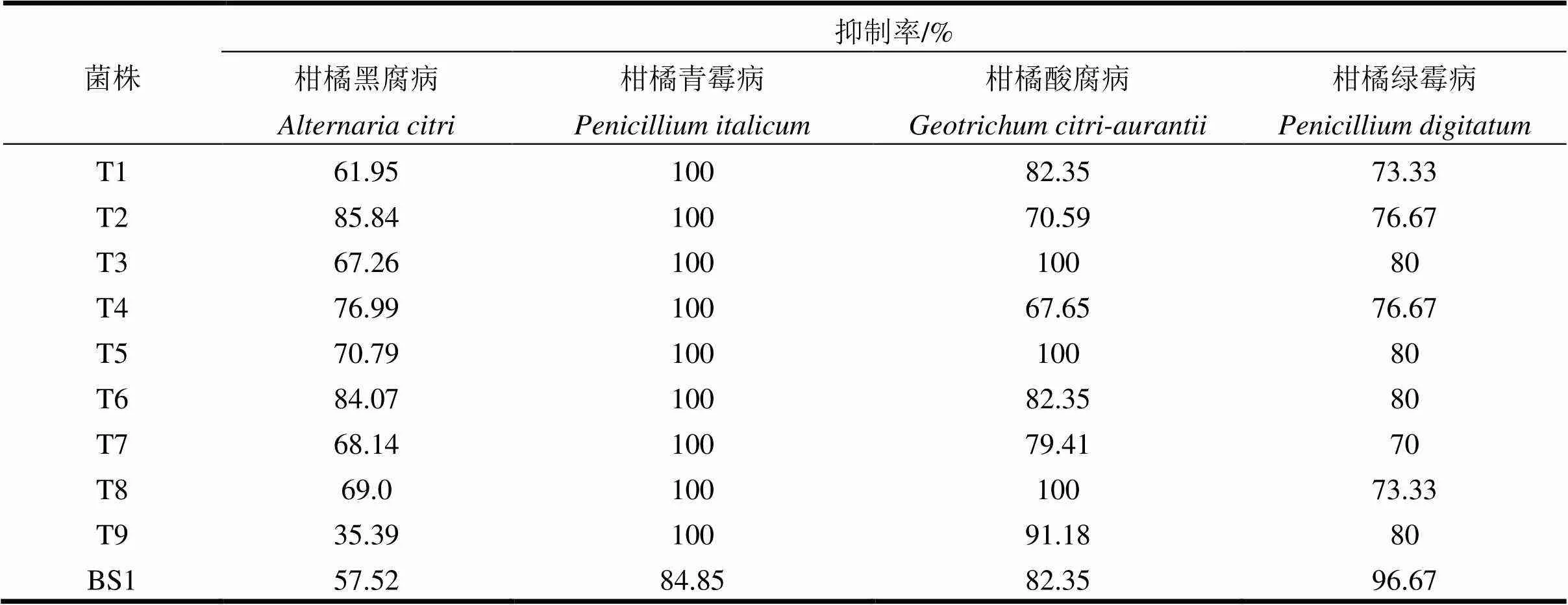
表2 木霉菌株对不同植物病原菌的抑制率
2.2 拮抗木霉的分子鉴定
基于ITS基因序列在OKEY v. 2.0比对结果可知:本研究的9株木霉菌以哈茨木霉()为主,其中6株木霉(T1、T3、T5、T7、T8和T9)在系统发育上与哈慈木霉亲缘关系最近;菌株T6与绿木霉()亲缘关系最近,而菌株T2和T4与拟康宁木霉()亲缘关系最近。

表3 基于ITS序列的TrichOKEY v2.0比对结果

表4 基于rpb2基因的TrichBLAST v.1.0比对结果
基于2基因序列输入BLAST v. 1.0比对结果可知:7株木霉(T1、T3、T5、T6、T7、T8和T9)与OKEY v. 2.0比对结果基本一致,而2株木霉(T2和T4)基于2基因序列blast结果为绿色木霉()。依据Zhu等[11]对于木霉菌ITS、2和1基因鉴定准确性的评价,2基因比ITS基因更适合作为木霉属的补充条形码,本研究据此认为菌株T2和T4鉴定为绿色木霉()更为合适。
3 讨 论
随着农业生产的发展以及人们对果蔬产品需求量的增加,柑橘作为世界主要水果之一,其种植面积及产量也不断扩大,而其产后病害也日益突出,成为影响柑橘产业发展的制约因子之一。目前,化学防治仍然是柑橘产后病害的主要措施之一。然而,杀菌剂的广泛使用带了诸多问题,如农药残留、病原菌抗性增加、生态平衡破坏等,进而造成杀菌剂效果下降、用量增加,甚至防治无效等后果[29-30]。如在柑橘上长期适应苯并咪唑类杀菌剂,使得原来对其不敏感的柑橘黑腐病与柑橘酸腐病菌种上升成为主要病害病原菌[31]。因此,寻找安全、经济、高效的生物防治成为研究的热点。
迄今为止,利用拮抗真菌对植物病害进行生物防治的研究相当多,但多数研究多限于实验室条件下,生产应用较为成功仅为少数,如木霉()、盾壳霉()、毛壳霉()等,其中以木霉作为生物载体的生防菌剂或菌肥开发应用最多,全球已注册的产品超过50种[32],如以色列MakhteshimAgan公司以哈茨木霉为生物载体开发的产品Trichodex用于防治由灰葡萄孢引起的蔬菜和葡萄病害;新西兰Agrimm Bilogicals公司以木霉(包括哈茨木霉和绿色木霉)为生物载体开发的产品Trichodwels用于防治各种土传病害及由紫韧革菌引起的银叶病;美国生物农药公司BioWorks以木霉(包括哈茨木霉和绿色木霉)为生物载体开发的RootShield用于防治输出及其它作物猝倒病。由此可见,木霉在植物病害生物防治方面展现出了巨大的应用潜力。
本研究的9株木霉对4种主要的柑橘产后病害均有一定的抑菌活性,除菌株T9对柑橘黑腐病菌抑菌效果较差外,其余8株木霉对4种柑橘产后病害均表现出一定的抑菌活性。9株木霉除了对柑橘青霉病菌抑制效果一致较好以外,而对其它3种柑橘产后病害表现出不同的抑制效果。从生长速度上看,木霉菌具有高于柑橘产后病害病原菌的生长速度,因此,木霉菌可覆盖病原菌并通过竞争作用达到抑菌目的。由于柑橘产后病害防治对象为柑橘果实,直接以拮抗木霉开发菌剂(如粉剂、水剂等)进行生物防治可能存在诸多问题。课题组进行了木霉发酵液粗提物平板抑菌(图2)初步试验,结果发现木霉粗提物中含有抑菌物质,今后将重点获得纯化的抑菌活性成分,将对开发利用木霉防治柑橘产后病害更为有利。
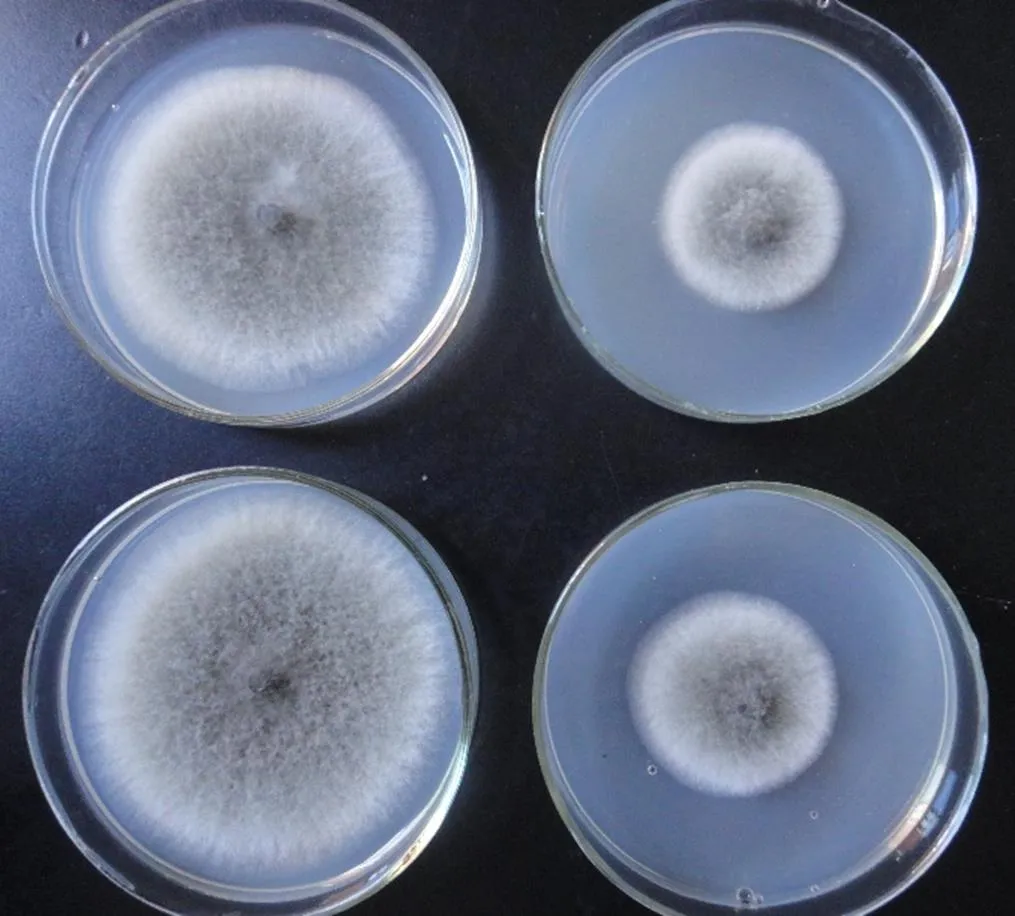
图2 木霉菌株T9发酵液对柑桔酸腐病菌的抑制作用
本研究通过系统发育分析将供试9株木霉鉴定为3种:其中包括6株哈茨木霉(),2株为绿色木霉()及1株绿木霉(),表现出较高的物种多样性。结合9株木霉对3种柑橘产后病害(柑橘青霉病除外)病原菌的抑菌效果来看:绿色木霉菌株T2对柑橘黑腐病抑制效果最好;哈茨木霉菌株T3和T8对柑橘酸腐病抑菌率最高;而哈茨木霉菌株T3与T5及绿木霉菌株T6则对柑橘绿霉病表现出较好的抑菌活性。然而,本试验尚未就供试菌株的抑菌机理及实际防病效果进行研究,后续试验将对上述问题做进一步研究。
[1] Tripathi P, Dubey N K. Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables[J]. Postharvest Biology & Technology, 2004, 32(3): 235-245.
[2] Asad S A, Ali N, Hameed A, et al. Biocontrol efficacy of different isolates ofagainst soil borne pathogen[J]. Pol J Microbiol, 2014, 63(1): 95-103.
[3] Zafari D, Koushki M M, Bazgir E. Biocontrol evaluation of wheat take-all disease byscreened isolates[J]. African Journal of Biotechnology, 2008, 7(20): 3650-3656.
[4] Benítez T, Rincón A M, Limón M C, et al. Biocontrol mechanisms ofstrains[J]. International Microbiology the Official Journal of the Spanish Society for Microbiology, 2004, 7(4): 249.
[5] Lorito M, Woo S L, Harman G E, et al. Translational research on: from 'Omics to the field[J]. Annual Review of Phytopathology, 2010, 48(1): 395.
[6] Rifai M A. A revision of the genus[J]. Mycol Pap, 1969, 116: 1-54.
[7] Bissett J. A revision of the genusI. Section Longibrachiatum sect[J]. Canadian Journal of Botany, 1984, 62(5): 924-931.
[8] Gams W, Bissett J. Morphology and identification of[M]//Kubicek C P, Harman G E.and: Vol 1: Basic biology, taxonomy and genetics. London: Taylor and Francis Ltd. 1998: 3-34.
[9] Druzhinina I S, Kopchinskiy A G, Komoń M, et al. An oligonucleotide barcode for species identification in Trichoderma and Hypocrea[J]. Fungal Genetics & Biology, 2005, 42(10): 813-828.
[10] Kopchinskiy A, Komon M, Kubicek Cp, et al. TrichoBLAST: a multilocus database forandidentifications[J]. Mycological Research, 2005, 109(6): 658-660.
[11] Zhu Z X, Zeng Z Q, Zhuang W Y. Selection of a supplementary DNA barcode for the genus(Hypocreales, Ascomycota)[J]. Mycosystema, 2014, 33(6): 1253-1262.
[12] John B, Walter G, Walter J, et al. Acceptednames in the year 2015[J]. Ima Fungus, 2015, 6(2): 263-295.
[13] 张广志, 杨合同, 张新建, 等. 木霉现有种类名录[J]. 菌物学报, 2014(6): 1210-1230.
[14] 朱兆香, 庄文颖. 木霉属研究概况[J]. 菌物学报, 2014(6): 1136-1153.
[15] 秦文韬, 陈凯, 庄文颖. 木霉属 5 个中国新记录种及 3 种木霉在中国的新分布[J]. 菌物学报, 2016, 35(10): 1-15.
[16] 朱兆香, 李玉. 木霉属3个中国新记录种[J]. 菌物学报, 2016, 35(11): 1008-1017.
[17] 陈凯, 庄文颖. 来自土壤的木霉属4个中国新记录种[J]. 菌物学报, 2017, 36(12): 1-10.
[18] 陈凯, 李纪顺, 张广志, 等. 中国新记录种毛细木霉及功能评价[J]. 山东科学, 2016, 29(1): 93-97.
[19] 陈凯, 李纪顺, 王贻莲, 等. 洞庭湖湿地木霉多样性及生防活性[J]. 微生物学通报, 2017, 44(10): 2307-2320.
[20] 张广志, 张新建, 李成云, 等. 木霉属7个中国新记录种(英文)[J]. 菌物学报, 2016, 35(8): 984-993.
[21] 邓秀新郭文武. 国际柑橘学会第九届学术大会介绍[J]. 果树学报, 2001(2): 124.
[22] 陈仕俏, 赵文红, 白卫东. 我国柑橘的发展现状与展望[J]. 农产品加工(学刊), 2008(3): 21-24.
[23] Zhang Z F, Zhu Z R, Ma Z H, et al. A molecular mechanism of azoxystrobin resistance inUV mutants and a PCR-based assay for detection of azoxystrobin-resistant strains in packing- or store-house isolates[J]. International Journal of Food Microbiology, 2009, 131(2/3): 157-161.
[24] 陆宁海, 徐瑞富, 吴利民, 等. 柑桔青霉菌侵染条件及致病性研究[J]. 东南园艺, 2005(1): 6-8.
[25] Dennis C, Webster J. Antagonistic properties of species-groups of: III. Hyphal interaction[J]. Transactions of the British Mycological Society, 1971, 57(57): 363-369.
[26] White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[J]. PCR Protocols: a guide to methods and applications, 1990, 18: 315-322.
[27] Liu Y J, Whelen S, Hall B D. Phylogenetic relationships among ascomycetes: evidence from an RNA polymerse II subunit[J]. Molecular Biology & Evolution, 1999, 16(12): 1799-1808.
[28] Burland T G. DNASTAR’s Lasergene sequence analysis software[J]. Methods in Molecular Biology, 2000, 132: 71-91.
[29] Eckert J W, Ogawa J M. The chemical control of postharvest diseases: deciduous fruits, berries, vegetables and root/tuber crops[J]. Annual Review of Phytopathology, 1988, 26(1): 433-469.
[30] Zhu J W, Xie Q Y, Li H Y. Occurrence of imazalil-resistant biotype ofin China and the resistant molecular mechanism[J]. Journal of Zhejiang Universityence A, 2006, 7(2): 362-365.
[31] 李红叶曹若彬. 果蔬产后病害生物防治研究进展[J]. 生物防治通报, 1993(4): 176-180.
[32] Woo S L, Scala F, Ruocco M, et al. The molecular biology of the interactions betweenspp., Phytopathogenic fungi, and plants[J]. Phytopathology, 2006, 96(2): 181.
Screening and Identification ofStrains in Biological Control of Post-harvest Diseases of Citrus
LUO Hong-xia1, LUAN Feng-gang2, ZHANG Yang2, LI Dong2*
(1. Forest Pest Control and Quarantine Bureau of Jiujiang, Jiujiang, Jiangxi 332000, China; 2. College of Forestry, Jiangxi Agricultural University, Nanchang 330045, China)
Nine strains ofspp. from soils in different bamboo forests in Jiangxi Province were evaluated, and their antagonism against,,, andwere got by flat dilution. And then strains ofspp. were identified with the sequences of ITS and2. The results showed that: (1) nine strains ofhad antagonism against, and the inhibition effects (IE) reached 100% in 7 days. There were different inhibition effect on other three pathogens of,, and. Thestrain T2 had the significant antifungal effects on, with the IE up to 85.84%. Thestrains T3 and T8 had powerful antagonism against, with the IE up to 100%. And the inhibitory effects ofstrains T3, T5 and T6 were the best, with the IE up to 80%. (2) Three species among the nine strains ofspp. were identified, of whichwas a dominant species, which included six strains (T1、T3、T5、T7、T8 and T9). Two strains ofspp. (T2 and T4) belonged to, while only onestrain (T6) belonged to.
biological control;; antagonist; post-harvest diseases of citrus
S436.66.1+9
A
2095-3704(2018)03-0192-06
2018-07-18
国家自然科学基金(31560203)、江西省自然科学基金项目(20171BAB204026)和江西省教育厅科技计划项目(GJJ160363)
罗红霞(1971—),女,工程师,主要从事林业微生物研究,LFG7869@126.com;
李冬,副教授,jxld2008@163.com。
罗红霞, 栾丰刚, 张扬, 等. 柑橘采后病害生防木霉的筛选与鉴定[J]. 生物灾害科学, 2018, 41(3): 192-197.
10.3969/j.issn.2095-3704.2018.03.42
