曲虫量对酱香大曲贮存质量的影响
何 星,卢红梅*,陈 莉,乔 岩,张 丽,安家静
(1.贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025;2.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025)
大曲又称为块曲或砖曲,以大麦、小麦等为原料,经破碎后加水混合,压成曲醅,再经发酵培养使微生物在曲块中生长繁殖而制成,统称大曲。大曲的类别有多种,可按工艺、最高品温及香型的不同来区分,按制曲工艺的不同分为传统大曲、纯种大曲和强化大曲[1];按最高品温分为低温大曲、中温大曲和高温大曲[2-4];由于很多白酒所用的大曲制作原料不尽相同,故其香型种类繁多,其中较常见是酱香型大曲、浓香型大曲、清香型大曲及兼香型大曲[5-7]。本试验的对象即为酱香型高温大曲。
白酒酿造过程中微生物主要来源于大曲,不同菌群在发酵过程中扮演着重要的角色:细菌能够水解淀粉和分解蛋白质,能够形成香味物质和香味物质前体,对酱香型白酒独特的风味有重要贡献,杨代永等[8]从茅台大曲中分离出98种微生物,其中细菌41种;大曲中酵母菌主要有酒化和酯化两个作用,酒化作用可将葡萄糖转化为乙醇,酯化作用可产生大量酯类物质,赋予芳香[9-10];大曲中霉菌能够产生多种活化酶,如糖化酶、液化酶、蛋白酶、脂肪酶等,是酿酒生产前期淀粉等大分子降解的主要动力,刘秀等[11]在茅台大曲发酵过程中分离霉菌35种,在制曲环境中分离霉菌49种;LIU X等[12]在茅台大曲中检出Microbacterium testaceum、Thermoascus crustaceus等不易培养霉菌。
“曲乃酒之骨”[13],白酒生产用大曲富含微生物,在发酵过程中起到发酵、生香剂的作用。酱香型白酒酿造工艺特殊,用曲量大是相对于其他白酒工艺的一个突出特点,大曲质量的优劣显得尤为重要,直接决定着白酒的出酒率和优质品率。酱香型大曲生产后按照传统要求需要贮存6个月以上才能投入使用,长时间的贮存使大曲受到曲虫的侵害严重。在酱香型大曲的贮存时期内,曲虫不但啃食大曲,同时也造成理化和生化性能方面的降低。有学者[14]研究发现,贮存4个月曲样受曲虫危害,其质量平均损耗率高达66.98%,淀粉含量、糖化力及发酵力等严重下降,虫蛀严重的曲块已难闻到正常大曲的曲香,因此曲虫对大曲贮存质量的影响不得不引起重视,经张百发等[15]对酱香型大曲研究发现,咖啡豆象、土耳其扁谷盗、蟑螂是酱香型大曲主要曲虫种群。虽然关于曲虫对大曲理化指标的影响的试验研究偶有报道,但曲虫数量对大曲理化指标影响程度却未有人进行研究。
本试验针对贮存酱香型大曲时不同数量曲虫对其的影响程度,在前期调研的基础上,通过添加不同数量的曲虫并进行相关指标检测探讨大曲贮存过程中受曲虫的影响情况,为曲虫数量对酱香型大曲危害的影响方面提供一些科学的依据。
1 材料与方法
1.1 材料与试剂
酱香型大曲:取自贵州省茅台镇某酱香型白酒企业制曲车间。曲虫:在车间利用曲虫诱捕器获取。
氢氧化钠:重庆茂业化学试剂有限公司;碘化钾:广东光华科技股份有限公司;五水硫酸铜、酒石酸钾钠:成都金山化学试剂有限公司;氯化钴:苏州华航化工科技有限公司;重铬酸钾:上海埃彼化学试剂有限公司;铬黑T:上海迈坤化工有限公司;无水乙酸钠、磷酸二氢铵:天津市大茂化学试剂厂;己酸:重庆九龙化学试剂厂;甲醛溶液:天津市盛奥化学试剂有限公司;以上试剂均为分析纯。
高温淀粉酶(20 000 U/g)、糖化酶(50 000 U/g):安琪酵母股份有限公司;平板计数琼脂培养基:天津市科密欧化学试剂有限公司;以上均为生物试剂。
1.2 仪器与设备
PHS-3E型酸度计:上海精科天美科学仪器有限公司;MB23水分测定仪:奥豪斯仪器(上海)有限公司;YXQLS-50SI立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;78-1型磁力加热搅拌器:江苏省金盘市荣华仪器制造有限公司;SPX-250型生化培养箱:上海悦丰仪器仪表有限公司;发酵栓:徐州大华玻璃制品有限公司。
1.3 方法
1.3.1 大曲的贮存方法
通过酒厂技术人员选择发酵仓中发酵较好的大曲多块,曲块破碎至大小约为0.3 kg左右。将4个20 L塑料桶分别编为1号、2号、3号和4号,每桶分别加入破碎程度相当的酱香型大曲曲块(约添加总容积的60%约7 kg),放置于曲仓通风口下。经调研曲仓中贮存时间较长的大曲发现,受虫蛀较轻或严重的大曲可通过蛀孔估计曲虫量,通过估算实验以7 kg大曲中添加0.1 g曲虫为较少量,0.3 g为曲虫一般量,1.0 g为严重数量,分别在2号桶、3号桶、4号桶添加经诱虫灯诱捕的活动良好的曲虫。使用40目防虫纱网将塑料桶口密封,使之可以通气、通风但曲虫不能跑出,每周打开各个试验桶进行通风和感官检查。
1.3.2 取样方法
每月从桶中选取大曲样品约100 g,取样要求:从桶中大曲的各个部分取样,即从其表面、中心、侧边、底部各选择大曲曲块约20 g,再从桶底选择粉末状曲粉约20 g,称质量后记录数据。将取得的样品用破碎机破碎后过60目筛,编号并备用。
1.3.3 水分的测定
参照QB/T 4257—2011《酿酒大曲通用分析方法》[16]。
1.3.4 菌落总数、霉菌、酵母菌总数的测定
具体操作方法参照GB 4789.2—2016《食品微生物菌落总数的测定》[17],GB 4789.15—2010《食品安全国家标准食品微生物学检验霉菌和酵母计数》[18]。
1.3.5 淀粉的测定
具体测定方法参照QB/T 4257—2011《酿酒大曲通用分析方法》。
1.3.6 大曲糖化力、液化力、酯化力及酒化力的测定
大曲中糖化型淀粉酶能将淀粉水解生成葡萄糖,用费林法测定所生成的葡萄糖量得出糖化力;利用淀粉能与碘产生蓝色反应的特性,试样浸出液在35℃,pH4.6溶液中酶解至试液对碘蓝紫色反应消失的特征检测液化力;大曲中酯化酶催化游离有机酸与乙醇合成酯,再用皂化法测定所生成总酯表示其酯化力;大曲能将原料中的淀粉转化为乙醇,以淀粉转化为乙醇的量来表示酒化力(以酒精度表示)。以上指标检测具体方法参照QB/T 4257—2011《酿酒大曲通用分析方法》。
1.3.7 气相色谱-质谱的检测方法
称取酱香型大曲1 g,研碎,置于10 mL固相微萃取仪采样瓶中,插入装有2 cm-50/30 μm Divinylbenzene/Carboxen/Polydimethylsiloxane StableFlex纤维头的手动进样器,在130℃条件下顶空萃取40 min,快速移出萃取头并立即插入气相色谱仪(gas chromatograph,GC)进样口(温度250℃)中,热解吸3 min进样。
色谱柱为ZB-5MSI5%苯基柱-95%二甲聚硅氧烷(30m×0.25 mm×0.25 μm)弹性石英毛细管柱,柱温40℃(保留2 min),以5℃/min升温至270℃,运行时间:48 min;汽化室温度250℃;载气为高纯氦气(He)(99.999%);柱前压7.62 psi,载气流量1.0 mL/min;不分流进样;溶剂延迟时间:1 min。离子源为电子电离(electron ionization,EI)源;离子源温度230℃;四极杆温度150℃;电子能量70 eV;发射电流34.6 μA;倍增器电压1 576 V;接口温度280℃;质量范围29~450 amu。对总离子流图中的各峰经质谱计算机数据系统检索及核对美国国家标准技术研究所(national institute of standards and technology,NIST)2005和Wiley275标准质谱图,确定了X种挥发性化学成分,用峰面积归一化法测定了各化学成分的相对质量分数。
2 结果与分析
2.1 曲虫数量对大曲感官性质影响
定时从试验桶中进行感官性质检测,并与具有丰富相关经验的制曲师共同检测,讨论感官变化,并进行记录,结果见表1。

表1 曲虫数量对大曲感官性质的影响Table 1 Effect of Daqu insects number on the sensory evaluation of Daqu
由表1可知,即使未添加曲虫,大曲中也会在贮藏3个月时出现曲虫,说明大曲贮藏过程中曲虫现象不可避免。随着添加曲虫数量的增加,对大曲感官性质的影响加剧;未添加曲虫组,大曲在贮存9个月后还保持一定的曲香味、大曲能够保持曲块的淡黄色,贮存5个月酱香味已显著存在,而在第6个月大曲中才开始出现异杂味。在曲虫添加量分别为0.1 g/7 kg、0.3 g/7 kg和1.0 g/7 kg的试验组中,曲香味分别在贮存的第8月、第7月和第6月酱香味降低,大曲的异杂味出现的时间分别为第2月、第2月和第1月。且添加量为1.0 g/7 kg的试验组在9个月的贮存后曲香味和酱香味基本消失,异杂味严重。
2.2 大曲水分含量的变化
曲虫数量对大曲水分含量变化的影响见图1。由图1可知,大曲贮存过程中水分含量的变化整体呈梯度下降趋势。未添加曲虫试验组,大曲经过9个月的贮存,其水分含量仅下降至11.64 g/100 g,当试验组加入曲虫后,大曲的水分与未添加曲虫组相比下降的幅度有所增加,而且随着曲虫添加量的增大,大曲的水分含量降低速度和降低程度更大,原因可能是曲虫的活动会增加大曲表层的空气流动,曲虫的虫蛀活动也能够促进大曲内部水分向外扩散。

图1 曲虫数量对大曲水分含量的影响Fig.1 Effect of Daqu insects number on the moisture of Daqu
2.3 大曲菌落总数的变化
曲虫数量对大曲菌落总数的影响见图2。由图2可知,大曲中菌落总数的数量整体都呈现下降的趋势。当曲虫的添加量为0.1 g/7 kg和0.3 g/7 kg时,大曲中菌落总数的数量在贮存前3个月较未添加组高,在贮存4~5个月过程中下降较快,贮存5个月以后略有一定的上升。可能原因是,曲虫死亡后的躯体能够提供一定的营养成分,使好氧性细菌的数量增加。当曲虫添加量为1.0 g/7 kg时,大曲贮存1~5月时菌落总数的下降速度较快,贮存时间超过5个月时,有一定程度的增加,增加幅度与前两者相似。

图2 曲虫数量对大曲菌落总数的影响Fig.2 Effect of Daqu insects number on the total number of colonies of Daqu
2.4 大曲霉菌数量的变化
曲虫添加量对大曲霉菌数量变化的影响见图3。由图3可知,曲虫的添加量为0.1 g/7 kg和0.3 g/7 kg时,大曲中霉菌的数量变化与未添加曲虫时一致,在贮存1、2月时霉菌的数量有所增加。添加量为0.1 g/7 kg时,大曲在前两个月的贮存过程中,霉菌数量较未添加较高,说明曲虫对霉菌的生长具有一定的促进作用;而添加量为0.3 g/7 kg时会对大曲的霉菌有一定的抑制;当添加量为1.0 g/7 kg时,霉菌在第1个月就出现下降,而后霉菌数量下降更加明显,说明曲虫数量较多时,对大曲中霉菌的数量具有抑制作用,因此曲虫重度情况下对大曲中霉菌的生长有较大影响。

图3 曲虫数量对大曲霉菌数量的影响Fig.3 Effect of Daqu insects number on the mold counts of Daqu
2.5 大曲酵母数量的变化
曲虫添加量对酵母数量的影响见图4。由图4可知,当添加量为0.1 g/7 kg和0.3 g/7 kg时,酵母菌的数量在贮存前3个月与未添加相比没有显著的变化,而在贮存3个月以后较未添加组略有降低,说明0.3 g/7 kg以下的曲虫量对大曲中酵母菌的数量影响较小。而添加量为1.0g/7kg时,酵母菌的数量降幅较大,但整体下降趋势较霉菌小,可能原因是酵母对生存环境的抗逆性较强,不易被恶劣的环境杀死。
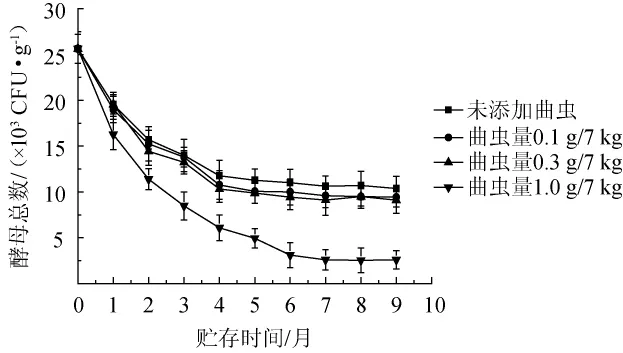
图4 曲虫数量对大曲酵母数量的影响Fig.4 Effect of Daqu insects number on the yeast counts of Daqu
从菌落总数、霉菌及酵母菌数量变化情况来看,大曲中微生物随着曲虫数量的整体大致呈梯度下降:曲虫量为0.1 g/7 kg和0.3 g/7 kg时,微生物减少的幅度并不大;曲虫量为1.0 g/7 kg时,微生物数量呈大幅度下降。
2.6 大曲淀粉含量的变化
曲虫数量对大曲淀粉含量的影响见图5。由图5可知,大曲在贮存过程中淀粉的变化趋势基本相同,其变化整体呈下降趋势,与曲虫的添加量在一定程度上呈正相关。如曲虫添加量为0.1 g/7 kg时,大曲经过9个月的贮存,淀粉含量下降为58 g/100 g大曲,而添加量为1.0 g/7 kg时淀粉含量下降为55.37 g/100 g大曲。在贮存的7、8、9月份,大曲中淀粉含量的降低速度略有放缓,其可能原因是贮存7、8、9个月对应的是10月、11月和12月份,这段时间曲虫活动减少,取食减少。
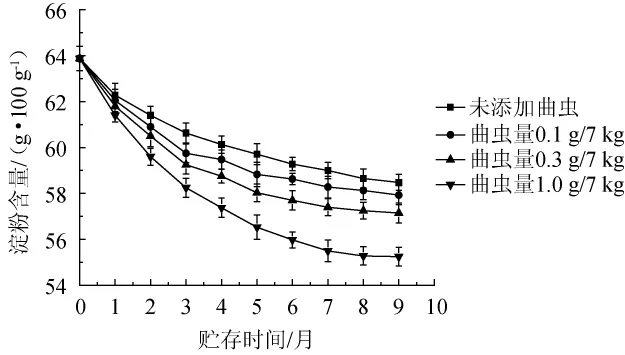
图5 曲虫数量对大曲淀粉含量的影响Fig.5 Effect of Daqu insects number on the starch content of Daqu
2.7 大曲糖化力的变化
曲虫数量对大曲糖化力的影响结果见图6,由图6可知,大曲在贮存过程中糖化力总体上呈先上升后下降的趋势。当曲虫的添加量为0.1 g/7 kg和0.3 g/7 kg时,在贮存的前两个月,大曲糖化力较未添组略有增加,在贮存2~6个月呈现波动但略有下降的变化,当贮存时间超过6个月后,大曲糖化力有一定程度的下降,且低于未添组的糖化力。糖化力的改变与霉菌的变化趋势有一定相关,但不完全一致,可能是其他种类的微生物对大曲的糖化力有一定的贡献。当曲虫的添加量为1.0 g/7 kg时,大曲从贮存初期糖化力的增加就较其他组低,而后呈现一个持续的下降,这可能是曲虫数量较多导致各种微生物数量的降低造成的。
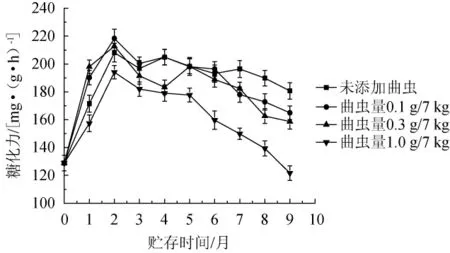
图6 曲虫数量对大曲糖化力的影响Fig.6 Effect of Daqu insect number on the saccharification of Daqu
2.8 大曲液化力的变化
曲虫数量对大曲液化力的影响见图7。由图7可知,大曲的液化力在贮存前4个月有所上升,贮存到第4个月时达到最大值,贮存时间超过4个月后液化力呈现下降的趋势。整体上看,未添组大曲的液化力较曲虫添加组高。随曲虫添加量的增加,添加组的大曲液化力降低幅度分别下降了4.3%、6.3%、8.8%。当曲虫的添加量为0.1 g/7 kg和0.3 g/7 kg时,大曲在贮存前2个月时,液化力的平均值>未添加组,而添加量为1.0 g/7 kg时,前两个月的平均值远<未添加曲虫组。说明曲虫的数量对大曲液化力有显著的影响,控制曲虫数量有利于保证大曲的液化力要求。
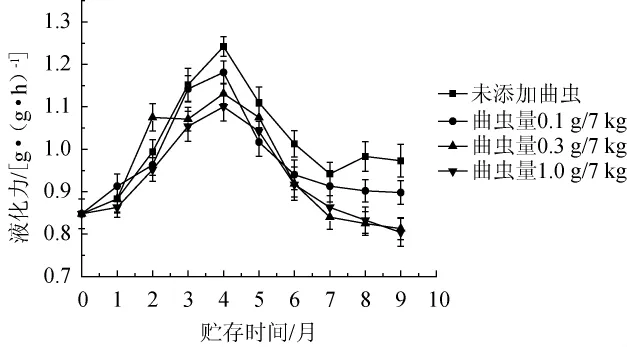
图7 曲虫数量对大曲液化力的影响Fig.7 Effcet of Daqu insects number on the liquefying power of Daqu
2.9 大曲酯化力的变化
曲虫数量对大曲酯化力的影响见图8,由图8可知,添加曲虫对大曲酯化力的影响较小。曲虫添加量分别为0.1g/7kg、0.3 g/7 kg和1.0 g/7 kg时,与未添加曲虫组相比,大曲酯化力与未添加组相比改变量分别为0.6%、0.7%和5%。当曲虫的添加量为0.1 g/7 kg和0.3 g/7 kg时,贮存期在1~4月时,添加组的酯化力高于未添加组,而贮存期超过5个月后,添加曲虫组的酯化力<未添组。当曲虫的添加量为1.0 g/7 kg时,大曲的酯化力一直低于未添加组的酯化力。可能原因是,随着曲虫在在贮存过程中的生长与繁殖,曲虫数量的增加会导致大曲中产生酯酶的微生物数量的降低。
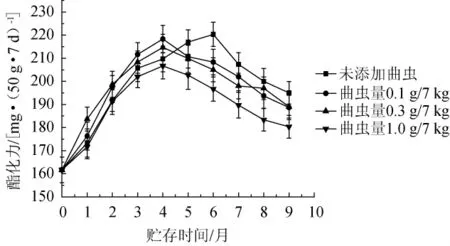
图8 曲虫数量对大曲酯化力的影响Fig.8 Effect of Daqu insects number on the esterification power of Daqu
2.10 大曲酒化力的变化

图9 曲虫数量对大曲酒化力的影响Fig.9 Effect of Daqu insects number on the liquor yield of Daqu
曲虫数量对大曲酒化力的影响见图9。由图9可知,当曲虫的添加量分别为0.1 g/7 kg和0.3 g/7 kg时,大曲的酒化力呈一定的动态变化,大曲经过9个月的贮存,酒化力与未添加组相比分别改变了1.2%vol和2.3%vol,特别是贮存时间超过6个月后,酒化力与未添加组相比有显著的下降。当曲虫的添加量为1.0 g/7 kg时,大曲的酒化力有较大幅度降低,储存9个月后,大曲的酒化力改变为5%vol。整体上来看,曲虫添加组酒化力的降低速度与未添加组相比较快,特别是曲虫添加量为1.0 g/7 kg时,降低速度最明显。
2.11 曲虫数量对大曲香味物质的影响
曲虫数量对大曲香味物质影响的结果见表2、表3。由表2、3可看出,随着曲虫数量添加的增多,酱香型大曲贮存6个月后香味物质的种类有显著的差别。未添加曲虫组和添加量为0.1 g/7 kg、0.3 g/7 kg、1.0 g/7 kg的试验组中香味物质的种类分别为61种,49种、36种和26种,添加0.1 g/7 kg、0.3 g/7 kg、1.0 g/7 kg组香味物质总量分别为未添加组的78.35%、19.89%和15.02%,其中酯类物质总量分别为未添加组的48.95%、31.82%和37.29%,吡嗪类物质总量分别为未添加组的51.40%、51.46%和10.45%,可知随着曲虫数量增加曲虫活动对香味物质的影响较大,这可能是曲虫活动强烈会减弱大曲酱香味的原因[20-21]。亚油酸乙酯、4-甲基-2,6-二叔丁基苯酚、α-檀香醇等只在添加曲虫组检出,壬醛、2-戊基呋喃、3-甲基丁醛等在曲虫添加组含量较未添加组高,可能与大曲的异杂味有关,需要进一步的试验验证。
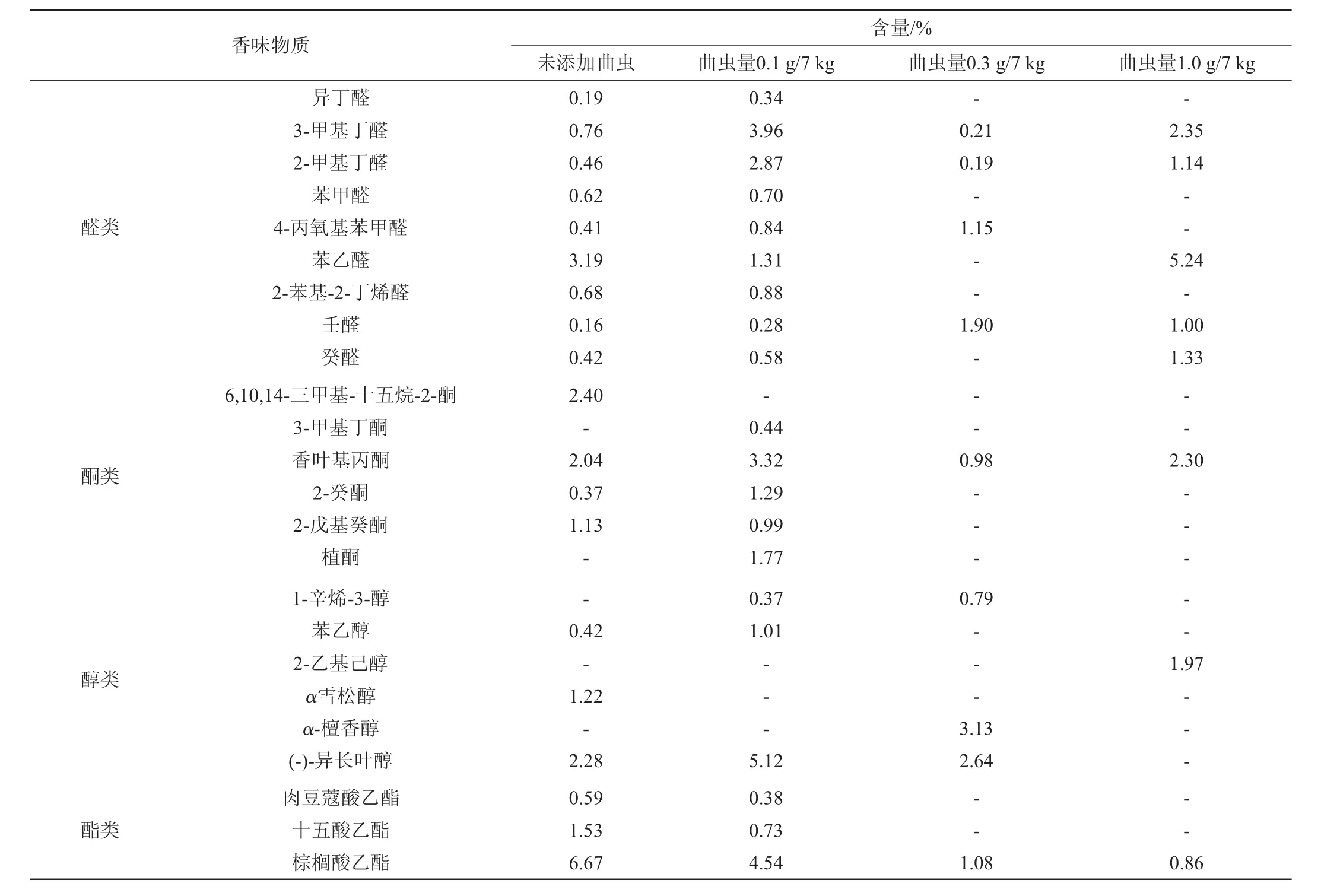
表2 曲虫数量对大曲香味物质的影响Table 2 Effect of Daqu insects number on the flavoring substances of Daqu

续表

表3 曲虫数量对大曲香味物质的影响Table 3 Effect of Daqu insects number on the flavoring substances of Daqu
3 结论
曲虫数量对酱香型大曲的感官具有较大的影响,在7kg大曲中曲虫量为0.3g以下时,大曲的曲香味保持持久,酱香味积累较快,曲块的色泽能够保持优异淡黄色,大曲中异杂味出现的时间晚,而曲虫量为1.0 g/7 kg时,大曲的曲香散失较快,酱香味积累慢,色泽容易变差,异杂味出现早,且异杂味最终比较严重。甚至能导致大曲的曲香味和酱香味消失。
酱香型大曲贮存过程中水分、淀粉含量随曲虫添加量的增加而逐渐降低;当曲虫量为0.1 g/7 kg时,霉菌、糖化力则在贮存前期略高于而后期则低于未添加曲虫组,而菌落总数在超过5个月后仍高于未添加组,酯化力和酒化力的改变不大;当曲虫量为1.0 g/7 kg时,大曲的各项指标都低于未添加对照组。
曲虫对酱香型大曲的香味物质有着较大的影响,随着曲虫数量的增加,其种类和总量不断减少。当曲虫量为0.1 g/7 kg时,对大曲香味物质的影响相对较小;当曲虫量为1.0 g/7 kg时,香味物质种类和总量分别减少了57.38%和84.98%。因此,采取有效措施控制曲虫量在0.3 g/7 kg以下时,对保证大曲质量有着重要意义。

