骆驼斯氏副柔线虫NCC基因原核表达载体的构建及生物信息学分析
赵学亮,冯陈晨,孙 柯,王梦雅,王文龙*
(1.内蒙古农业大学兽医学院/农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018;2.内蒙古农业大学动物科学学院,内蒙古呼和浩特 010018)
骆驼在动物学分类上属于脊索动物门(Chordata)、骆驼科(Camlidae)、骆驼属(Camelus)[1],因其极耐干渴,不怕炎热和寒冷,适于在沙漠行走,故有“沙漠之舟”的美称。近年来,内蒙古乃至全国养驼业的发展呈现逐年萎缩的态势,骆驼存栏数量急剧减少,已处于濒危状态,2014年阿拉善双峰驼再次被列入《中华人民共和国畜牧法》国家级畜禽品种保护名录。分析骆驼数量锐减的原因,除环境和生产方式改变以外,寄生虫病是造成骆驼数量锐减的主要原因之一[2]。有资料报道,在大多数养驼国家,寄生虫病占骆驼发病总数的30%以上,而内蒙古地区骆驼斯氏副柔线虫病感染率曾高达90%以上。斯氏副柔线虫病(Parabronemosis)是由斯氏副柔线虫(Parabronemaskrjabini)寄生在骆驼真胃中所引起的一种寄生虫病。除骆驼以外,牛、羊等反刍动物也可感染,但以骆驼最易感染并且是其最适宜的宿主[3-4]。斯氏副柔线虫属于柔线科(Habronematidea)、副柔亚科(Parabronematinae)、副柔属(Parabronema))[5]。当骆驼大量感染斯氏副柔线虫后,可引起骆驼生长发育迟缓,营养不良,贫血甚至死亡,给养驼业和农牧民带来巨大的经济损失。
由于骆驼在地域上分布的特殊性,国内外对骆驼斯氏副柔线虫病的研究甚少。目前,有关骆驼斯氏副柔线虫形态学及传播媒介的研究逐渐清晰[6],赵治国[7]等捕捉了内蒙古骆驼主产区的蝇类并进行生物学剖检,确定西方角蝇和截脉角蝇是斯氏副柔线虫的传播媒介。同年,张晓东等[8]利用斯氏副柔线虫ITS序列构建系统进化树,明确了副柔属的归科问题,副柔属归类于柔线科。邓侨等[9]在2017年详细描述了西方角蝇和截脉角蝇各虫态的形态特征,确定了多处可用于区分两种角蝇卵、2期幼虫、3期幼虫、蛹和成蝇的形态特征差异。冯陈晨等[10]在2017年对斯氏副柔线虫进行了转录组测序,构建出转录组学图谱。
前人在斯氏副柔线虫的研究中取得了阶段性成果,但对斯氏副柔线虫组学研究还很匮乏,尤其是对其生物信息学分析的研究甚少。本研究参考已报道的线虫免疫学诊断抗原的特点,筛选高通量测序转录组数据,通过Blastx比对确定与表皮胶原蛋白相关的候选基因NCC,通过克隆斯氏副柔线虫NCC基因的CDS区,构建原核表达载体pET30a(+)-NCC,用生物信息学方法分析该基因结构、理化性质、抗原表位等,为斯氏副柔线虫新药物靶点发掘、NCC蛋白功能及其作用机制的研究奠定理论基础,同时也为骆驼斯氏副柔线虫病生前诊断方法的建立提供参考。
1 材料与方法
1.1 材料
1.1.1 虫体和菌株 斯氏副柔线虫样本采自于内蒙古自治区巴彦淖尔市乌拉特后旗双峰驼真胃。根据雌、雄虫的不同形态特征,在显微镜下鉴定,并分装标记后存放液氮中保存。
试验所用菌株E.coliDH5α、E.coliBL21(DE3)均购自北京全式金生物有限公司;质粒载体,克隆载体pMD19-T购自宝生物工程有限公司,表达载体pET-30a(+)由本实验室保存。
1.1.2 主要试剂 总RNA提取试RNAiso Plus、限制性内切酶XhoⅠ、EcoRⅠ、T4DNA连接酶、DNA Marker,TaKaRa公司产品;质粒小提试剂盒、DNA凝胶回收试剂盒,AXYGEN公司产品。
1.2 方法
1.2.1 Total RNA提取与反转录 斯氏副柔线虫Total RNA提取步骤按照RNAiso Plus(Trizol法)说明书操作。将获得的Total RNA进行纯度和浓度检测后,根据反转录试剂盒(Primer ScriptTMRT reagent Kit,TaKaRa),以Total RNA为模板反转录合成cDNA。
1.2.2 扩增目的基因 NCC序列来自本实验室骆驼斯氏副柔线虫转录组测序数据,利用Primer5.0和Oliga6.24软件设计NCC基因的特异性引物,由华大基因有限公司合成。上游引物F:5′-CCGGAATTCATGGGTCTGATGGATGATAC-3′(下划线为EcoRⅠ酶切位点);下游引物R:5′-CCACTCGAGCCTTTCAGGTTGTGCGCTAA-3′(下划线为XhoⅠ酶切位点)。以cDNA为模板,用高保真酶进行NCC基因CDS区的PCR扩增,反应条件为:94℃ 5 min;94℃ 1 min,55℃ 1 min,72℃ 90 s,31个循环;72℃ 5 min。将PCR产物用10 g/L琼脂糖凝胶电泳检测。
1.2.3 pET30a(+)-NCC重组质粒的构建 从测序结果正确的菌株中提取克隆质粒(命名为pMD-NCC),将pMD-NCC和表达载体pET30a(+)分别用限制酶EcoRⅠ、XhoⅠ双酶切后,以凝胶回收试剂盒回收目的基因和载体片段,用T4 DNA连接酶连接构建NCC基因原核表达载体(命名为pET30a(+)-NCC)并转化大肠埃希菌BL21(DE3)感受态细胞。在含卡那霉素的固体LB培养基培养后,挑取单菌落分别进行PCR和质粒双酶切鉴定,阳性菌株送华大基因公司进行双向序列测定。
1.2.4 NCC基因生物信息学分析 利用Prot-Param在线软件分析NCC蛋白的氨基酸序列组成和理化性质;蛋白质的疏水性在其构象、三级结构的稳定性等方面都起着至关重要的作用[11],利用ProtScale软件分析氨基酸残基的疏水性;利用DNA Star软件中的Kyte-Doolittle方法和Hopp-Woods方法对NCC蛋白的亲水性进行分析;SOPMA在线软件分析蛋白质的二级结构;利用TMHMM Server软件进行跨膜区结构预测;SignaIP 4.1 Server在线软件进行信号肽分析;NetPhos 3.0 Server软件预测磷酸化位点;利用DNAStar预测NCC蛋白质表面可行性,可塑性,B/T细胞抗原表位等。
2 结果
2.1 目的基因的PCR扩增
经PCR扩增出的NCC大小为711 bp,与预期目的基因片段大小一致(图1)。
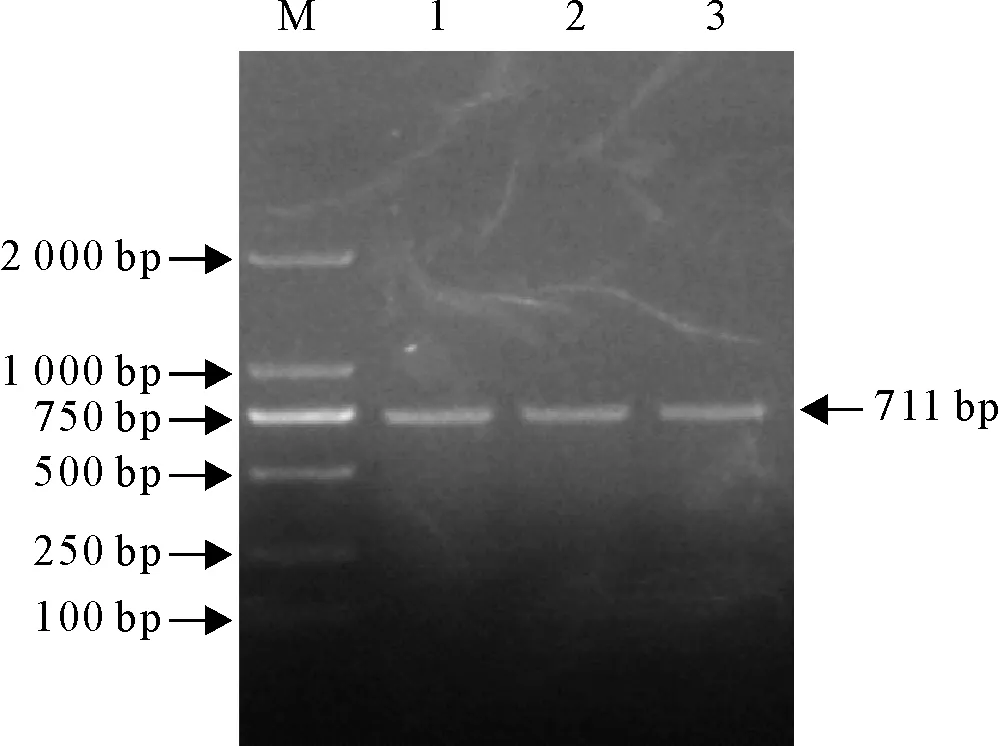
M.DNA 标准DL 2 000;1~3.NCC基因产物M.DNA Marker DL 2 000;1-3.Products of NCC gene
2.2 重组表达质粒的鉴定
将阳性重组质粒进行双酶切鉴定,结果与预期大小相符(图2),表明pET30a(+)-NCC质粒构建成功。经过测序后,未发现基因突变,重组基因与目标基因序列完全一致。
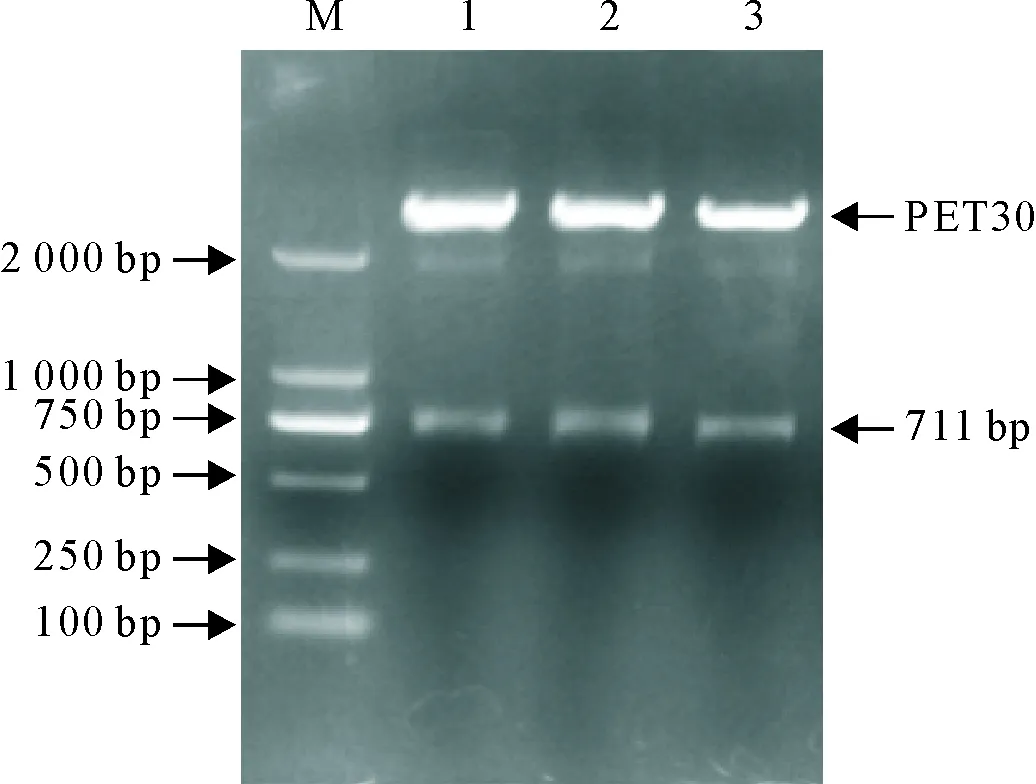
M.DNA 标准DL 2 000;1~3.重组质粒的双酶切产物
M.DNA Marker DL 2 000;1-3.Enzyme digestion products of recombinant plasmid
图2重组质粒pET30a(+)-NCC的双酶切鉴定
Fig.2 Enzyme digestion identification of recombinant plasmid
pET30a(+)-NCC
2.3 NCC基因的生物信息学分析
2.3.1 NCC蛋白理化性质分析 利用在线软件Prot-Param分析其氨基酸序列组成和理化性质,结果为蛋白质理论大小值为25.252 3 ku,理论等电点为6.33,分子式为C1086H1699N321O355S10,其氨基酸组成如表1所示,包含20种氨基酸,含量最高的是Gly占15.2%,含量最低的是Trp占0.8%;带负电荷数(Asp+Glu)为28个,带正电荷数(Arg+Lys)为27个;蛋白质不稳定指数(instability index)为40.08,是不稳定蛋白(注:不稳定系数小于40,说明蛋白稳定,反之则不稳定);脂肪系数(aliphatic index)为58.8;总平均亲水性(grand average of hydropathicity)为-0.559,是亲水性蛋白质;NCC蛋白在体外哺乳动物类网状红细胞中的半衰期为30 h,在酵母体内的半衰期大于20 h,在大肠埃希菌体内的半衰期大于10 h。
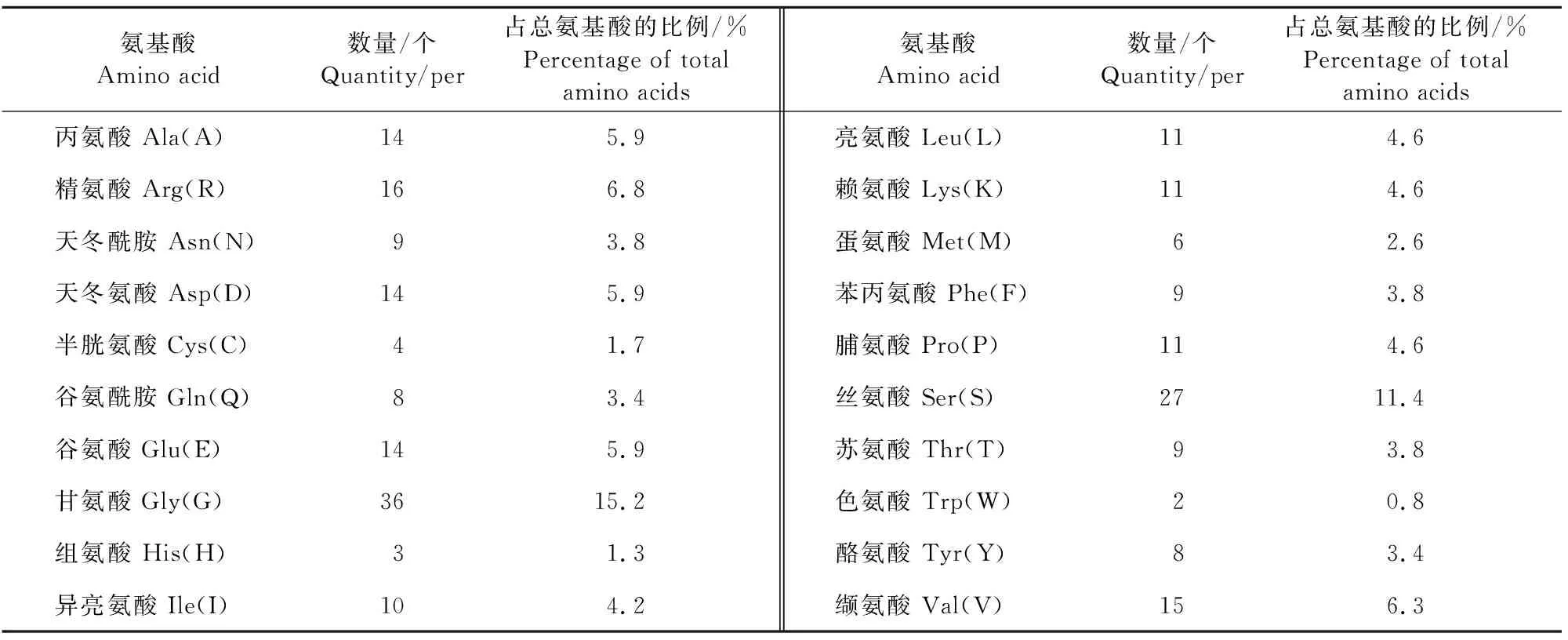
表1 NCC蛋白质的氨基酸组成
2.3.2 NCC蛋白的疏水性分析 应用软件ProtScale分析NCC蛋白氨基酸残基的疏水性,由图3可知其疏水性最大值为1.932,最小值为-1.979,为亲水性蛋白,与ExPAsy-Prot Param在线分析软件得到的结果一致。
2.3.3 NCC蛋白磷酸化位点的预测 蛋白质磷酸化位点可以通过酶促反应调控蛋白质之间的相互作用,在细胞信号转导的过程中起重要作用。细胞内参与磷酸化的氨基酸主要有丝氨酸、苏氨酸和酪氨酸。利用在线软件NetPhos2.0 Server对NCC蛋白进行磷酸化位点的预测,如图4可知,当潜在磷酸化位点的阈值为0.5时,NCC蛋白存在27个潜在的磷酸化位点,其中包括23个丝氨酸位点,1个苏氨酸位点,3个酪氨酸位点。
2.3.4 NCC蛋白跨膜结构和信号肽预测 通过在线工具TMHMM/TMpred和SignalP4.0预测NCC蛋白跨膜结构和信号肽。通过TMHMM预测结果(图5)中展示了1个跨膜区,从输出的文本文件中确定NCC蛋白在21-43位置存在1个跨膜区。利用TMpred在线软件分析NCC蛋白的跨膜螺旋特征,根据跨膜拓扑学分析模型可知,值大于500时该蛋白具有跨膜螺旋特征,而NCC蛋白数值大部分在500以下(图6),NCC蛋白具有一个明显的跨膜螺旋特征,与TMHMM预测结果一致。利用SignalP和SecretomeP软件对NCC蛋白的信号肽序列预测分析发现NCC不存在信号肽,但是在SecretomeP软件预测中被认为是非典型分泌蛋白NN-Score=0.929(若NN-Score﹥0.5,判定为分泌蛋白)(图7)。
2.3.5 NCC蛋白的二级结构预测 利用在线软件Phyre2对NCC蛋白的二级结构进行预测,结果显示参与α螺旋的氨基酸有63个,占26.58%,参与构成β-折叠的氨基酸有26个,占10.97%,参与构成延伸链的氨基酸有34个,占14.35%,参与构成无规卷曲的氨基酸有114个,占48.1%。
2.3.6 NCC蛋白的亲水性分析 利用DNA Star软件中的Kyte-Doolittle方法和Hopp-Woods方法对NCC蛋白的亲水性进行分析,结果(图8)显示,NCC亲水性区域主要分布在:3-17、58-69、79-97、108-151、153-194、203-226等氨基酸残基,在NCC蛋白的18-42氨基酸残基有很大的疏水性,与ExPASy-ProtScale软件预测趋于一致。
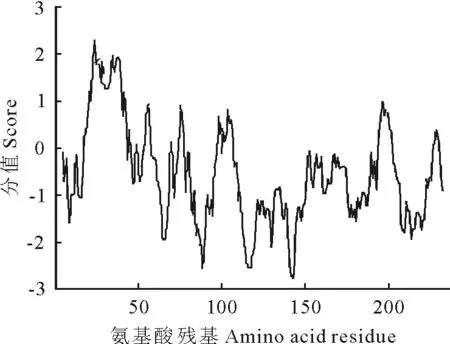
图3 NCC蛋白疏水性结果
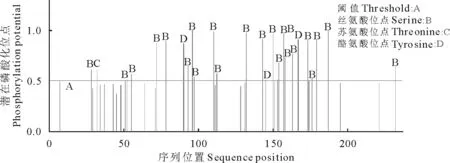
图4 NCC蛋白磷酸化位点的预测
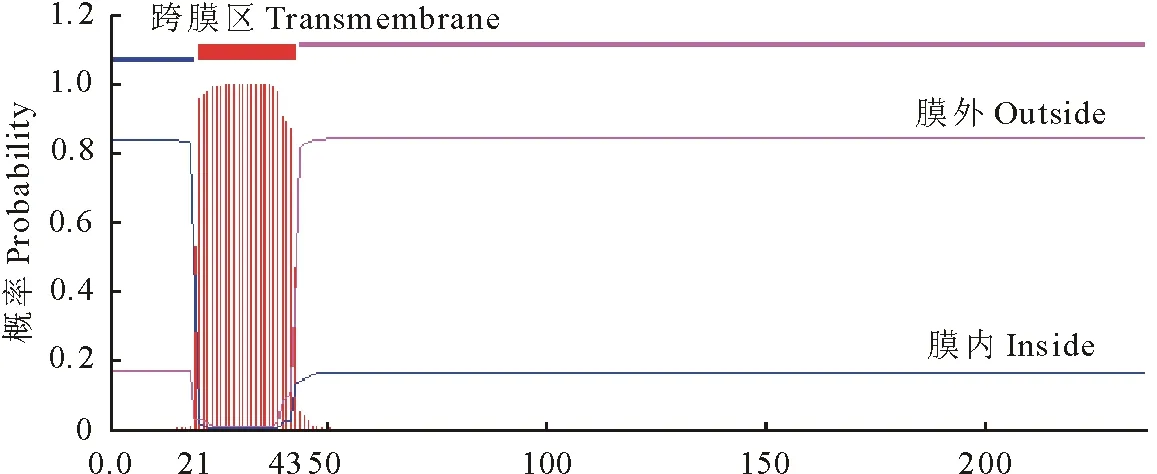
图5 NCC蛋白跨膜结构预测

图6 NCC蛋白跨膜螺旋预测
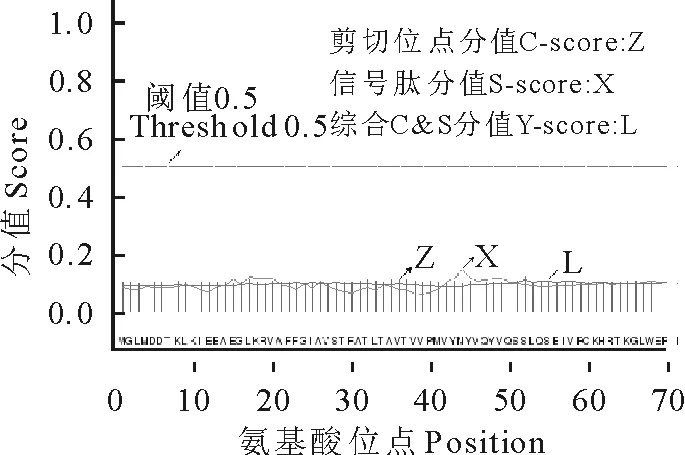
图7 NCC基因信号肽预测
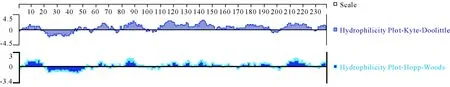
图8 NCC蛋白的亲水性分析
2.3.7 NCC蛋白的表面可及性分析 采用Emini方法预测NCC蛋白的表面可及性,表面可及性较高区域位于NCC蛋白分子表面,可及性较低区域埋藏于分子内部的区域。由图9可见,NCC蛋白的氨基酸呈现在表面可能性较大的区域主要是5-12、83-93、110-121、127-132、138-147、206-223、177-183、232-237等氨基酸残基,其他部位展示的可能性较小或表现为负值。
2.3.8 NCC蛋白的表面可塑性分析 应用DNA Star软件中Karplus-Schulz方法对NCC蛋白质骨架区的柔韧性进行分析,结果(图10)显示,韧性较高区域有5-18、50-56、62-67、76-87、90-100、112-166、171-192、200-227、233-234氨基酸残基。这些区域可能具有一定的柔韧性,形成抗原表位的可能性较大,易与抗体进行嵌合。
2.3.9 NCC蛋白的B细胞抗原表位预测 采用Jameson-Wolf方法对NCC蛋白的B细胞抗原表位进行预测(图11)。然后根据NCC的二级结构预测及其表面特性,蛋白质亲水性、表面可及性、柔韧性等综合分析所预测的NCC蛋白的B细胞抗原表位。NCC存在8个潜在的B细胞抗原表位位点,在3-18、50-55、60-69、75-99、110-168、171-197、203-227、229-237位氨基酸处具有较高的抗原性,可能是B细胞抗原表位的优势区段。
2.3.10 NCC蛋白的T细胞抗原表位预测 T细胞表位是可以被TCR识别的抗原表位。利用AMPHI方法预测免疫优势辅助性T淋巴细胞抗原位点,Rothbard-Taylor方法预测含有特定基序(motif)的潜在T淋巴细胞抗原决定簇。综合两种方法预测T细胞抗原表位(图12),NCC蛋白的T细胞抗原表位可能有11个,主要位于2-5、13-22、24-38、45-53、66-69、73-84、105-119、128-130、132-137、141-150、158-167氨基酸残基。
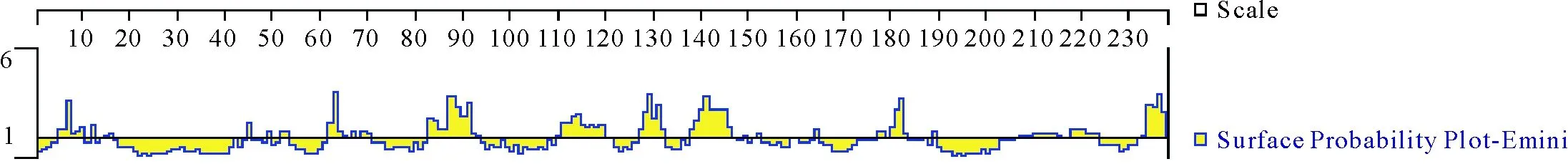
图9 NCC蛋白表面可能性区域

图10 NCC蛋白的表面柔韧性区域
Fig.10 Flexible regions of NCC protein
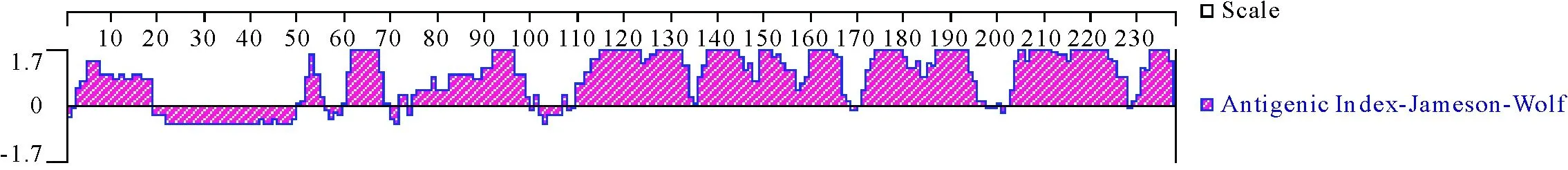
图11 NCC蛋白B细胞抗原表位的预测

图12 NCC蛋白T细胞抗原表位的预测
3 讨论
由于骆驼主要分布于经济欠发达国家或地区,导致斯氏副柔线虫病的相关研究较少,到目前为止,其确切的生活史仍未清晰。在斯氏副柔线虫病的防治上,尚缺乏有效的生前诊断方法和防治措施。近20年来,骆驼斯氏副柔线虫病是造成骆驼数量锐减的主要原因之一,严重制约我国养驼业的健康发展。本研究利用原核表达系统构建原核表达载体pET30a(+)-NCC,利用DNA Star预测表皮胶原蛋白NCC基因的抗原表位,为斯氏副柔线虫诊断方法的建立奠定基础,同时为该蛋白DNA疫苗的研究提供了可靠的依据,具有重要的应用价值。
表皮胶原蛋白构成的表皮不仅能够维持虫体的形态和运动,还能够抵抗宿主的防御系统,保护虫体免受外界伤害[12]。表皮胶原蛋白的一级结构具有一段较长的氨基酸区间,由 Gly-X-Y 序列重复形成,其中 Gly 的位置属于甘氨酸(Gly),X 的位置属于脯氨酸(Pro),Y 的位置氨基酸种类不固定。通过在线软件Prot-Param分析显示,NCC蛋白的氨基酸序列中Gly和Pro含量较高,分别占11.4%和5.9%。这一结果表明骆驼斯氏副柔线虫NCC蛋白存在与表皮胶原蛋白共有的结构特征。根据李文娜[13]报道,旋毛虫感染期表皮胶原蛋白附着一层外衣,正是由于这层外衣的存在,使得抗体血清无法识别胶原蛋白,除去外衣之后,体表皮断面上的抗原可以被识别,而隐蔽的胶原蛋白抗原表位可以作为骆驼斯氏副柔线虫病疫苗的候选抗原。
生物信息学是近年来发展起来的一种高效的研究手段,促进了生物学研究领域的快速发展[14]。在寄生虫的研究上,也得到了广泛的应用[15]。本研究克隆了斯氏副柔线虫与表皮胶原蛋白有关基因NCC编码序列,成功构建原核表达载体pET30a(+)-NCC。通过生物信息学软件对骆驼斯氏副柔线虫NCC蛋白氨基酸组成与理化性质构预测。NCC是亲水性蛋白,亲水区的存在有利于蛋白的高效表达。蛋白质二级结构的预测是联系一级结构和三级结构的纽带,NCC蛋白二级结构包括α螺旋、β折叠、无规则卷曲和延伸链,属于混合型蛋白[16],转角和无规则卷曲二级结构比较松散,故该区域有可能与抗原表位有关[17]。利用DNA Star对斯氏副柔线虫NCC蛋白的B细胞抗原表位进行预测,从该蛋白的亲水性、表面可及性与可塑性等方面进行分析。说明该蛋白亲水性多肽较多,其合成的多肽很可能易溶于水;表面可及性较高区域可能位于NCC蛋白分子表面;该蛋白的柔韧性区域较多,形成抗原表位的可能性较大,易与抗体进行嵌合。综合分析可知骆驼斯氏副柔线虫NCC既含有较多潜在的B细胞抗原表位,又有较多潜在的T细胞抗原表位。本试验为进一步氏副柔线虫病诊断方法的建立和免疫防治研究提供参考。

