复合酶水解卵白蛋白及其特性与结构分析
刘丽莉 陈 珂 李 玉 代晓凝 孟圆圆
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
中国是世界上第一鸡蛋生产大国,蛋品深加工比例却不到1%[1],这种现状严重限制了中国蛋品行业的发展。鸡蛋清粉是蛋品深加工中产量最大的制品之一,但它的功能特性及局限性影响了其在食品加工中的应用。卵白蛋白又称卵清蛋白(Ovalbumin, OVA),是鸡蛋清中的主要成分,其分子量为44.5 kDa[2]。等电点为4.5,由4个自由巯基和1个包埋在OVA中心的二硫键组成[3]。OVA中疏水氨基酸含量为50%[4]。OVA作为模式蛋白能较好地体现鸡蛋清的功能特性。
目前,提高蛋白质的功能特性主要是通过对蛋白质改性实现的[5]。国内外关于鸡蛋清蛋白改性的报道有很多,如许美玉等[6]通过碱性蛋白酶酶解改善OVA的乳化性,并优化了酶解工艺条件,使其酶解OVA的乳化活性较未改性OVA提高了89.61%。Lechevalier等[7]研究了干热处理对蛋清粉功能、营养和过敏性的影响。Xiong等[8]研究了高强度超声波(HIUS)对OVA结构和性质的影响。本课题组[9]前期利用碱性蛋白酶对OVA进行酶解处理,发现酶解后OVA溶解度和乳化性明显提高。酶法改性可以将大分子的蛋白质降解成小分子肽甚至更小的氨基酸,同时产生具有生物活性的物质,从而提高了人体对其的消化吸收[10]。
市场上的鸡蛋清粉由于溶解度差、腥味重等缺点限制了其在食品加工中的应用,所以需要应用适当的方法对蛋清粉进行改性以开发出功能特性较好的蛋清粉。而针对OVA改性的探讨对提高整体蛋清粉的功能特性起到关键作用。生物酶解改性方法是当前蛋白质较为理想的改性方法,它具有安全、高效、作用条件温和的优点。但目前针对酶解OVA改性的相关文献研究[6, 9]多集中在单一酶源的筛选和应用,OVA的水解度偏低,而且缺乏针对酶解改性后OVA特性与结构的深入分析。本试验拟在前期单一酶酶解OVA试验[9]基础上,采用复合酶对OVA进行酶解改性,以提高OVA的功能特性从而开发出高附加值的功能性蛋清粉,为鸡蛋深加工制品提供一种新途径。
1 材料与设备
1.1 材料与仪器
1.1.1 材料与试剂
木瓜蛋白酶(1.0×104U/g)、中性蛋白酶(5.0×104U/g)和风味蛋白酶(1.6×104U/g):上海蓝季生物有限公司;
酒石酸钾钠:分析纯,济南金日和化学试剂有限公司;
溴酚蓝、溴化钾:分析纯,上海一研生物有限公司;
尿素、三羟甲基氨基甲烷:分析纯,上海山浦化工有限公司。
1.1.2 仪器与设备
高速分散均质机:HD-1604型,北京杰瑞恒达科技有限公司;
磁力加热搅拌器:78-1型,深圳美达仪器有限公司;
高速分散均质机:HD-1604型,北京杰瑞恒达科技有限公司;
超速冷冻离心机:H1650型,北京兴达恒信科技有限公司;
全自动凯氏定氮仪:K9860型,济南海能仪器股份有限公司;
磁力加热搅拌器:78-1型,深圳美达仪器有限公司;
荧光分光光度计:Cary eclipse型,美国Aglient公司;
扫描电镜:EM-30Plus型,韩国COXEM公司。
1.2 方法
1.2.1 OVA的酶解工艺 称取一定质量的OVA粉溶解于蒸馏水中,配制成OVA溶液,调节温度和pH,加入一定量的复合酶,再滴加NaOH来维持pH值恒定,反应一段时间后,置于90 ℃水浴中灭酶10 min,冷却后于10 000 r/min离心10 min,取上清液测水解度,将上清液冷冻干燥,即得OVA肽。
1.2.2 复合酶配比选择 配制3%蛋白浓度的OVA溶液,pH为8,总酶量5 000 U/g(木瓜蛋白酶、中性蛋白酶和风味蛋白酶的质量比分别为2∶1∶1,1∶1∶2,1∶2∶1),在50 ℃ 的水浴锅中加热4 h,测定其水解度。并以3种单一酶作为对照。
1.2.3 OVA酶解工艺优化
(1) pH的选择:固定酶解时间6 h,底物OVA浓度5%,加酶量8 000 U/g,温度60 ℃,分别考察不同pH(5,6,7,8,9)对酶解反应水解度的影响。
(2) 酶解时间的选择:固定pH 7,底物OVA浓度5%,加酶量8 000 U/g,温度60 ℃,分别考察不同酶解时间(2,4,6,8,10 h)对酶解反应水解度的影响。
(3) 底物OVA浓度的选择:固定pH 7,酶解时间6 h,加酶量8 000 U/g,温度60 ℃,分别考察不同底物OVA浓度(2%,3%,4%,5%,6%,7%)对酶解反应水解度的影响。
(4) 加酶量的选择:固定pH 7,酶解时间6 h,底物OVA浓度5%,温度60 ℃,分别考察不同加酶量(4 000,5 000,6 000,7 000,8 000,9 000 U/g)对酶解反应水解度的影响。
(5) 温度的选择:固定pH 7,酶解时间6 h,底物OVA浓度5%,加酶量8 000 U/g,分别考察不同温度(40,45,50,55,60,65 ℃)对酶解反应水解度的影响。
1.2.4 OVA酶解的响应面优化试验 在单因素试验基础上,利用Design-Expert 8.0.5软件,以水解度为响应值,设计五元二次通用旋转组合试验。
1.2.5 水解度测定 采用甲醛滴定法测定氨基态氮含量,凯氏定氮法测定总氮含量[11]。水解度(DH)按式(1)计算:
(1)
式中:
DH——水解度,%;
N1——上清液中氨基态氮含量,mol/L;
N0——样品中总氮含量,mol/L。
1.2.6 OVA功能特性的测定
(1) 持水性和持油性的测定:称取0.1 g待测样品于离心管中称量总重,加入3 mL水(或大豆油),静置30 min后,于10 000 r/min离心10 min,称量沉淀与离心管总重[12]。按式(2)计算蛋白质持水性和持油性。
(2)
式中:
WAC——蛋白质持水性,g/g;
OAC——蛋白质持油性,g/g;
W0——待测样品的重量,g;
W1——待测样品和离心管的总重量,g;
W2——沉淀与离心管总重量,g。
(2) 表面疏水性的测定:参照Chelh等[13]的方法,将OVA、OVA肽分别溶于pH 7.4 Tris-HCl缓冲液中,加入1 mg/mL 溴酚蓝溶液200 μL,于10 000 r/min离心10 min,取上清液稀释10倍后在595 nm处测定吸光值,以Tris-HCl缓冲液为空白,以1 mL pH 7.4的Tris-HCl缓冲液加1 mg/mL 溴酚蓝为对照。蛋白质表面疏水性按式(3)计算:
(3)
式中:
SH——蛋白质表面疏水性,%;
A0——1 mL pH 7.4的Tris-HCl缓冲液加1 mg/mL溴酚蓝为对照的吸光值;
A1——上清液稀释10倍后在595 nm处测定吸光值。
(3) 浊度的测定:取一定量的OVA、OVA肽分别加入pH 7.4的Tris-HCl缓冲液,配制成2.5 mg/mL溶液,于6 000 r/min 均质1 min,使其充分溶解,以不加样品的Tris-HCl缓冲液作为空白组,在340 nm处测定样品吸光度值(A340 nm),吸光值表示其浊度[14]。
1.2.7 OVA结构表征
(1) 化学作用力的测定:根据文献[15]的方法,修改如下,准确称取1 g OVA和OVA肽,分别加入10 mL的0.05 mol/L NaCl(SA)、0.6 mol/L NaCl(SB)、0.6 mol/L NaCl+1.5 mol/L尿素(SC)、0.6 mol/L NaCl+8.0 mol/L尿素(SD)、0.6 mol/L NaCl+8.0 mol/L尿素+1.5 mol/Lβ-巯基乙醇(SE),于10 000 r/min均质1 min后,4 ℃静置2 h,然后于10 000 r/min冷冻离心10 min,取上清液。采用标准曲线法计算上清液中不同蛋白质含量。分别按式(4)~(7)计算离子量含量、氢键含量、疏水相互作用含量和二硫键含量。
IC=C2-C1,
(4)
HB=C3-C2,
(5)
HI=C4-C3,
(6)
DB=C5-C4,
(7)
式中:
IC——离子量含量,%;
HB——氢键含量,%;
HI——疏水相互作用含量,%;
DB——二硫键含量,%;
C1——溶解于SA的蛋白质含量,%;
C2——溶解于SB的蛋白质含量,%;
C3——溶解于SC的蛋白质含量,%;
C4——溶解于SD的蛋白质含量,%;
C5——溶解于SE的蛋白质含量,%。
(2) 荧光光谱分析:将待测样品溶于pH 7.4的Tris-HCl缓冲液中,配制成浓度为1 mg/mL的蛋白溶液,激发和发射单色器的带宽均为5 nm,在激发波长为295 nm,扫描范围300~450 nm的条件下,测定待测样品的荧光发射光谱。
(3) 扫描电镜(SEM)分析:分别将OVA、OVA肽进行喷金处理,再将样品置于扫描电子显微镜下观察样品的微观结构。
1.2.8 数据分析 每个样品重复3次试验,采用Design-Expert 8.0.5软件进行响应面试验设计及方差分析,Origin 8.5软件作图。
2 结果与分析
2.1 复合酶配比的筛选
复合酶配比对OVA水解度的影响见图1。
由图1可知,采用复合酶酶解OVA的水解度显著优于单一酶(P<0.05);而且不同配比的复合酶酶解OVA水解度的顺序为1∶1∶2>1∶2∶1>2∶1∶1,当3种酶的质量比为1∶1∶2时,水解度达到最大值,为26.54%,故3种酶复合的比例选用1∶1∶2。
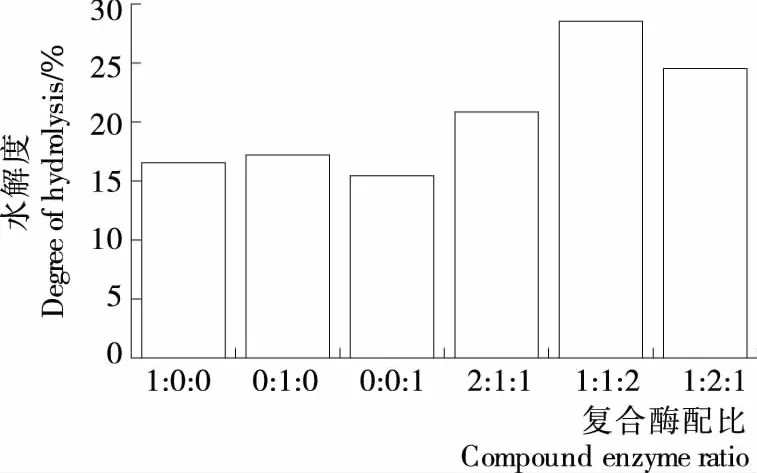
图1 复合酶配比对OVA水解度的影响Figure 1 Effect of enzyme ratio on degree of hydrolysis and of OVA
2.2 单因素试验
不同酶解条件对水解度的影响见图2。
由图2(a)可知,当pH<7时,水解度随着pH升高而升高;当pH>7时,水解度随着pH的升高而下降;当pH为7时,水解度达到最大值。可能是3种酶的最适pH均在7左右[16],当pH>7时,酶的活性受到影响,水解度降低,因此OVA的酶解pH为7时较为适宜。
由图2(b)可知,水解度随着OVA酶解时间的延长,呈先升高后下降的趋势;当酶解时间为6 h时,水解度出现最大值。可能是在一定酶解时间内,随着酶解时间的延长,酶作用在OVA上,使其断裂成大小不一的多肽分子,OVA中可被酶解的肽键逐渐增多,水解度变大;而后随着酶解时间的延长,酶的活性下降,进而造成水解度逐步下降[17]。因此酶解时间选择6 h。
由图2(c)可知,当OVA浓度<5%时,水解度逐渐增加;当OVA浓度>5%时,水解度呈逐渐下降趋势。这可能是当OVA浓度逐渐增大时,复合酶和OVA结合的几率增大,OVA酶解较彻底,水解度逐渐增大;而当OVA浓度继续增大时,导致酶与蛋白之间接触减小,酶解液黏度变大,溶解性降低,OVA酶解进行较慢,从而导致水解度降低[18]。因此,OVA浓度选定为5%。
由图2(d)可知,水解度随着加酶量的增加,呈先增加后减少的趋势。原因是随着加酶量的增加,酶与OVA结合的几率增大,反应速率升高,水解度相应增大;但随着加酶量的增多,底物OVA相对不足,导致反应进程减弱,水解度逐渐减小。因此,加酶量选定为8 000 U/g。
由图2(e)可知,随着温度的升高,水解度先上升后下降;在60 ℃时,水解度达到最大值。可能是温度过高导致蛋白酶变性,从而使酶解反应速率降低[19]。所以,温度选定为60 ℃。
2.3 二次回归正交旋转试验
通过五因素三水平通用旋转试验对复合酶酶解制备OVA肽的工艺进行响应面优化,其试验设计方案及结果见表1、2。

图2 酶解条件对水解度的影响Figure 2 Influence of different enzymatic conditions on degree of hydrolysis表1 五元二次通用旋转组合设计试验因素与水平Table 1 Factors and levels used in second-ordel rotation combination experimental design

水平X1 pHX2 酶解时间/hX3 底物OVA浓度/%X4 加酶量/(U·g-1)X5 温度/℃-26.06.03.07 00050.0-16.56.54.07 50052.507.07.05.08 00055.017.57.56.08 50057.528.08.07.09 00060.0
表2五元二次通用旋转组合试验设计方案及结果
Table 2 Quadratic orthogonal rotary composite experimental design in terms of coded values of five variables and corresponding experimental results

试验号X1X2X3X4X5水解度/%11111127.132111-1-129.68311-11-127.68411-1-1129.4951-111-126.6261-11-1130.9971-1-11130.4681-1-1-1-126.069-1111-127.4110-111-1130.9611-11-11127.5812-11-1-1-126.4513-1-111127.6314-1-11-1-126.6415-1-1-11-125.8116-1-1-1-1125.0917-2000026.55182000028.37190-200027.82200200028.792100-20025.59220020027.1223000-2029.23240002026.79250000-228.12260000230.59270000030.28280000030.59290000030.29300000031.08310000030.12320000031.14
对表2中水解度的试验数据进行多元回归拟合,得到水解度的回归方程为:
(8)
该水解度模型在α=0.05水平下剔除不显著项后的回归方程为:
(9)
2.3.1 方差分析和显著性检验 由表3可知,Y1回归模型的R2=96.43,P<0.000 1,差异极显著,失拟项P=0.158 6>0.05,差异不显著,说明Y1模型的拟合度较高。因此该回归模型可以较好地反映自变量与响应值之间的变化关系。
2.3.2 双因素交互效应分析 由图3可知,响应面呈抛物线形,等高线呈椭圆形,说明底物OVA浓度与加酶量的交互作用对水解度影响极显著,这与表3中显著性分析结果一致。由等高线的变化趋势可看出,当底物OVA浓度低于5.0%~5.5%中某固定值、加酶量低于7 750~8 000 U/g中某固定值时,随着底物OVA浓度与加酶量增加,水解度增加;当底物OVA浓度高于5.0%~5.5%中某固定值、加酶量高于7 750~8 000 U/g中某固定值时,随着底物OVA浓度与加酶量的增加,水解度减小;当底物OVA浓度为5%、加酶量为8 000 U/g时,水解度为30.28%。
由图4可知,酶解时间与加酶量的响应面呈抛物线形且

表3 水解度的方差分析表Table 3 Analysis of variance for the hydrolysis degree

图4 酶解时间与加酶量交互作用对水解度的影响Figure 4 Response surface and corresponding contour plots showing the effect of interaction of hydrolysis time and enzyme dosage on degree of hydrolysis
比较陡峭,等高线呈明显的椭圆形,说明酶解时间与加酶量对水解度影响有极显著的交互作用。由等高线的变化趋势可看出,当酶解时间低于7.0~7.3 h中某固定值、加酶量低于7 750~8 000 U/g中某固定值时,随着底物OVA浓度与加酶量增加,水解度增加;当底物OVA浓度高于7.0~7.3 h中某固定值、加酶量高于7 750~7 938 U/g中某固定值时,随着底物OVA浓度与加酶量的增加,水解度减小。
2.4 利用回归方程确定最佳作用参数和模型验证
经五元二次正交旋转试验及响应面优化法,采用Design Expert 8.0软件和回归方程分析得到复合酶酶解OVA的最佳工艺为:pH 7.5、酶解时间7.29 h、底物OVA浓度5.28%、加酶量7 529.72 U/g、温度56.42 ℃,此时水解度为31.22%。为了提高复合酶酶解制备OVA肽试验的操作性和验证模型的准确性,将预测的最优工艺条件修改为:pH 7.5、酶解时间7 h、底物OVA浓度5%、加酶量7 500 U/g、温度56 ℃。在此条件下做3次重复验证实验,实际测得水解度为(31.03±0.14)%。水解度的实际值与预测值相差0.61%,说明水解度的模型方程与实际结果拟合度良好,证明响应面优化复合酶酶解OVA的工艺条件是可行的。
2.5 复合酶酶解对OVA功能特性的影响
由表4可知,OVA肽的持水性较OVA提高了1.65 g/g。可能是酶解使蛋白分子断裂,形成小分子肽链,从而使其结合水的能力增强,持水性增强[20]。与持水性相反,OVA肽的持油性较OVA降低了1.05 g/g,主要是蛋白的持油性与表面疏水性有关,表面疏水基团减少,与油结合机会减少造成的。OVA肽较OVA的表面疏水性大小明显减小了4.05%(P<0.05),造成的主要原因是复合酶酶解得到的OVA肽的溶解度升高,表面疏水性相应降低[21]。OVA肽的浊度大小呈下降趋势且差异显著[22](P<0.05),这是因为OVA肽是由OVA经酶解得到了分子量较小的多肽或者氨基酸,OVA肽能与水形成氢键,使其溶解度较OVA升高浊度下降[23]。
2.6 复合酶水解OVA结构表征
2.6.1 化学作用力分析 酶解改性对OVA化学作用力即离子键、氢键、疏水相互作用、二硫键的影响见表5。相对于OVA,OVA肽的离子键含量明显减少(P<0.05),这是因为酶解改性使得离子键发生了断裂,导致OVA肽的离子键含量较OVA分别下降6.63%。氢键的稳定性弱于离子键,经酶解处理后的OVA即OVA肽的氢键发生断裂使其含量较OVA明显减少17.29%(P<0.05)。OVA肽的疏水相互作用含量较OVA分别减少4.35%,可能是酶解使蛋白质分子量变小,亲水基团增多,溶解性升高,疏水相互作用减弱;另外,OVA肽的羰氨缩合破坏了蛋白质分子的疏水性相互作用,最终导致OVA肽的疏水相互作用含量较OVA明显减少(P<0.05)。相对于OVA,酶解制备的OVA肽的二硫键含量均明显减少(P<0.05),可能是酶解改性破坏了半胱氨酸残基,使二硫键的形成受阻[24]。

表4 酶解改性对OVA功能性质的影响†Table 4 Effect of the enzymatic modification on functional properties of OVA
† 不同字母表示差异显著(P<0.05)。

表5 酶解改性对OVA化学作用力的影响†Table 5 Effect of the enzymatic modification on chemical reaction of OVA %
† 不同字母表示差异显著(P<0.05)。
2.6.2 荧光光谱分析 对OVA和复合酶酶解制备的OVA肽进行荧光光谱分析,结果见图5。
从图5可以看出,相对于OVA,OVA肽的荧光强度均有所降低;最大吸收峰位置也发生了改变,OVA的最大吸收峰在340 nm处,OVA肽的最大吸收峰红移至345 nm处。可能是荧光强度与表面疏水性呈正相关,酶解改变了OVA的空间构象,使其氢键更加稳定,表面疏水性降低,OVA肽荧光强度减弱。
2.6.3 扫描电镜(SEM)分析 对OVA和复合酶酶解制备的OVA肽进行SEM测定分析,结果见图6。
由图6中可知,OVA为典型的球蛋白,表面光滑,成颗粒状。酶解之后,表面不规则的凹陷消失,颗粒变小。说明酶解改性使其微观结构发生明显变化。

图5 荧光光谱分析Figure 5 Analysis of fluorescence spectroscopy

图6 改性前后OVA的SEM图Figure 6 Scanning electron micrographs of OVA before and after modification
3 结论
本试验研究了木瓜蛋白酶、中性蛋白酶和风味蛋白酶复合酶水解OVA及其特性与结构,确定了3种酶的最佳质量比和最适酶解工艺条件。结果表明,与单一酶相比,复合酶显著性提高了OVA的水解度。通过对改性后的OVA特性分析表明,酶解作用显著提高了OVA的功能特性,如持水性提高、表面疏水性和浊度降低等。为了更加深入地了解OVA相关功能性质变化的机理,通过测定化学作用力分析经酶解改性后OVA的离子键、氢键、疏水相互作用、二硫键的变化;采用荧光光谱和扫描电镜观察改性后OVA结构的变化。结果表明蛋白质的三股螺旋结构发生了明显的变化,同时,OVA的微观结构由球状完全变成片状,表明酶解改性对OVA结构产生显著性的影响。但针对改性后的OVA结构与功能特性之间的构效机制还有待进一步的深入探讨。

