陕西特色牛、羊肉食用品质及蛋白稳定性研究
魏燕超 曹建昕 刘满顺 刘永峰
(陕西师范大学食品工程与营养科学学院,陕西 西安 710062)
中国草地资源丰富,羊肉、牛肉产量丰厚分别居世界第1、3位[1]。牛、羊肉均是重要的高营养畜产品,近些年由于生活水平的提高,消费者的关注焦点已从肉制品的重量转至质量[2]。而决定肉质量高低的指标主要有嫩度、色泽等食用品质[3],众多食用品质与体内多种蛋白质结构、组成及其相互间的反应相关联[4]。剪切力是反映肉嫩度的常用指标,不同部位肉的剪切力与肉嫩度密切相关[5]。魏秀丽等[6]用蛋白质的溶解度反映蛋白的降解来研究动物宰后肌原纤维蛋白变化规律,发现肌原纤维蛋白结构的破坏及降解会使蛋白水合力改变而引起肌肉的持水性发生改变,从而改善了肉的嫩度。色泽是决定消费者购买与否最直观、影响最大的因素[7],研究[8]表明肌肉内肌红蛋白等相关蛋白质的相互转化及其蛋白稳定性、溶解性是影响肉色的本质原因,此外,pH值的变化也会导致肉色的改变。
鉴于牛、羊均为牛属的食草性动物[9],且均为食用较广的红肉,它们不同部位肌肉的色泽、嫩度、蛋白结构等均存在差异,但前人鲜有比较研究牛、羊肉宰后食用品质的差异,尤其通过宰后蛋白的变化分析品质差异的研究甚少。所以,本研究选取因含高蛋白、低脂肪、低胆固醇、丰富的氨基酸及矿物质等被称之为“肉中骄子”“肉中人参”的陕北著名的地方标志性产品的秦川牛肉、横山羊肉为研究对象[10-12],就它们的色泽、pH值、剪切力、肌浆蛋白与肌原纤维蛋白的溶解度及聚合降解情况进行研究分析,以期为牛、羊肉的品质调控提供一定的理论依据。
1 材料与方法
1.1 试验仪器及材料
1.1.1 原料肉
随机选取最适屠宰年龄(屠宰率最高)的未去势的秦川公牛和陕北白绒山羊公羊,即18月龄秦川公牛3头、10月龄陕北白绒山羊公羊3只[13-14]。宰后立即取牛背最长肌(NH)、牛腹部肌肉(NL)、羊背最长肌(YH)和羊腹部肌肉(YL)各200 g于离心管中,在干冰中运回实验室后(-78~-80 ℃),平均分割为6份,储存于-80 ℃冰箱中作为后续试验样品。
1.1.2 试验仪器
色差计:CR-10型,深圳壹博源有限公司;
pH计:E201-F型,上海雷磁仪器厂;
摇床:TS-1型,海门市其林贝尔仪器制造有限公司;
电子天平:JA2003N型,上海精密仪器有限公司;
全波长酶标仪:Multiskan Go型,美国Thermo Fisher Scientific公司;
凝胶成像仪:BIO-BEST200E型,美国SIM公司;
质构仪:TA. XT. Plus型,英国Stable Micro System公司;
恒温水浴锅:HH-4型,金坛市岸头仪都仪器厂;
蛋白电泳仪:Mini-PROTEAN Tetra System型,美国Bio-Rad公司;
冰箱:DW-HL398S型,中科美菱低温科技股份有限公司;
离心机:TGL-16gR型,上海安亭科学仪器厂。
1.1.3 试验试剂
蛋白Marker:电泳试剂,北京康润诚业生物科技有限公司;
Loading buffer、BCA试剂盒:北京康为试剂公司;
磷酸二氢纳、磷酸氢二钠、碘化钾:分析纯,天津市科密欧化学试剂有限公司;
SYPRO Ruby染色液:电泳试剂,美国Invitrogen公司;
十二烷基硫酸钠(SDS)、二硫苏糖醇(DTT)、三羟甲基氨基甲烷(Tris Base)、丙烯酰胺、过硫酸铵(APS)、四甲基乙二胺(TEMED)、甲叉双丙烯酰胺:分析纯,美国Sigma公司。
1.2 试验方法
1.2.1 pH值的测定 分别将肉样剔除筋膜后剪成碎末,称取10 g处理好的肉末于50 mL三角瓶中,再加入10 mL蒸馏水,室温静置10 min,使用pH计测定样品pH值[6]。
1.2.2 色泽的测定 将肉样除去筋膜、脂肪等物质,称取1 g样品于空气中静置3 min。用黑白版校正色差计后,设定容差为2 SDCM,测定样品色度L*(亮度)、a*(红度)、b*(黄度)值。
1.2.3 剪切力的测定 参考NY/T 1180—2006测定方法。分别将待测样品剔除筋膜等杂质,沿肌纤维方向切成近似6 cm×6 cm×3 cm的肉块,并置于80 ℃恒温加热至肉样内部温度达到70 ℃后取出,在室温中冷却后,切成近似1 cm×1 cm×3 cm的小块,用质构仪测定剪切力,设置速度为60 mm/min,探头距离为25 mm。
1.2.4 蛋白质溶解度的测定 参考Bowker等[15]的方法。肌浆蛋白溶解度的测定:分别取1 g肉样于10 mL磷酸缓冲液中(0.25 mol/L,pH 7.2),在冰上匀浆后,于4 ℃摇床过夜。次日于2 500 r/min离心20 min后,取上清液,用BCA(Bicinchoninic acid)法测定的蛋白浓度即为肌浆蛋白溶解度;全蛋白溶解度的测定:分别取1 g肉样于含1.1 mol/L KI的磷酸缓冲液中(0.1 mol/L,pH 7.2),在冰上匀浆后,于4 ℃摇床过夜。次日于2 500 r/min离心20 min后,取上清液,用BCA法测定的蛋白浓度即为全蛋白溶解度;肌原纤维蛋白溶解度按式(1)计算:
c=c1-c2,
(1)
式中:
c——肌原纤维蛋白溶解度,μg/μL;
c1——全蛋白溶解度,μg/μL;
c2——肌浆蛋白溶解度,μg/μL。
1.2.5 SDS-PAGE电泳
(1) 蛋白提取:参考Huang等[16]的方法。分别称取1 g样品于离心管,加入6 mL缓冲溶液(0.1 mol/L Tris pH 8.3、0.01 mol/L DTT),在冰上匀浆后,于4 ℃、10 000 r/min离心20 min,取上清液用于肌浆蛋白的分析。在剩余沉淀中加入25 mL 5% SDS缓冲溶液,涡旋、混匀,待沉淀溶解后,于80 ℃水浴30 min,分装并置于-80 ℃保存,用于肌原纤维蛋白的分析。通过BCA法测定蛋白浓度,并用全波长酶标仪测定其吸光度值。
(2) SDS-PAGE电泳:电泳采用15%分离胶和5%浓缩胶。分别将提取的蛋白样品与Loading buffer混合后,于沸水水浴3 min后冷却至室温,在3 000 r/min离心2 min后取上清液8 μg,上样。电泳过程中,初始电压为80 V,待溴酚蓝进入分离胶后,将电压调至130 V,待溴酚蓝距离凝胶底部约0.5 cm处,关闭电源,停止电泳。
(3) 染色:将凝胶浸入到含40%甲醇和10%乙酸的100 mL 溶液中,于摇床上放置2 h后,弃去溶液后,用100 mL 双蒸水洗涤2次,每次10 min;完成上述操作后,加入SYPRO Ruby染色并没过凝胶,避光染色过夜。染色完成后,弃去染色液,加入100 mL脱色液(含7%乙酸和10%乙醇)没过凝胶,于摇床上脱色2 h。
(4) 凝胶成像:完成脱色后,采用凝胶成像仪采集图像。光源波长为254 nm。
1.3 数据处理
所有数据平行测定3次,数据统计分析选用SPSS 17.0软件,多重比较方法选用Duncan法。
2 结果与分析
2.1 pH值
由图1可知,宰后羊肉腹部肌肉的pH值显著高于背最长肌肌肉(P<0.05),但牛肉在两个部位中pH值无显著差异(P>0.05)。比较同一部位牛、羊肉的pH值可知,牛、羊肉在背最长肌和腹部组均有显著性差异(P<0.05),且在2个部位羊肉的pH值均显著高于牛肉的(P<0.05),分别高出5.40%,5.65%。
动物在宰后过程中,肌肉的pH值与肉的色泽、持水性、嫩度等品质有至关重要的联系[17]。动物宰后,有氧呼吸停止,代谢由有氧代谢转变成无氧代谢,其中主要以糖酵解为代表,因此产生乳酸的速率加快,从而使得pH值发生改变[18]。试验结果表明,宰后羊肉组2个部位的pH值均高于牛肉组的,且背最长肌的高于腹部肌肉的,表明宰后羊肉的糖酵解力较牛肉稍强,背最长肌的糖酵解力较高,与马晓冰等[19]的研究结果一致。

不同小写字母表示同一物种不同部位差异显著(P<0.05);不同大写字母表示同一部位不同物种间差异显著(P<0.05)
图1 YH、YL、NH和NL组的pH值
Figure 1 pH of YH, YL, NH and NL groups after slaughter
2.2 色泽
由图2可知,宰后牛肉、羊肉背最长肌的L*值显著高于腹部肌肉(P<0.05),分别高出13.21%,6.29%,说明背最长肌较腹部肌肉的亮度更好,而同一部位肉块中,羊肉的L*值均显著大于牛肉的(P<0.05),背最长肌和腹部肌肉分别高出9.16%和16.27%。比较a*值发现,羊肉的背最长肌显著大于腹部肌肉(P<0.05),高出46.10%,但牛肉2个部位的a*值无显著差异(P>0.05),说明羊肉的背最长肌较腹部肉质偏红,但牛肉在这2个部位的红度值区别不明显;牛、羊肉在同一部位背最长肌肉质中a*值无显著差异(P>0.05),但在腹部组中,牛肉的a*值显著大于羊肉的,高出54.48%,说明牛羊肉的背最长肌肉色中的红色相差较小,但牛肉的腹部较羊肉的腹部颜色更偏红。与a*值相反,羊肉的背最长肌和腹部肌肉的b*值无显著差异(P>0.05),但牛肉背最长肌的b*值显著大于腹部的(P<0.05),高出21.34%;同一部位牛、羊肉b*值的变化趋势同a*值,在背最长肌中无显著差异(P>0.05),但在腹部组中,羊肉的b*值显著大于牛肉的(P<0.05),高出16.93%。
肉的色泽与动物品种、环境因素及纤维类型有关,且肉色主要由肌红蛋白及其相关蛋白所决定[20]。除此之外,潘晓建等[18]还发现,肌肉的pH值也与肉色及其稳定性有关联。pH值对肉色的影响机理为,当肉的pH值高于肌肉蛋白等电点时,肌肉的束缚水能力与肌肉表面对光线的吸收能力增强,这会使得肉的表观颜色加深,与上述研究得出的腹部较背最长肌pH值大,但亮度较背最长肌差相一致。有研究[21]发现,pH值较高时可改变肌红蛋白的吸收特征,使得肉色变暗红。也有研究者[22]发现肌浆蛋白氧化程度与肉a*值呈负相关,这是由于氧化使得肌红蛋白结构改变,降低了肌红蛋白结合氧气的能力,从而使得a*值减小。结合上述肌浆蛋白溶解度分析,背最长肌的溶解度较腹部大,与背最长肌的a*值比腹部大相一致。Tang等[23]也曾研究认为肌浆中还原型谷胱甘肽的含量与肉的L*值呈负相关,与a*值呈正相关,且有助于提高牛骨骼氧合肌红蛋白的稳定性,通过本文的电泳分析(见图5),未发现有此现象。

不同小写字母表示同一物种不同部位差异显著(P<0.05);不同大写字母表示同一部位不同物种间差异显著(P<0.05)
图2 YH、YL、NH和NL组的色泽
Figure 2 Color of YH, YL, NH and NL groups after slaughter
2.3 剪切力
由图3可知,在牛、羊肉组中,宰后腹部的剪切力均显著大于背最长肌的(P<0.05),分别高出3.83%,5.66%。由于一般情况下剪切力与肉嫩度呈反比,则可知牛、羊肉的背最长肌嫩度均优于腹部肌肉。除此之外,上述研究结果显示,羊肉2个部位剪切力差异较牛肉明显,说明屠宰率最高月龄的羊肉在这2个部位的肉质嫩度差异较牛肉明显。比较同一部位的剪切力发现,在2个部位肉中,羊肉的剪切力均显著小于牛肉的(P<0.05),背最长肌和腹部肌肉分别低6.84% 和4.99%,说明屠宰率最高月龄且相同部位羊肉肉质较牛肉更嫩,且牛、羊肉间背最长肌差异较大。
肉的嫩度直接决定着消费者的消费情况,直接影响着肉的商业价值[24-26]。而剪切力又是反映肉嫩度的常用指标。本研究发现背最长肌肌肉的剪切力小于腹部肌肉的,与之前研究[27]结果一致。有研究[28]通过改变胴体成熟过程所处的环境温度而使得肌原纤维蛋白降解、小片化指数增加来减小剪切力值,最终改善肉的嫩度。因为肌肉蛋白的溶液度也能反映蛋白的降解情况[9],所以研究发现羊肉组的肌原纤维溶解度与剪切力均小于牛肉组的,与该结论一致,但在牛、羊肉组中背最长肌的肌原纤维溶解度小于腹部组的,而腹部的剪切力却大于背最长肌部位的结果与上述结论相悖,所以该结果还有待进一步分析。此外,肉的pH值对其嫩度也有一定的影响。由于pH值的减小降低了肌浆钙离子激活因子的活力,使得其对肌肉骨架蛋白的降解能力减小,从而肌原纤维小片化指数减少,肉质嫩度变差[29]。这与上述研究发现羊肉组的pH值大于牛肉组的,但羊肉组的剪切力小于牛肉组的结果相一致。

不同小写字母表示同一物种不同部位差异显著(P<0.05);不同大写字母表示同一部位不同物种间差异显著(P<0.05)
图3 YH、YL、NH和NL组的剪切力
Figure 3 Shearing force of YH, YL, NH and NL groups after slaughter
2.4 蛋白质溶解度
2.4.1 肌浆蛋白溶解度 由图4可知,背最长肌的肌浆蛋白溶解度均显著大于腹部的(P<0.05),分别高出11.23%,8.76%。就同一部位的肌浆蛋白溶解度而言,羊肉组均显著大于牛肉组(P<0.05),背最长肌和腹部肌肉分别高出8.23% 和10.68%。在宰后过程中蛋白质的溶解度与其降解程度呈正相关,由此可知,屠宰率最高月龄的牛、羊肉宰后过程中背最长肌的蛋白降解较腹部明显,且同一部位比较,羊肉在宰后过程中肌浆蛋白的降解程度较牛肉大。

不同小写字母表示同一物种不同部位差异显著(P<0.05);不同大写字母表示同一部位不同物种间差异显著(P<0.05)
图4 YH、YL、NH和NL组的肌浆蛋白溶解度
Figure 4 Sarcoplasmic protein solubility of YH, YL, NH and NL groups after slaughter
2.4.2 肌原纤维蛋白溶解度 由图5可知,背最长肌的肌原纤维蛋白溶解度均显著小于腹部的(P<0.05),分别低5.18%,5.99%。就同一部位的肌原纤维蛋白溶解度而言,羊肉组均显著小于牛肉组(P<0.05),背最长肌和腹部肌肉分别低14.16%和13.29%。结果表明在屠宰率最高月龄阶段,牛、羊肉腹部肌肉的肌原纤维蛋白降解程度较背最长肌肌肉的明显,且同一部位的蛋白溶解度比较发现,牛肉的蛋白降解程度较羊肉的明显。
肌浆蛋白与肌原纤维蛋白间也存在相互影响,肌浆钙离子激活因子中含硫氢基团的半胱氨酸残基作为其活性中心,易氧化而使得部分酶失活,从而减弱了肌原纤维蛋白的水解性,致使肌原纤维小片化指数减小[30]。这与上述研究结果,同一部位的牛、羊肉和牛、羊肉的背最长肌和腹部肌浆蛋白溶解度与肌原纤维蛋白溶解度呈负相关的结果相一致。

不同小写字母表示同一物种不同部位差异显著(P<0.05);不同大写字母表示同一部位不同物种间差异显著(P<0.05)
图5 YH、YL、NH和NL组的肌原纤维蛋白溶解度
Figure 5 Myofibrillar protein solubility of YH, YL, NH and NL groups after slaughter
2.5 电泳的结果
2.5.1 肌浆蛋白的电泳图 通过SDS-PAGE电泳分析法,详细分析蛋白降解情况。由图6可知,2组肉的电泳条带差别较小,均在35~40 kDa 呈弥散现象。牛肉组在16~20 kDa 的条带比羊肉组的多,且亮度较高,该范围内主要蛋白为肌红蛋白,而肌红蛋白又直接影响着肉的颜色,这也与上述得出牛肉组的红度值显著高于羊肉组的相一致。除此之外,由图6还可知,在12~13 kDa 内,羊肉组的条带较牛肉组亮,可能是宰后肉成熟过程中羊肉的降解速率及降解程度较牛肉快。

图6 YH、YL、NH和NL组的肌浆蛋白SDS-PAGE图谱
Figure 6 SDS-PAGE spectrum of sarcoplasmic protein of YH, YL, NH and NL groups after slaughter
2.5.2 肌原纤维蛋白的电泳图 由图7可知,在25~40 kDa 背最长肌的条带较腹部多,且在35~45 kDa出现了交联现象。羊肉组在100 kDa的条带较牛肉组亮,该分子量大小的蛋白应该是肌原纤维蛋白中的主要蛋白——α-辅肌动蛋白。观察40 kDa左右的条带发现,羊肉组的条带较牛肉组更宽,此分子量大小的蛋白应是肌动蛋白(43 kDa)。在25~35 kDa 内,羊肉组的条带数较牛肉组多,该分子量范围内的蛋白可能是部分肌球蛋白轻链。除此之外,羊肉组的小分子条带较多,说明羊肉在宰后蛋白的降解程度较牛肉明显。
动物宰后,蛋白的降解情况及其降解后产生的多肽对肉的食用品质至关重要[31-33]。羊肉组中肌浆蛋白的溶解度大于牛肉组可能是牛、羊肉肌浆蛋白的疏水相互作用力存在差异所致,羊肉组中肌肉蛋白的表面疏水性氨基酸的相对含量较高,致使溶解度较大[34-35]。Lin等[35]研究发现,肌浆蛋白中二硫键含量与肉硬度呈正相关,而二硫键含量越高,蛋白肽链的空间结构越紧密,溶解度越低,可能是背最长肌和腹部肌肉溶解度存在差异的原因之一,这也与上述肌浆蛋白溶解度与剪切力的关系相一致。本研究得出背最长肌肌肉的肌原纤维蛋白溶解度小于腹部肌肉的,可能是腹部肌肉所含的肌原纤维蛋白中的肌动蛋白与肌球蛋白易结合,生成的肌动球蛋白又能很快地降解成小分子量的蛋白,从而使得与水分子的相互作用力加强而出现溶解度差异[36]。牛肉组的肌原纤维蛋白溶解度大于羊肉组的,可能是羊肉中钙蛋白酶(μ-calpain)活性较牛肉中低,减慢了肌原纤维蛋白聚合和降解速率[9]。
3 结论
在最适屠宰年龄下,因受剪切力和蛋白降解的影响,横山羊肉背最长肌和腹部的肌肉均稍嫩于秦川牛肉,二者背最长肌的肉质嫩度均优于腹部肌肉;横山羊肉背最长肌和腹部的肌肉色泽均稍亮于秦川牛肉,二者背最长肌肌肉的亮度优于腹部;秦川牛肉背最长肌和腹部肌肉较横山羊肉肉色偏红,但秦川牛肉2个部位肌肉肉色差异不明显,而横山羊肉的背最长肌肌肉较腹部肌肉偏红;此外,横山羊肉2部位蛋白降解的降解速率及降解程度较秦川牛肉显著,这也是其肉质较嫩的主要原因之一。本研究仅宏观地研究了陕西特色牛、羊肉食用品质及蛋白稳定性间的关系,因此,后续研究可通过蛋白组学和生物信息学深入分析具体蛋白及特定的生物通路对宰后不同部位及不同物种间肉品质差异的影响,从而为食品企业肉类加工、储藏提供一定的理论指导。
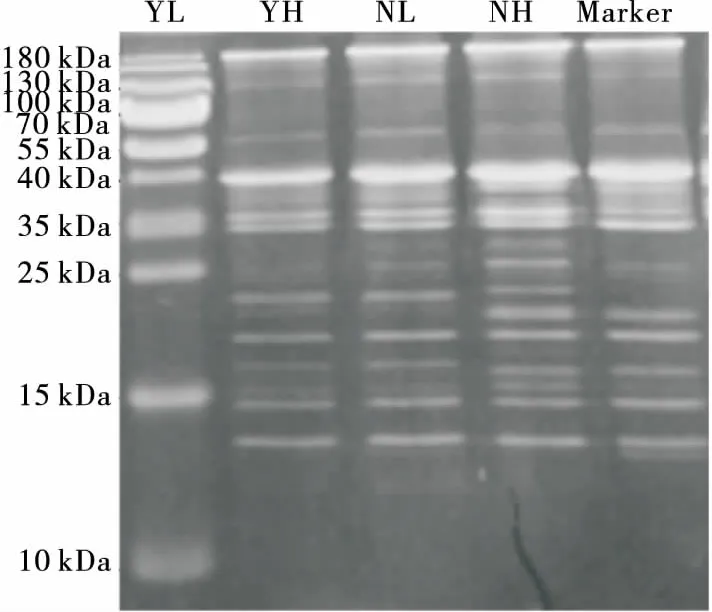
图7 YH、YL、NH和NL组的肌原纤维蛋白 SDS-PAGE图谱
Figure 7 SDS-PAGE spectrum of myofibrillar protein of YH, YL, NH and NL groups after slaughter

