聚乙二醇干扰素治疗非活动性HBsAg携带者血清MIP-1β水平变化趋势
曹振环,柳雅立,马丽娜,郑燕红,王 群,王俊丽,吴芳芳,陈新月
非活动性HBsAg携带者(inactive hepatitis B surface antigen carrier, IHC)是指HBsAg阳性>6个月,HBeAg阴性,抗-HBe阳性,HBV DNA低水平或检测不到,ALT正常,肝组织学检查病变轻微的患者[1]。通常IHC被认为处于机体的“免疫控制期”,但其仍存在潜在的危险,可逆转为HBeAg阳性及阴性慢性乙型肝炎(chronic hepatitis B, CHB),导致ALT升高,肝脏炎症再度活动。有报道称IHC肝炎复发率在5、10、15、20和25年分别为 10.2%、17.4%、19.3%、20.2%和20.2%[2]。另外,IHC的肝癌发生率也远高于正常人[3];IHC使用化疗药物、糖皮质激素等免疫抑制剂时,极易发生HBV再激活,甚至肝衰竭[4-6]。我们之前对IHC进行了聚乙二醇干扰素(pegylated-interferon,Peg-IFN)治疗,HBsAg清除率达到44.7%[7],为这类人群的治疗提供了可靠的临床依据。但目前尚缺乏Peg-IFN治疗IHC获得HBsAg清除的相关免疫学研究。巨噬细胞炎性蛋白1β(macrophage inflammatory protein-1β, MIP-1β)是一种趋化因子,可以趋化T淋巴细胞、NK细胞、单核细胞和未成熟树突状细胞(dendritic cell, DC)在炎症部位和肿瘤局部发挥作用。有报道称在HBV感染过程中,MIP-1β不利于机体快速清除病毒,导致慢性持续性肝炎,另外可诱发免疫损伤,促进肝脏纤维化[8-9]。但MIP-1β与HBsAg清除,尤其是与经过Peg-IFN治疗的IHC获得HBsAg清除的关系还未见报道。
1 对象与方法
1.1 对象 2013年1月—2016年1月就诊于首都医科大学附属北京佑安医院门诊的IHC 20例。IHC诊断符合2015年《慢性乙型肝炎防治指南》,入组标准:①HBsAg阳性>6个月,HBeAg阴性、抗-HBe阳 性、 抗 -HBc阳 性,HBV DNA< 20 IU/ml,ALT正常;②HBsAg定量<1000 IU/ml;③TBIL<25 μmol/L,ALB>40 g/L,INR 0.8~1.2;④WBC(4~ 10)×109/L,PLT(100~ 300)×109/L;⑤FibroScan:E值<6.4 kPa;⑥未接受过抗病毒治疗;⑦排除重叠HIV、HCV感染,自身免疫性疾病,肝硬化,肝癌,肝功能失代偿,严重代谢性疾病及合并其他系统肿瘤等。另纳入健康人11例(HBsAg阴性,抗-HBs>200 IU/ml)。
1.2 治疗方法与疗效 20例IHC接受Peg-IFNα-2a 135 μg,1次/周,皮下注射。13例治疗24周后获得HBsAg清除,设为应答组(R组),7例治疗24周后未获得HBsAg清除,设为无应答组(NR组)。
1.3 标本 采集20例IHC基线、12周、24周的血清及11例健康者的血清进行MIP-1β检测。
1.4 实验室方法 细胞因子检测:采用Luminex(液相芯片技术)检测血清MIP-1β水平,仪器为美国Bio-Rad公司Bio-Plex 200 system。HBsAg、抗-HBs定量:应用HBsAg quantitative Elecsys(Roche Diagnostics GmbH, German)检测,HBsAg定量检测下限为0.05 IU/ml,抗-HBs>10 IU/ml为阳性。HBV DNA定量:采用RT-PCR,仪器为Roche Cobas/Taqman Real-Time PCR2.0 System,德国罗氏公司试剂盒,检测下限为20 IU/ml。肝功能检测:采用脱氢酶法、溴甲酚绿法、循环酶法氧化酶法、肌氨酸氧化酶法等,仪器为Olympus AU5400全自动生物化学分析仪,试剂为上海科华东菱公司相关试剂盒。
1.5 统计学处理 应用SPSS 13.0软件进行统计分析。正态分布的计量资料以±s表示;3组间比较用单因素方差分析(组间方差齐),两两比较用q检验。2组间比较用t检验。计量资料不同时间点比较用单因素重复测量的方差分析。多组间计数资料比较采用R×Cχ2检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 一般资料及基线特征 本研究共入组20例IHC,R组13例,NR组7例,同时纳入11例健康人为HC组。3组在性别、年龄、ALT水平上无明显差异。R组基线HBsAg定量低于NR组,但差异无统计学意义(t=3.684,P=0.067)。见表1。
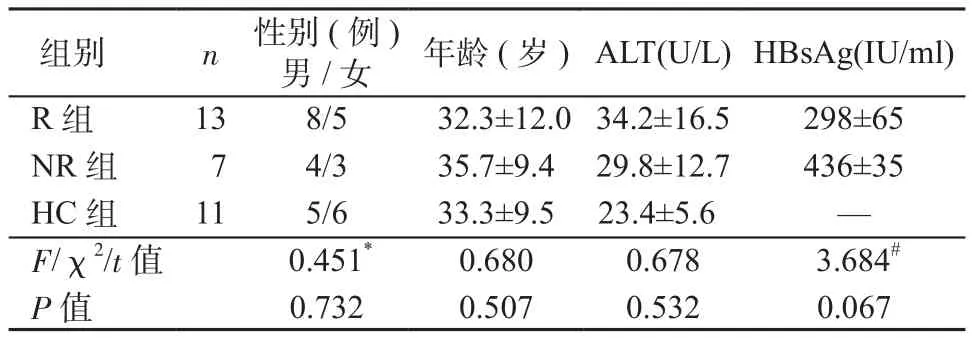
表1 一般资料及基线特征Table 1 General data and baseline characteristics of the patients
2.2 3组间基线血清MIP-1β水平比较 R组基线MIP-1β水平为(102.25±72.09)pg/ml,NR 组为(80.49±57.82)pg/ml,HC 组 为(87.46±52.74)pg/ml,虽然R组MIP-1β水平较高,但可能由于样本量较小,3组之间差异无统计学意义(F=0.320,P=0.729)。见图1。
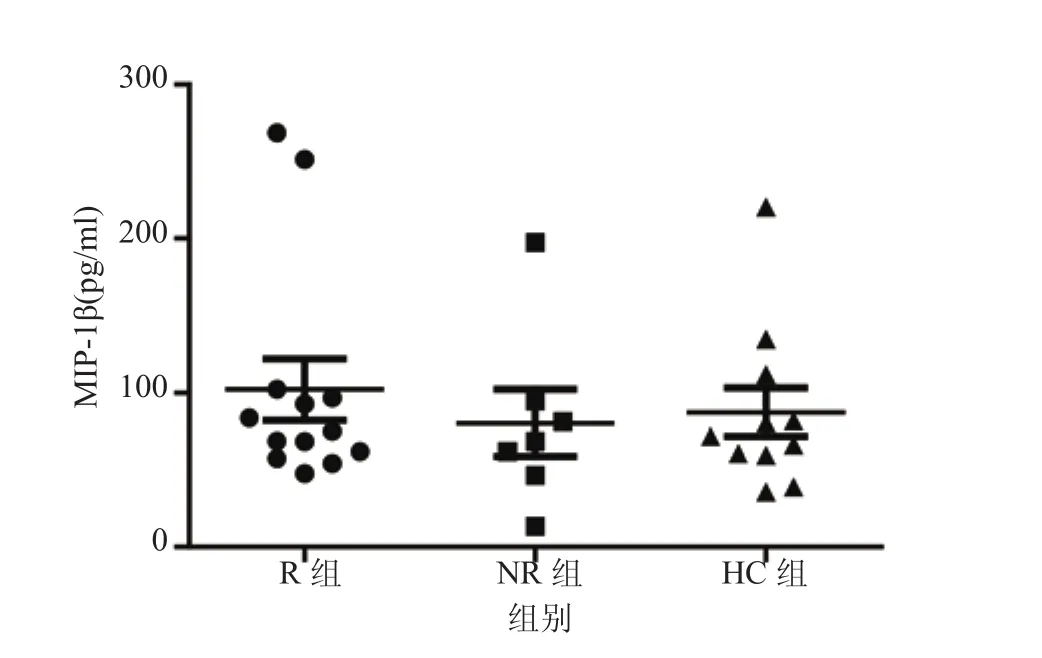
图1 3组血清MIP-1β水平比较Figure 1 Comparison of serum MIP-1β levels among 3 groups
2.3 R组抗病毒治疗后MIP-1β水平变化 R组抗病毒治疗后MIP-1β水平明显下降,基线为(102.25±72.09)pg/ml,12 周 降 至(59.19±31.05)pg/ml,24周降至(48.95±26.91)pg/ml(F=4.532,P=0.018)。基线与12周、24周相比,差异均有统计学意义(P=0.028,P=0.007)。见图2。

图2 R组抗病毒治疗后MIP-1β水平变化情况Figure 2 Changes of MIP-1β level after antiviral treatment in R group
2.4 NR组抗病毒治疗后MIP-1β水平变化 NR组中大部分患者MIP-1β呈下降趋势或水平波动。各时间点平均值无明显变化,基线为(80.49±57.82)pg/ml,12周为(76.16±64.32)pg/ml,24周为(69.48±40.71)pg/ml(F=0.071,P=0.932)。见图3。

图3 NR组抗病毒治疗后MIP-1β水平变化情况Figure 3 Changes of MIP-1β level after antiviral treatment in NR group
3 讨 论
IHC是HBV感染者中最大的一个群体[10-11]。多项在高加索人群中进行10年以上的随访数据显示,与HBeAg阳性或HBeAg阴性的CHB患者相比,IHC预后好,发生HCC几率较低[12]。但亚洲人群与高加索人群不同,亚洲的IHC可能存在HCC高风险。台湾的一项研究对1965例IHC进行了平均11.5年的随访,结果显示16%的患者出现病毒再激活,25年肝硬化累积发生率达到15%,病毒再激活者20年肝硬化累积发生率更是高达46%[13]。另一项台湾研究对1932例IHC进行了平均13.1年的随访,结果发现这些IHC的肝癌和肝癌相关死亡风险是非HBV携带者的4.6倍(HR=4.6,95%CI:2.5~8.3)和2.1倍(HR=2.1,95%CI:1.1~4.1)[14]。由此可见,我们不应该把IHC作为“健康携带者”对待,探索其治愈方案对于改善其预后仍具有非常重要的意义。本课题组在前期应用Peg-IFN治疗IHC,获得了较高的HBsAg清除率,为进一步的基础研究提供了宝贵的临床资源。
MIP-1β是一种趋化因子,表达于单核细胞,巨噬细胞,NK细胞,T、B淋巴细胞及内皮细胞。MIP-1β对T淋巴细胞、NK细胞、单核细胞和未成熟DC均具有很强的趋化能力。但MIP-1β水平与CHB患者抗病毒疗效的相关性报道甚少,尤其是与HBsAg清除的相关性尚未见报道。
本研究选取了前期部分获得HBsAg清除的IHC病例,初步检测了基线及治疗过程中血清27种细胞因子水平,包括IL-1、IL-2、IL-17、IL-22、MIP-1β等。结果发现IHC在Peg-IFN治疗后,其MIP-1β水平下降明显。为此,本文进一步分析了血清MIP-1β水平与HBsAg清除的相关性,结果显示HBsAg清除者MIP-1β水平下降明显,而未清除者则无此现象。既往研究表明病毒性肝炎患者血清MIP-1β表达升高,其可介导CCR5HIGH的T细胞进入门脉区,发挥免疫效应,导致机体不能迅速清除病毒,而发展为慢性持续性肝炎[14]。本研究的结果提示Peg-IFN治疗IHC,可一定程度降低MIP-1β水平,使之发挥疾病慢性化的作用减弱,这可能有利于疾病的治愈——获得HBsAg清除。

