PD-L1调节结直肠癌细胞生物学行为的作用研究
熊振芳 ,熊秋迎 ,万红萍 ,时军
(南昌大学第一附属医院,1、病理科;2、普外科,南昌 330006)
结直肠癌是严重威胁人类健康的常见恶性肿瘤之一。目前,我国结直肠癌的发病率高居恶性肿瘤的第3位,而死亡率位居第4位[1],近年来尽管治疗水平明显提高,但结直肠癌仍然是主要的致死癌症之一,晚期结直肠癌患者的5年生存率尚不足5%[2]。近年来,针对免疫卡控点药物引领了肿瘤治疗进入免疫治疗的新时期,也为结直肠癌的治疗提供了新策略。PD-L1(Programmed death ligand-1,程序性死亡分子配体-1)是B7/CD28协同刺激分子超家族中主要成员之一,起负性调节作用。在正常条件下,PD-L1主要表达于淋巴细胞,但在多种恶性肿瘤中发现有PD-L1的表达[3]。研究表明,很多肿瘤PD-L1蛋白表达与临床病理因素存在相关性。有研究发现,PD-L1在肺癌、鼻咽癌、乳腺癌、膀胱癌、卵巢癌、恶性黑色素瘤中表达并提示患者预后较差[4-10]。本课题组前期研究结果也显示,在结直肠癌中PD-L1的高表达状态和肿瘤浸润侵袭、淋巴结转移以及患者生存期显著相关,提示PD-L1可以成为结直肠癌重要的分子生物学标志,对于评估肿瘤免疫逃逸应答水平具有重要的意义。其在结直肠癌中的生物学功能和临床应用前景值得深入探讨。
基于以上背景,本课题组通过构建慢病毒转染系统下调PD-L1基因在直肠癌细胞系中的表达,观察PD-L1表达下调后对细胞生物学功能的影响,探讨PD-L1对结直肠癌细胞增殖、侵袭和迁移的作用。
1 资料与方法
1.1 仪器与试剂 3种结直肠癌细胞系 (HT-29、
通信作者:时军HR8348、SW480)、 细胞裂解液、FBS 胎牛血清、DMEM高糖完全培养基、DMSO冻存液、总RNA提取试剂盒、HiFiScript cDNA第一链合成试剂盒、流式细胞仪、PCR扩增仪。
1.2 方法
1.2.1 实验共分3组 PD-L1沉默慢病毒组、空载体组、空白组。
1.2.2 慢病毒包装 ⑴取生长状态良好的细胞,0.05%-0.25%胰酶消化后,悬浮细胞,接种于培养皿中(培养条件:37℃,5%CO2培养过夜);⑵去除培养液,换Opti-MEM培养液;⑶质粒混合:向EP管中加入 250μl无血清 Opti-MEM、0.5μg表达质粒和1.5μg包装混合质粒,室温孵育5min;⑷Lipo稀释:向EP管中加入250μl Opti-MEM和9μl脂质体,室温孵育5min;⑸将脂质体溶液和DNA溶液混匀,室温孵育20min;⑹胰酶消化后用DMEM培养基重悬细胞;⑺向六孔板中加入DNA-脂质体混合物和含血清的生长培养基;⑻将重悬的细胞加到平板中,37℃,5%CO2孵育过夜;⑼除去含有DNA-脂质体复合物的培养基,代之以DMEM;⑽48-72h之后收集含病毒的上清,3000rpm离心20min,去除沉淀,病毒上清于-80°C冰箱贮存。
1.2.3 细胞转染 ⑴当细胞的融合度满意时,弃除培养液,PBS洗涤2次,胰蛋白酶消化3min;⑵加入DMEM,将细胞吸取到离心管中离心,取沉淀物,再加入DMEM完全培养基并分别接种到6孔板、24孔板和96孔板中,培养箱中培养(37℃,5%CO2);⑶细胞生长状态良好时,分别进行空白对照、空载体、沉默PD-L1转染。
1.2.4 流式检测细胞凋亡和细胞周期 ⑴转染48h后收集细胞,PBS洗涤2次,胰蛋白酶消化1min,再加入含10%FBS的DMEM;⑵将细胞吸取到1.5ml离心管中离心,弃除上清,用PBS洗涤2次,收集细胞;⑶将细胞分为两份,一份用Binding Buffer悬浮细胞,再加入 5μl Propidium Iodide和 5μl Annexin V-FITC,常温避光孵育5-15min,于1h内用流式细胞仪检测细胞凋亡;⑷另一份加入70%的乙醇溶液充分固定2h,用流式细胞仪检测细胞周期。
1.2.5 侵袭实验 ⑴细胞转染48h后,将侵袭小室放入10%中性福尔马林固定液中固定15min;⑵取出侵袭小室,用PBS洗涤2次,放入新鲜配制的姬姆萨染色液中反应15min;⑶取出侵袭小室,将小室内部细胞用滤纸擦去,显微镜下拍照观察。
1.2.6 划线实验 ⑴当6孔板中的细胞铺满板底后,用枪头垂直于孔板间隔相同距离划痕;⑵取出孔板,用PBS清洗划痕上的细胞碎片;⑶加入无血清培养基后放入培养箱培养,间隔4-6h拍照记录。
1.2.7 细胞增殖和毒性检测 ⑴细胞消化后,加入含10%胎牛血清的DMEM培养基;⑵96孔板每孔接种约4000个细胞,每孔加入100μl的培养基,置于培养箱(37℃,5%CO2)中孵育;⑶待细胞生长状态良好时转染相应慢病毒;⑷48h后,弃除培养基,每孔加入新鲜配制的毒性检测液CCK8 10μl;⑸培养箱培养4h后,用酶标仪检测波长为450nm的OD值。实验重复3次,取平均值作为最终实验结果。按公式计算生长抑制率=[(对照组OD-实验组OD)/对照组 OD]×100%。

图2 HR8348细胞系实验分组的凋亡图

图3 SW480细胞系实验分组的凋亡
2.2 流式检测细胞周期 ⑴HT-29细胞:与对照组比较,空载组细胞周期变化不明显,而PD-L1基因沉默组中S期细胞比例减少,G1期细胞比例明显增多。⑵HR8348细胞和SW 480细胞:与对照组比较,PD-L1基因沉默组和空载组的细胞周期比例变化不明显。见图4-6。
2 结果
2.1 流式检测细胞凋亡 每种结直肠癌细胞系3个不同实验组中,与对照组及空载组比较,PD-L1基因沉默组凋亡率显著增加。说明PD-L1基因沉默后,可以促进细胞凋亡。见图1-3。
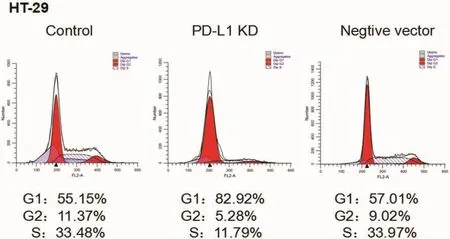
图4 HT-29细胞系实验分组的细胞周期图

图1 HT-29细胞系实验分组的凋亡图
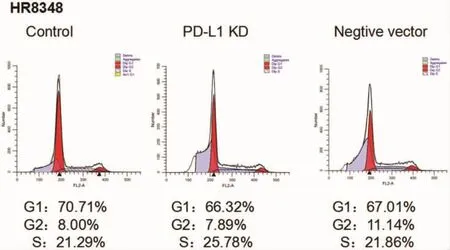
图5 HR8348细胞系实验分组的细胞周期图
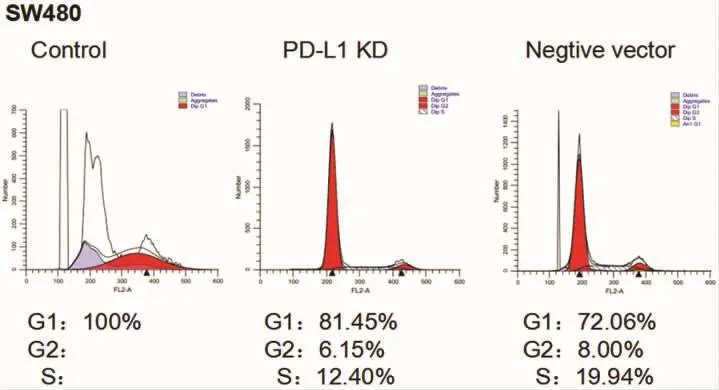
图6 SW 480细胞系实验分组的细胞周期图
2.3 侵袭实验 ⑴HT-29细胞:PD-L1基因沉默后,细胞侵袭能力降低。空载组、对照组、PD-L1基因沉默组细胞侵袭数目分别为46个、27个、17个。⑵HR8348细胞:PD-L1基因沉默后,细胞侵袭能力显著降低。空载组、对照组PD-L1基因沉默组细胞侵袭数目分别为127个、140个、48个。⑶SW480细胞:PD-L1基因沉默后,细胞侵袭能力有所降低。空载组、对照组、PD-L1基因沉默组细胞侵袭数目分别为78个、98个、59个。说明PD-L1表达下调后,细胞侵袭能力显著下降,差异具有统计学意义(P<0.05)。见图7-10。
2.4 划线实验 每种结直肠癌细胞系3个不同实验组中,与对照组及空载组比较,PD-L1基因沉默组细胞迁移能力显著被抑制。见图11。

图7 HT-29细胞系实验分组的细胞侵袭图

图8 HR8348细胞系实验分组的细胞侵袭图

图9 SW 480细胞系实验分组的细胞侵袭图

图10 3种细胞系实验分组的细胞侵袭数目柱状图

图11 3种细胞系实验分组的细胞迁移距离柱状图
2.5 细胞增殖和毒性检测 下调PD-L1表达,能显著抑制3种细胞系的增殖能力,差异具有统计学意义(P<0.05)。见图 12。
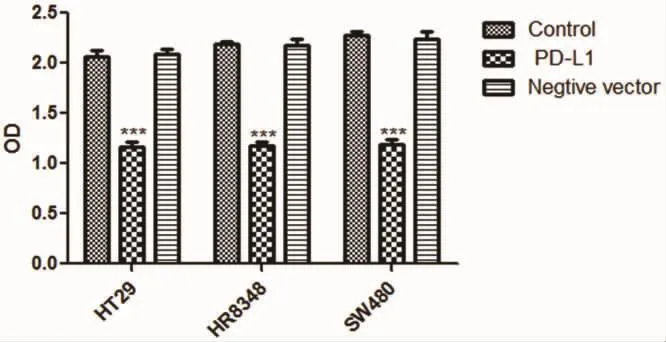
图12 3种细胞系实验分组CCK8检测OD图
3 讨论
PD-1是协同刺激受体,是免疫球蛋白超家族成员之一,主要功能是传导抑制信号的。其配体即为共刺激分子PD-L1,是首个被鉴定的负性共刺激分子,属B7超家族成员。生理状态下,PD-L1表达于免疫细胞、抗原提呈细胞等表面。PD-1/PD-L1信号传导通路能传递抑制性信号,诱导免疫细胞发生凋亡,调节机体免疫应答反应。越来越多的研究表明PD-1/PD-L1通路在肿瘤浸润和进展过程中发挥重要的作用,在多种恶性肿瘤中发现有PD-L1的过表达,而且还与肿瘤的恶性生物学行为及生存预后相关,是目前恶性肿瘤免疫治疗策略中的热门分子靶点。
本课题组前期实验也验证了在结直肠癌中PD-L1的过表达与肿瘤恶性生物学行为及患者的生存预后密切相关。为了进一步探索PD-L1对结直肠癌细胞生物学功能的影响,本课题组构建慢病毒转染系统下调PD-L1在直肠癌细胞系中的表达,然后进行一系列的分子生物学实验,研究下调PD-L1分子的表达对细胞生物学功能的影响,进一步阐明PD-L1分子在结直肠癌发生、发展中的作用和意义。结果表明下调PD-L1的表达,可以抑制癌细胞的高侵袭性,抑制细胞周期,促进癌细胞凋亡,降低结直肠癌细胞的体外增殖、侵袭和转移能力。综合目前已有的研究和本课题组研究成果,我们证明了下调PD-L1的表达能够抑制结直肠癌细胞生长,进一步论证了PD-L1能够直接影响肿瘤细胞恶性生物学功能,但其具体的信号传导通路及调控网络如何发挥作用有待进一步探讨。
最新研究发现,PD-1阻断剂对PD-L1过表达患者的治疗更加有效[11-13]。因此,阻断PD-1/PD-L1信号传导通路为肿瘤免疫治疗翻开了新篇章,其相关抗体及抑制剂在很多临床试验也取得了一定的研究成果,这为结直肠癌的治疗带来了曙光。
一般认为,PD-L1分子主要通过与受体PD-1结合后起到免疫抑制和免疫逃逸作用,其自身缺乏信号传导能力。Cao等发现,PD-L1可增强肿瘤细胞Slug和Twist的表达,抑制E-cad的表达,从而诱导上皮间质转化,促进肿瘤的发生[14]。而Hallett等结果显示,PD-L1分子可以不依赖于PD-1,自身作为功能分子,为肿瘤细胞传导生长抑制信号[15]。由此推测,PD-L1自身即可调控结直肠癌细胞的生物学功能,对抑制肿瘤细胞凋亡、促进肿瘤进展有重要作用。
PD-L1的表达调控通路在不同组织学类型的恶性肿瘤中可能不尽相同,正因如此,在肿瘤免疫治疗的临床试验中单一使用抗PD-L1抗体或抑制剂并不都能达到理想效果。进一步明确这些网络调控通路中的相关分子,联合抑制这些分子靶点可能会有更加明确的疗效。
综上所述,本研究显示,单独下调结直肠癌细胞中的PD-L1的表达,促进癌细胞凋亡,抑制癌细胞增殖、迁移和高侵袭性,降低癌细胞的恶性生物学行为。

