新型含铜金属心血管支架材料
杨 柯,任 玲
(中国科学院金属研究所,辽宁 沈阳 110016)
1 前 言
1.1 支架内再狭窄及主要影响因素
尽管心血管支架在过去几十年里取得了显著的治疗效果,但它一直被支架植入后发生的再狭窄问题所限制[1]。支架内再狭窄是指经过冠脉介入手术后,冠状动脉造影结果显示血管内径再次狭窄超过50%以上。相比于早期的球囊血管成形术,金属裸支架(bare metal stent,BMS)的出现大大减少了支架内再狭窄(in-stent restenosis,ISR)的发生,使其发生率减少为20%~40%。为了进一步降低支架内再狭窄的发生率,人们又开发出了在金属支架上包裹药物涂层的药物洗脱支架(drug-eluting stent,DES),将支架内再狭窄降低到了5%~10%,但再狭窄发生率仍未控制在令人满意的范围内[2,3]。
人体动脉血管的内膜主要由内皮细胞构成,中膜主要由平滑肌细胞构成。支架在植入血管的过程中,首先血管内膜受到损伤引发炎症反应,血小板聚集在支架处易形成血栓,接着平滑肌细胞向该部位迁移和增殖,细胞外基质大量生成,这导致了新生内膜的产生[4]。支架内再狭窄的发生主要是血栓形成和新生内膜作用的结果[5]。此外,支架膨胀不良、支架断裂、过敏反应等多种因素也会影响支架内再狭窄的发生[6]。目前应对这种现象的治疗手段包括再次植入支架、球囊扩张、冠状动脉斑块旋切术等方法,但并没有最佳的治疗方案。
1.2 铜对人体心血管系统的有益作用
200多年前,人们就发现铜(Cu)可以促进兔子无血管的角膜中新血管的生成[7]。人体缺乏Cu会导致血管胶原和蛋白合成障碍,从而不利于血管的连接。对体内缺乏Cu的动物的解剖学结果表明,这些动物的大动脉出现了裂纹,动脉中有泡状细胞,心脏肥大,平滑肌细胞增殖和迁移,冠状动脉有血栓形成[8]。医学研究证实,Cu能够促进内皮细胞的增殖和迁移,而血管形成主要就是依靠内皮细胞的增殖和迁移[9]。新血管的生成受到相关的生长因子的调控,比如血管内皮生长因子(vascular endothelial growth factor,VEGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)、缺氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)等。
VEGF是目前发现能够促进血管生成的最有效的生长因子,研究的也最为深入。VEGF信号通路在血管生成过程中参与了众多调节过程,有着无可替代的作用。它能显著促进全身各组织器官中内皮细胞的增殖、迁移和趋化[10]。研究表明,CuSO4通过释放Cu离子,可激活EGFR/ERK/c-fos传导通路,提高癌症细胞中VEGF的表达,并且经过CuSO4处理过的癌症细胞培养液可以促进内皮细胞的迁移及血管生成能力[11]。在功能性子宫内膜出血的患者体内,血清中Cu含量的明显增加,进而促进了VEGF-A的分泌,导致了子宫内膜的生长[12]。由此可以看出,Cu与VEGF的增加有着显著的关系。
FGF能够促进成纤维细胞的增长,是强烈的结缔组织细胞促生长因子。FGF有多种异构体,其中hFGF-1是以多蛋白复合物的形式释放到细胞外的,其突触结合蛋白的C2A区域与Cu离子有着很高的亲和力,这表明Cu参与了FGF多蛋白复合物的形成[13]。HIF-1α是在缺氧状态下血管生成的调控因子,具有相当广泛的靶基因谱。在细胞缺氧时,HIF-1α能改变细胞代谢中的氧含量,启动保护性反应[14]。HIF-1α能促进VEGF的表达,从而促进血管的生成[15]。Cu可以调节HIF-1α与低氧反应元件HRE的结合以及HIF-1转录复合物的形成,所以HIF-1α的激活需要Cu的参与[16]。此外,Cu在激活HIF-1α后,也能促进它的表达[17]。
人体内血管新生往往伴随着血管舒张。虽然许多因子都具有促进血管舒张的特性,但是最终都要归根于一氧化氮(NO)的作用。NO通过激活NO合成酶和MAPK信号通路,提高FGF-2的表达,从而触发及诱导细胞的增长和分化[18]。NO合成酶一共有3种亚型,包括神经型NO合酶、内皮型NO合酶(endothelial nitric oxide synthase,eNOS)及诱导型NO合酶,其中前两种酶只能在短时间内产生少量的NO,后一种则能在数小时内产生大量的NO[19]。eNOS可以合成NO,在内皮细胞的迁移、增殖和分化中扮演着必不可少的角色。将小鼠eNOS的基因敲除后发现,小鼠的伤口愈合速度明显下降[20]。Demura等测定了Cu2+、Mn2+、Zn2+、Fe2+这4种金属二价离子对eNOS活性的影响,发现只有Cu2+在浓度大于10-6mol/L时才会明显增加人的肺动脉内皮细胞中eNOS的活性[21]。反之,饮食中Cu的缺乏会导致小鼠受NO调节的血管舒张功能退化[22]。
以上医学研究结果表明,Cu是人体中必不可少的微量元素,特别是其具有促进血管生成的作用。在正常情况下,它维持人体血管基本的结构和功能。在血管受损伤时,Cu能通过提高VEGF、FGF、HIF-1α等相关因子的表达来促进内皮细胞、成纤维细胞的增殖和分化,保护细胞不受缺氧的影响。此外,Cu还能增加血管生成所必需的NO的释放,以提高损伤部位的愈合速度。所以,Cu对人体冠脉系统的健康起着重要的生物功能性作用。
Cu还参与人体内正常细胞的代谢过程,在生物系统中起着独特的催化作用。Cu是生物体内血浆铜蓝蛋白、超氧歧化酶、细胞色素C氧化酶、多巴胺β-羟化酶等13种以上酶中的活性成分,在维持生物体内的新陈代谢方面起着多种极为重要的生理和生化作用[23]。Cu能促进造血机能,调节铁的吸收和利用,维护骨骼、血管、皮肤和内分泌的正常功能,促进骨骼、血管和皮肤胶原的生成。Cu对心血管系统的影响很大,在心肌的收缩与舒张、细胞膜的结构与功能、血压调节、体内水钠平衡以及血液凝固中起着重要作用[24]。人体内的细胞色素C及多种金属酶中都含有微量的Cu元素,这些金属酶能促进心血管中的基质胶原和弹性硬蛋白的合成,对维持心血管的正常结构和良好弹性极为重要。此外,心脏和动脉壁中的铜酶是血管内3种主要结缔组织中的重要成分,对冠心病的形成起着重要的抑制作用[25]。然而,Cu在人体中的含量是受到严格控制的。正常成年人体内含Cu量为100~200 mg,50%~70%的Cu存在于肌肉及骨骼内,20%左右存在于肝脏内,5%~10%分布于血液内,微量存在于含铜的酶类中。Cu在人体内不易保留,需经常摄入和补充。世界卫生组织建议成人每日Cu的上限摄入量为2~3 mg[26]。其调查显示,全世界存在较多缺Cu的高危人群。例如,目前只有25%的美国居民日常摄入的Cu量达到了美国国家科学院食品和营养委员会推荐的合适水平。
人体内缺Cu不仅容易引发贫血、心脏肥大、冠心病、关节炎骨质疏松等疾病,还会影响人体的分泌系统和免疫功能。其中,缺Cu对心血管系统的影响最为显著。有研究表明,Cu缺乏容易导致心房血栓形成、冠状动脉坏死、冠状动脉血栓形成、心肌坏死和心室钙化等疾病[27]。缺Cu还易导致动脉平滑肌的迁移和变性、动脉弹性组织变性和断裂,以及心室和冠状动脉瘤的形成[28]。Cu离子不仅能诱导内皮生长因子,促进内皮细胞增殖,进而加快血管再生过程,而且能阻止动脉平滑肌细胞(VSMC)的过度增殖[9]。由此可见,如果在心血管系统中造成微量Cu元素的持续释放,可能会同时起到促进内皮细胞生长、抑制动脉平滑肌过度增殖以及降低血栓形成倾向等多方面有益的生物医学功能及作用。
Baird等[29]研究表明,铜离子有助于将VSMC内的硫醇排出胞外;而缺Cu的细胞硫醇不能排出,在胞内可形成超氧化物,这种超氧化物会降低NO的生物活性,使低密度脂蛋白(LDL)被氧化,阻碍VSMC中的乙酰胆碱与组胺之间的反应,从而会导致VSMC的过度增殖并变性,形成泡沫细胞。因此如果在冠脉支架置入血管受损处能够原位持续地释放(补充)微量铜离子,将有望能够抑制血管受损处的VSMC的增殖和变性,进而降低由VSMC增殖和变性引发的支架内再狭窄的发生率。
Johnson等[30]研究表明,铜离子会影响血小板中钙元素的运动,刺激凝血酶,并影响铜-过氧化物歧化酶的活力,降低血小板中血栓素和脂质过氧化氢物的产生,进而抑制血栓的形成。在冠脉支架的植入过程中,血管壁损伤会导致血小板活化,释放凝血酶,并激活更多的血小板,导致在支架处形成急性血栓[31]。由于含铜不锈钢支架自身能够持续释放微量铜离子,抑制支架表面血栓的形成,因而有利于抑制由血栓形成引发的支架内再狭窄。
1.3 新型含铜金属心血管支架材料的创新研究
鉴于上述Cu元素对人体冠脉系统的有益生物功能,包括促进血管内皮化、抑制动脉平滑肌增生、降低血栓形成倾向等,以及Cu可作为合金化元素加入到结构金属中的材料特性,作者团队通过在现有冠脉支架用金属材料(316L不锈钢、L605钴基合金)中添加适量Cu元素,首次创新性开发出具有抑制支架内再狭窄功能的新型含铜金属心血管支架材料,并从多方面验证了含铜金属(316L-Cu不锈钢、L605-Cu合金)对支架内再狭窄的抑制作用。
2 316L-Cu不锈钢对支架内再狭窄的抑制作用研究
Cu离子具有促进血管生成的作用,因此可以尝试在现有血管支架材料中适量添加Cu元素,使血管支架具有促进伤口愈合或加速血管新生的生物功能。在支架植入冠脉血管过程中,血管内壁往往会受到损伤,这时平滑肌细胞向该部位迁移和增殖,导致新生内膜的产生[32]。因此,增加内皮细胞的活性,加速内皮化过程,可以抑制平滑肌细胞的激活。此外,Cu离子对血栓形成及VSMC增殖的抑制作用亦会对抑制支架内再狭窄起到关键作用。所以向支架材料中添加适量Cu元素,通过支架在冠脉中适量释放Cu离子,有助于抑制支架内再狭窄的发生。
316L不锈钢是第一款应用于临床的金属冠脉支架材料,由美国强生Cordis公司于1994年推向市场。但它是一种生物惰性材料,不会与机体组织主动发生有益的相互作用。近年来,作者团队利用Cu离子对心血管系统的诸多有益作用,在316L不锈钢中添加适量Cu,开发出具有抑制支架内再狭窄功能的新型含铜316L不锈钢(316L-Cu)[33,34]。这种新型支架材料在保持316L不锈钢原有性能的基础上,可以在心血管中持续和微量释放Cu离子,从而实现促进内皮化、抑制平滑肌增生、降低血栓形成倾向等多重生物功能,是一种有效降低支架内再狭窄发生率的新一代心血管支架材料。
2.1 含铜不锈钢对血管内皮细胞的影响
2.1.1 内皮细胞在材料表面上的粘附
在24 h和72 h共同培养后,316L-Cu不锈钢表面上粘附的人脐静脉血管内皮细胞(HUVEC)数量都明显多于316L不锈钢,且细胞之间连接紧密,生长状态良好。从图1所示的荧光染色照片可以看到,316L不锈钢表面的HUVEC部分染色质出现浓缩状态,细胞核的染色质高度凝聚和边缘化,而且细胞核裂解为碎块,产生凋亡小体,而316L-Cu不锈钢表面上粘附的HUVEC没有观察到这种情况。以上实验结果表明,316L-Cu不锈钢具有促进HUVEC增殖的作用。
2.1.2 对细胞凋亡率的影响
采用Annexin V-FITC/PI流式细胞术检测培养液以及316L和316L-Cu两种不锈钢浸提液分别对HUVEC凋亡情况的影响。在316L-Cu不锈钢浸提液中培养的HUVEC凋亡细胞数量少于316L浸提液中培养的HUVEC凋亡数量,而培养液中的HUVEC凋亡细胞数量最少。表1给出了细胞凋亡率的具体计算结果,可见HUVEC的细胞凋亡变化趋势与上文细胞粘附观察结果是一致的。

图1 HUVEC在316L不锈钢(a)和316L-Cu不锈钢(b)表面上培养24 h后的荧光染色照片Fig.1 Fluorescence staining images of HUVEC cultured on the surfaces of 316L stainless steel (a) and 316L-Cu stainless steel (b) for 24 h

表1 培养液、316L与316L-Cu不锈钢浸提液对HUVEC的细胞凋亡率的影响[34]Table 1 The effect of culture solution,extracts from 316L and 316L-Cu stainless steel on the cell apoptosis rates of HUVEC[34]
2.1.3 细胞迁移
利用Transwell实验考察材料对细胞迁移能力的影响。图2为HUVEC的Transwell实验结果。图2b显示,经过24 h共培养后有大量经过血清饥饿培养(已排除增殖对迁移能力影响)的HUVEC从Transwell insert 膜的上表面迁移至含有316L-Cu不锈钢浸提液的Transwell下室,而图2a中只有较少的HUVEC迁移至Transwell insert 膜的下表面,说明相比于316L不锈钢,316L-Cu不锈钢对HUVEC的迁移能力有明显的提升作用。

图2 Transwell实验结果(HUVEC):(a)316L不锈钢浸提液,(b)316L-Cu不锈钢浸提液Fig.2 The results of transwell essay of HUVEC with the extracts from 316L stainless steel (a),316L-Cu stainless steel (b)
2.1.4 定量PCR
进一步通过RT-qPCR实验,考察316L和316L-Cu不锈钢对促进血管生长的血管内皮生长因子(VEGF)和能够合成NO促进血管舒张的eNOS酶的影响。从图3可以看出,与316L-Cu不锈钢共培养3 d后的血管内皮细胞的VEGF和eNOS的mRNA表达均明显高于316L不锈钢,表明316L-Cu不锈钢能显著促进血管化过程。

图3 内皮细胞在不锈钢表面培养3 d后VEGF(a)和eNOS(b)的mRNA相对表达量[35]Fig.3 Relative mRNA expressions of VEGF (a) and eNOS (b) in cells cultured on the surfaces of stainless steels for 3 d (*p<0.05 compared with 316L)[35]
2.1.5 小管生成实验
小管生成实验可以评定材料有无促进血管内皮细胞形成管状结构的能力。由图4小管生成实验结果可以看出,316L不锈钢组中的细胞还处于比较分散的状态,而316L-Cu不锈钢组中的细胞已经连在了一起,形成了网络状结构。这说明316L-Cu不锈钢具有促进血管内皮细胞形成小管结构的能力。
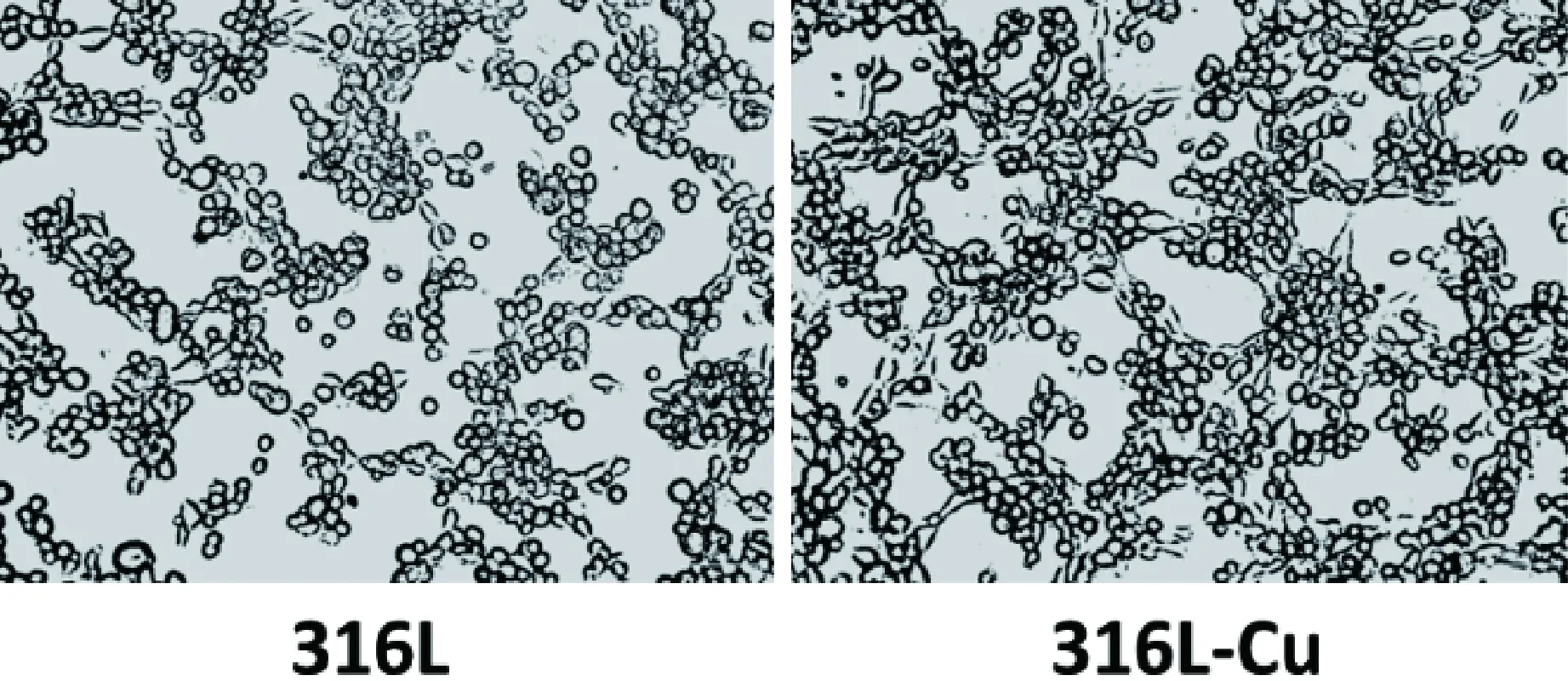
图4 小管生成实验照片[35]Fig.4 Images of tube formation essay[35]
早在20年前就有研究表明[36],铜离子能够促进血管再生。目前已有许多研究结果证明铜离子能够促进血管内皮细胞的增殖,从而加快血管的再生进程。Hu等[9]研究表明,铜离子能强烈地诱导血管内皮细胞增殖,其作用可以与bFGF(具有最佳刺激作用的血管内皮细胞生长因子之一)相媲美,并且铜离子不会改变血管内皮细胞的形态。McAuslan等[37]研究表明,铜离子是唯一能够诱导血管内皮细胞增殖并促进血管再生的金属元素。然而,铜离子诱导血管内皮细胞增殖的机理目前还不明确。支架内再狭窄的过程是有限的,当支架植入处的血管表面内皮化完成后,支架内再狭窄现象即会停止。血管内皮化的重建过程能够抑制由VSMC增殖引发的内膜增生,并且抑制炎症的发生。由此可见,由于含铜不锈钢能够明显促进血管内皮细胞的增殖与迁移,加快血管的再生和重建,因此有利于抑制支架内再狭窄的发生。
2.2 含铜不锈钢对动脉平滑肌细胞的影响
2.2.1 动脉平滑肌细胞在材料表面上的粘附
将动脉平滑肌细胞(VSMC)分别与316L和316L-Cu两种不锈钢共培养24 h、72 h,与316L-Cu不锈钢相比,无论培养时间是24 h还是72 h,316L不锈钢表面上粘附的VSMC数量都更多,且细胞密度大,细胞之间连接紧密,生长状态良好;316L-Cu表面上粘附的VSMC细胞数量远少于316L不锈钢表面,且细胞密度小,更加稀疏。以上结果表明,在316L中加入适量铜元素后可明显抑制VSMC在其表面上的增殖。
2.2.2 对细胞凋亡率的影响
在316L不锈钢浸提液中培养的VSMC的凋亡细胞数量少于316L-Cu不锈钢浸提液中培养的VSMC凋亡数量,而培养液中的VSMC凋亡细胞数量最少。表2给出了细胞凋亡率的具体计算结果,可见,研究培养液体对细胞凋亡的影响实验结果与上文所述的细胞粘附观察结果相一致,即316L-Cu不锈钢对VSMC生存有明显抑制作用。

表2 培养液、316L与316L-Cu不锈钢浸提液中VSMC的细胞凋亡率[34]Table 2 The effect of culture solution,extracts from 316L and 316L-Cu stainless steel on the cell apoptosis rates of VSMC[34]
2.2.3 细胞迁移
针对VSMC的Transwell实验结果显示,经过24 h共培养后,有大量经过血清饥饿培养(已排除增殖对迁移能力影响)的VSMC从Transwell insert膜的上表面迁移至含有316L不锈钢浸提液的Transwell下室,而316L-Cu只有较少的VSMC迁移至Transwell insert 膜的下表面,说明相比于316L不锈钢,316L-Cu不锈钢对VSMC的迁移有明显的抑制作用。
血管由内膜、中膜和外膜构成。VSMC存在于血管的中膜,是构成血管并维持其正常生理功能的基础,是决定血管活性、血管构型及维持血管张力的重要因素。VSMC的代谢、功能的改变或表型转化、异常增殖、迁移,与动脉粥样硬化、高血压、经皮腔内冠状动脉成形术及冠状动脉旁路移植术后血管再狭窄等的发生和发展密切相关。以上实验均证明316L-Cu不锈钢对VSMC迁移具有明显的抑制作用,因而使用含铜不锈钢制作冠脉支架,有望降低由VSMC迁移而引发的支架内再狭窄的风险。
2.3 含铜不锈钢对血栓形成的影响
2.3.1 动态凝血时间
动态凝血时间反映了材料与血液接触后,内源性凝血因子被激活的程度,可用以判断材料对内源性凝血过程的影响。图5给出了利用光密度(O.D.)测定的316L和3176-Cu不锈钢的动态凝血时间。O.D.值越高,表明材料表面的动态凝血时间越长。可以看出,316L-Cu不锈钢在不同时间点的O.D.值均高于316L,说明与316L不锈钢相比,316L-Cu不锈钢表面上相对不易发生凝血。测定结果表明,316L不锈钢与316L-Cu不锈钢的全凝时间分别为77 min与120 min,后者大大长于前者。由此可见,316L-Cu不锈钢抵御内源性凝血的能力优于316L不锈钢。
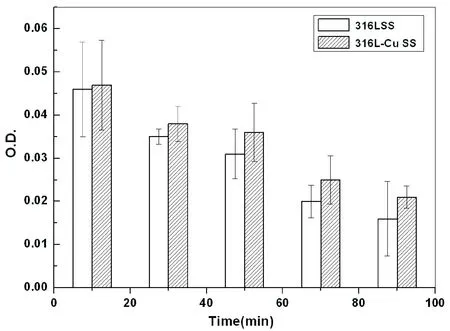
图5 316L不锈钢和316-Cu不锈钢的动态凝血时间比较[34]Fig.5 Comparison of effects of 316L and 316-Cu stainless steel on blood coagulation[34]
2.3.2 材料表面上的血小板粘附
血小板细胞质膜上结合有多种凝血因子,在血液凝固过程中具有重要作用,而且血小板还具有黏附异物的功能。当植入材料与血液接触后,血小板会在材料的表面黏附、聚集,达到一定程度后就会发生凝血,产生血栓。
图6为316L和316L-Cu不锈钢分别与血小板接触180 min后,材料表面血小板黏附形貌的SEM照片。可以看出,与血小板接触180 min后,316L不锈钢表面黏附了较多血小板,而且血小板出现了明显的聚集,有少部分已经伸出了尾足。而316L-Cu不锈钢表面仅黏附了极少量的血小板,血小板没有发生聚集现象,保持了较好的形态。
动态凝血时间测定以及血小板粘附实验结果均表明,与316L不锈钢相比,316L-Cu不锈钢能显著抑制血小板在其表面上的粘附,且具有更长的全凝时间。

图6 316L不锈钢(a)和316L-Cu不锈钢(b)与血小板接触180 min后表面血小板黏附的SEM 照片Fig.6 Morphology of platelet adherent on different materials after 180 min: (a) 316L stainless steel,(b) 316-Cu stainless steel
2.4 生物安全性
采用ICP-MS技术检测了316L-Cu不锈钢在生理盐水中浸泡至7 d内的Cu离子释放量,测得每日的Cu离子释放量为5×10-9~10×10-9g/L。如果拿一枚316L-Cu不锈钢冠脉支架进行测算,则其每日的Cu离子释放量数量级为10-3μg,远低于世界卫生组织(WHO)推荐的成人每日的Cu摄入量(2~3 mg)。
委托国家药监局认可的四川医疗器械生物材料和制品检验中心按照国家相关试验要求,对316L-Cu不锈钢进行了部分生物安全性检验。结果表明,材料的细胞毒性为0~1级(细胞相对增值率为99.7%),无迟发型超敏反应,无全身毒性,满足国家标准要求。皮内反应试验结果也满足国家标准要求。
2.5 动物植入研究
图7是316L-Cu不锈钢支架、316L不锈钢支架、市售L605合金载药支架分别植入猪冠脉后的血管内皮细胞覆盖情况照片。可以看到植入14 d后,3种支架表面均发生了血管内皮化。316L-Cu支架筋上几乎完全被形貌规则的梭形内皮细胞覆盖,内皮化完成良好。载药支架筋也几乎被内皮所覆盖,但仍然有少量裸露部分,且细胞形貌不规整。316L支架虽然被完整覆盖,但可以观察到很多白色点状物,其是红细胞、白细胞和血小板的复合物,意味着形成了较强的急性炎症和血栓性反应。
采用HE染色进一步评价316L-Cu不锈钢的促血管内皮化效果。图8所示是支架植入14 d后动物冠脉血管横截面的HE染色照片。316L-Cu不锈钢支架的血管内皮化明显优于载药支架,内皮重建完整,覆盖整个支架筋,且没有发生血管内膜增生。而载药支架筋几乎都裸露在外,内皮化很差。316L不锈钢支架的血管内皮化成度介于316L-Cu不锈钢支架和载药支架之间,有部分支架筋裸露在外。从内皮化程度的形态定量分析(图8D)可以看到,316L-Cu不锈钢支架明显优于另外两种支架。

图7 支架植入动物(猪)冠脉内14 d后,血管内皮细胞覆盖和内皮细胞形态学分析:(A)316L-Cu不锈钢支架,(B)L605合金载药支架,(C)316L不锈钢支架[35]Fig.7 SEM images of surface characterization of explanted endovascular stent following 14 d in animal artery: (A) endothelial coverage above struts in 316L-Cu-BMS,(B) DES,and (C) 316L-BMS (fig.a1,b1,b2,c1 are the zoomed-in images indicated by the black squares in fig.A,B,C)[35]

图8 支架植入14 d后的动物冠脉血管切片照片:(A)316L-Cu不锈钢支架,(B)L605合金载药支架,(C)316L不锈钢支架;(D)内皮化程度的形态定量分析[35]Fig.8 Photomicrographs of representative animal vessel sections afer 14 d intervention,representative Hematoxylin-eosin stain of explanted stents of 316L-Cu-BMS (A),DES (B),316L-BMS (C) (fig.a,b,c are the zoomed-in images indicated by the black squares in fig.A,B,C),and quantitative morphometric analysis of endothelialization scores (D)[35]
3 L605-Cu合金对支架内再狭窄的抑制作用研究
L605钴基合金是第二代冠脉支架材料,与第一代支架材料316L不锈钢相比,它具有更加优异的性能[38]。L605合金较高的密度提高了支架的射线可视性,使支架能更安全准确地输送到病变处。此外,L605合金的抗拉强度更高,使支架在保持原有径向力的同时,能加工得更细更薄,方便支架输送到更细的血管中。同时,较薄的支架壁减少了与血管接触的面积,金属覆盖率减小,有利于降低支架内再狭窄的发生率[39]。因此,L605钴基冠脉支架开发成功后,很快便在临床上得到了广泛的应用。
鉴于316L-Cu不锈钢在降低支架内再狭窄作用方面取得的一系列研究结果,在相同的思想指导下,设计和开发出含铜L605(L605-Cu)合金,以期达到同样的效果。为此主要对L605-Cu合金对血管内皮化及凝血的作用开展了研究。
3.1 细胞增殖
利用CCK-8实验可以研究内皮细胞在材料表面的增殖情况。图9为采用CCK-8实验得到的内皮细胞(HUVEC)在L605和L605-Cu合金表面上培养1 d和3 d后的增殖结果。可以看出,随着共培养时间的增长,两组材料表面的细胞数量均在增加。共培养1 d时,两种材料表面上的细胞数量几乎一致。共培养3 d时,L605-Cu合金表面上的细胞更多一些,但是与L605合金相比没有统计学差异。

图9 HUVEC在L605和L605-Cu合金表面上生长1 d和3 d后的增殖情况[40]Fig.9 Effect of experimental materials on the proliferation of HUVECs cultured for 1 d and 3 d,respectively[40]
3.2 细胞凋亡
表4给出了内皮细胞在L605和L605-Cu合金表面上培养1 d和3 d后的凋亡率。可以看出,共培养1 d和3 d时,L605-Cu合金表面的内皮细胞凋亡率均低于L605合金,表明其可以抑制内皮细胞的早期凋亡。因此,其长期植入后能够减缓内皮细胞的死亡,有利于血管的内皮化。

表4 内皮细胞在L605和L605-Cu合金表面上培养后的凋亡率[40]Table 4 The cell apoptosis rates of HUVECs on the surfaces of L605 and L605-Cu alloys[40]
3.3 细胞形态
图10为内皮细胞分别在L605和L605-Cu合金表面上共培养1 d和3 d后的vWF蛋白及细胞骨架染色照片。可以看出,材料表面上的细胞均能正常表达vWF,共培养3 d后,L605-Cu合金表面上内皮细胞的数量更多一些。图10b显示,共培养1 d时,两种合金表面上的细胞铺展情况均很好,L605-Cu表面上的细胞大多都伸出了丝状伪足。共培养3 d时,相比于L605合金,L605-Cu合金表面上的细胞骨架微丝特异性染色更深,说明细胞中F-肌动蛋白的含量更高。由此可见,L605-Cu合金表面应更适合内皮细胞的生长和迁移。
3.4 细胞迁移
划痕实验及Transwell实验均能够用于表征细胞的迁移能力。图11a为划痕实验和Transwell实验的照片。划痕实验结果显示,24 h后两种合金组中均有部分内皮细胞迁移到了划痕中间(图中两条直线代表划痕刚形成时的位置)。分析初始和24 h拍摄的照片可知,L605和L605-Cu合金之间的细胞相对迁移面积没有统计学差异(见图11b)。然而在Transwell实验中,有更多的内皮细胞受到含Cu浸提液的作用而实现了迁移,并且分析结果显示两组之间存在统计学差异(图11c)。
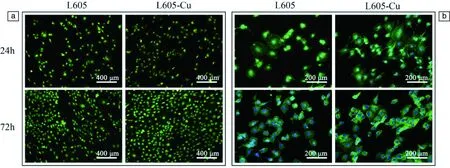
图10 内皮细胞在L605和L605-Cu合金表面生长1 d和3 d后的荧光染色照片:(a)vWF,(b)细胞骨架[40]Fig.10 Cell attachment on the surface of L605 and L605-Cu alloys: (a) vWF staining,(b) cytoskeleton staining[40]

图11 L605及L605-Cu合金浸提液对内皮细胞迁移的影响:(a)划痕实验及Transwell实验的代表性照片,(b)划痕实验中的相对迁移面积,(c)Transwell实验中的细胞迁移数[40]Fig.11 Effect of extracts from L605 and L605-Cu alloys on cell migration: (a) typical images of wound scratch assay and Transwell assay,(b) the quantitative analysis of scratch assay,(c) the amounts of cells migrated toward the extracts in Transwell assay[40]
3.5 小管生成
内皮细胞的迁移能力得到增强后,可能会更快地形成血管。图12a为内皮细胞在L605和L605-Cu合金的浸提液作用下形成的毛细血管状结构的照片。L605-Cu合金的浸提液使内皮细胞更快地形成了小管结构;在同样的时间内,L605合金的浸提液中的内皮细胞之间还没有形成完整的网络。通过对小管长度和节点数进行定量分析后发现,含Cu合金浸提液能明显增加这两个参数的值,证明L605-Cu合金能促进小管的生成(图12b,12c)。所以,L605-Cu合金有望通过提升内皮细胞的迁移能力和小管形成能力加速血管的内皮化进程。

图12 细胞在L605及L605-Cu合金浸提液的作用下形成的管腔结构(a)以及小管长度(b)和节点数(c)定量的结果[40] Fig.12 Tube formation induced by extracts of L605 and L605-Cu,respectively (a),quantitation of the results by measuring tube length (b) and branching points (c)[40]
3.6 VEGF和NO的分泌及基因表达
VEGF和NO是在血管生成过程中很重要的两种物质。图13a为内皮细胞与样品共培养1 d和3 d后,细胞培养上清液中的VEGF含量。由图可知,虽然两个合金组的数据之间没有统计学差异,但是与L605相比,L605-Cu合金上清液中的VEGF含量平均值有轻微上升的趋势。内皮细胞与样品共培养后,向培养液中释放的NO量随着培养时间的增长而增加,但L605和L605-Cu两个合金组之间的数据没有统计学差异(见图13b)。RT-qPCR实验结果说明,L605-Cu合金使VEGF的mRNA表达增加了1.8倍(见图13c),但并不能增加eNOS的mRNA表达(见图13d)。
已有研究证实,Cu离子能够增加内皮细胞中VEGF的合成和分泌[38,39,41]。尽管L605-Cu合金能够明显增加内皮细胞中VEGF的mRNA相对表达量,但是却没有增加VEGF的分泌量。这可能是由于共培养的时间不够充分,不足以使两个合金组之间表现出差异性。尽管很多含Cu材料也能够增加内皮细胞中NO的合成与分泌,但是L605-Cu合金并没有展现出同样的性能,这可能是因为L605-Cu合金在检测时间内溶出的Cu离子量不足以起到该作用。
3.7 动态凝血
在动态凝血实验中,血液的凝固程度同游离的血红蛋白数量成反比,所以凝固的越快,吸光度的值越低。如图14所示,在90 min的测定时间内,L605-Cu合金表面上的血液凝固时间始终大于L605合金的血液凝固时间。因此,L605-Cu合金的血栓发生率更低。支架的植入易导致血管内壁受损,引发凝血级联反应。因而支架表面对凝血的影响十分重要,L605-Cu合金更加优异的血液相容性有助于减少血栓的发生。

图13 共培养上清液中VEGF(a)及NO(b)的含量,共培养3 d后细胞中VEGF(c)及eNOS(d)的mRNA相对表达量[40] Fig.13 Concentrations of VEGF (a) and NO (b) in supernatant,gene expressions of VEGF (c) and eNOS (d) in cells cultured for 3 days[40]
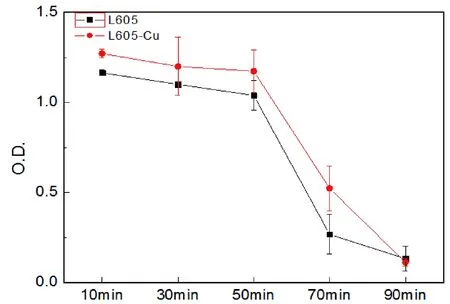
图14 L605和L605-Cu合金的动态凝血趋势Fig.14 Effects of L605 and L605-Cu on blood coagulation
4 结 语
从以上研究结果可以看出,通过在含铜金属表面持续和微量释放Cu离子,使医学研究发现的Cu离子在维持和修复心血管方面的有益作用得到验证。无论是体外实验还是体内实验,都证明含铜金属表面释放的微量Cu离子能够促进血管生成,并具有抑制动脉平滑肌细胞增殖和降低血栓形成几率的作用,这些有益作用均有助于降低支架内再狭窄发生率。由此可见,Cu离子通过对一系列生长因子的调控作用来影响血管的功能,进而对心血管系统的健康产生重大影响。因此,在现有心血管支架用金属材料中适量添加Cu是一种有效减小支架内再狭窄发生风险的新途径,新型含铜金属材料有望成为新一代心血管支架材料而得到临床应用。

