亚低温对放射性肺损伤大鼠的保护作用
王远飞,李曙芳,王新钢,王永丽,许文黎,黄立群,岳娟,安全
(中国辐射防护研究院药物安全性评价中心,药物毒理与放射损伤药物山西省重点实验室,中核放射毒理与放射性药物临床前评价重点实验室,太原 030006)
最新的癌症统计报告指出[1]:肺癌为我国癌症发病率之首,乳腺癌在女性癌症中发病率最高。随着一系列胸部肿瘤放疗的增加,射线导致的肺部损伤尤为突出[2](发生率约为15% ~20%),但是传统的放射性肺损伤防治方法都存在很大的弊端,所以新的防治手段亟待提出。亚低温在神经系统等方面的保护作用已被广泛研究,并应用于颅脑损伤、心胸外科、急性肺损伤等领域[3],但在放射性肺损伤防治方面报道较少。因此,本实验拟通过X线模拟机定位,直线加速器照射复制大鼠放射性肺损伤模型,并给予亚低温干预,观察并比较亚低温与临床常用药氨磷汀对放射性肺损伤的防护效果,期望能够对亚低温防治放射性肺损伤提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
6~8周龄SPF级雄性SD大鼠75只,体重(205±15)g,由北京维通利华实验动物公司提供【SCXK(京)2016-0006】。动物饲养于中国辐射防护研究院GLP中心动物实验室【SYXK(晋)2013-0002】。
1.1.2 主要仪器与设备
Elekta Synergy型医用电子直线加速器、SL-IE型放射治疗模拟机由山西大医院放疗科提供;H0-3多通道温度巡检仪、福意联恒温箱、石蜡包埋机、石蜡切片机、全自动组织脱水机、CX21型生物显微镜(Olympus)、酶标仪等由中国辐射防护研究院毒理室提供。
1.1.3 主要试剂
注射用氨磷汀注射液(开封明仁药业有限公司);超氧化物歧化酶、还原型谷胱甘肽、丙二醛测定试剂盒、Masson染色试剂盒(南京建成生物工程研究所);肿瘤坏死因子(TNF-α)Elisa试剂盒,细胞凋亡检测试剂盒,DAB染色试剂盒(博士德生物)。
1.2 方法
1.2.1 实验动物分组
75只SD大鼠随机分为5组:空白对照组、单纯照射组、氨磷汀阳性组、亚低温预防组、亚低温治疗组,每组15只。每5只一组分笼饲养。
1.2.2 模型建立及亚低温干预
10%水合氯醛(3 mL/kg)腹腔注射麻醉后,仰卧位固定,在X线模拟机下定位照射野(全肺),并标记;用12 MeV电子线[4]进行20 Gy垂直单次照射,源皮距100 cm,照射深度3 cm,剂量率300 cGy/min。空白对照组单纯麻醉,不进行照射;单纯照射组在麻醉后进行定位及射线照射;氨磷汀阳性组在照射前0.5 h内腹腔注射氨磷汀(150 mg/kg)[5];亚低温预防组在麻醉后预先用冰袋使动物体温降至(34±1)℃范围内即行射线照射并维持亚低温6 h;亚低温治疗组在照射后立即将大鼠置于可调节温箱中,使其体温维持在(34±1)℃范围内并持续6 h[6]。除亚低温实验组外其余各组动物体温一律保持在正常基础体温内,体温用多通道肛温仪监测,并用恒温箱调控。
1.2.3 标本取材及处理
于照射后6 h、14 d和35 d共3个时间点各组麻醉处死5只大鼠,腹主动脉取血并于-80℃保存,称取全肺组织重量,计算肺系数(肺质量mg/体重g×100%)。取各大鼠右肺前叶迅速置于4%多聚甲醛溶液中固定24 h,病理取材,石蜡包埋后行HE及Masson染色,观察病理组织学的变化,其余肺组织分装后于-80℃中保存。检测血清中的SOD、MDA、GSH含量;凋亡检测试剂盒观察各组大鼠肺组织凋亡情况;检测各组肺组织匀浆中细胞因子TNF-α含量。
1.3 统计学方法
实验数据用均数±标准差表示。用SPSS 17.0统计分析软件进行方差分析(One-Way ANOVA),两两比较方差齐时采用Bonferroni方法检验,方差不齐时用Games-Howell方法检验。P< 0.05为差异有统计学意义。
2 结果
2.1 大体观察
空白对照组大鼠正常生长,无不良反应发生;单纯照射组大鼠在照射7 d后皮肤毛躁,相对于空白对照组活动迟缓,在14 d左右出现胸毛脱落现象,在照射后第35天呼吸频率明显加快,胸部毛发脱落严重;氨磷汀阳性组及亚低温组相对于单纯照射组症状较轻。空白对照组大鼠肺组织表明光滑,呈粉红色,弹性良好;照射后第14天单纯照射组大鼠肺部颜色发暗,外形无明显变化,氨磷汀组及亚低温组差异不大,见图1;照射后第35天单纯照射组大鼠肺部明显肿胀增大,颜色发紫并有白色结节,氨磷汀组及亚低温预防组也有轻微小结节,肺组织颜色加深,见图2,大鼠肺系数结果见表1,第35天时,单纯照射组的肺系数明显提高,氨磷汀组和亚低温预防组都有所降低(P< 0.05),肺组织失代偿性增大,而各干预能改善其肺功能。
2.2 肺组织病理组织学及胶原沉积观察
正常对照组肺组织结构清晰,各级支气管、肺泡管、肺泡囊及肺泡间隔结构正常,未见充血、水肿,炎细胞浸润等改变。照射后当天,各组肺组织病理镜检均未见异常;在照射后第14天,单纯照射组肺泡结构改变伴中度纤维化出现,阳性对照组及亚低温预防组有中度纤维化但无肺泡间隔结构改变,亚低温治疗组肺泡腔及支气管壁轻度纤维化;照射后第35天,单纯照射组肺泡及肺泡壁内充满炎性细胞并伴严重的肺泡壁结构改变及纤维化,阳性组及亚低温预防组纤维化程度加重,亚低温治疗组炎症及纤维化程度也有所增加,程度较轻。如图3、图4。

注:从左至右依次为空白对照组、单纯照射组、氨磷汀阳性组、亚低温预防组、亚低温治疗组。图1 照射后第14天肺组织肉眼观察Note. From left to right: Control group, Model group, Amifostine group, Mild hypothermia prevention group, and Mild hypothermia treatment group, respectively.Figure 1 Lung tissues at 14 d after irradiation

注:从左至右依次为空白对照组、单纯照射组、氨磷汀阳性组、亚低温预防组、亚低温治疗组。图2 照射后第35天肺组织肉眼观察Note. From left to right: Control group, Model group, Amifostine group, Mild hypothermia prevention group, and Mild hypothermia treatment group, respectively.Figure 2 Lung tissues at 35 days after irradiation

注:A.空白对照组;B.单纯照射组;C.阳性对照组;D.亚低温预防组;E.亚低温治疗组。图3 照射后第14天肺组织病理变化(HE染色,×200)Note. (A) Control group. (B) Model group. (C) Amifostine group. (D) Mild hypothermia prevention group. (E) Mild hypothermia treatment group.Figure 3 Pathological changes in the rat lung tissues at 14 d after irradiation(HE staining, ×200)
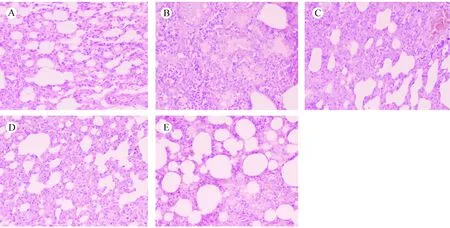
注:A.空白对照组;B.单纯照射组;C.阳性对照组;D.亚低温预防组;E.亚低温治疗组。图4 照射后第35天肺组织病理变化(HE染色,×200)Note. (A) Control group. (B) Model group. (C) Amifostine group. (D) Mild hypothermia prevention group. (E) Mild hypothermia treatment group.Figure 4 Pathological changes in the rat lung tissues at 35 d after irradiation (HE staining, ×200)
Masson染色阳性是指肺泡及肺泡间隔内出现蓝染条索状物,为增生的胶原纤维组织。如图5、图6观察可见:照射后14 d时单纯照射组的胶原沉积较多,各干预组有少量沉积;照射后35 d时单纯照射组胶原含量增加,氨磷汀组及亚低温组胶原含量略有升高,程度较轻。提示亚低温干预温能减轻放射性肺炎及纤维化的发生、发展程度,与氨磷汀防护效果相近。
2.3 不同时间点大鼠抗氧化能力
与正常对照组比较,各照射组SOD活性都有下降趋势;与单纯照射组比较,第14天时亚低温治疗组的SOD活性恢复明显(P< 0.05),第35天时氨磷汀阳性组及亚低温治疗组SOD活性回升,差异有统计学意义,恢复效果优于亚低温预防组;与单纯照射组比较,阳性组及亚低温干预组第14天血清中MDA含量均明显降低(P< 0.05),第35天单纯照射组含量依然最高;各时间结点照射组的GSH含量都低于空白对照组,趋势明显。提示亚低温在放射性肺损伤大鼠的抗氧化能力方面有较好的作用,结果列于表1。
2.4 辐照后大鼠肺组织中细胞因子TNF-α含量变化
照射后6 h除空白对照组维持在正常水平外,其余各组TNF-α含量迅速升高,其中单纯照射组升高明显,氨磷汀阳性组及亚低温治疗组与单纯照射组相比,上升程度较低(P< 0.05);照射后第14天,各受照组仍处于较高水平,相较于照射后6 h略有下降,但各组间差异不明显,见表2,表明亚低温治疗组在辐照前期对炎症细胞因子有很好的抑制作用。
2.5 大鼠肺组织中细胞凋亡改变
利用免疫组化对细胞凋亡部位进行染色,阳性部位为细胞核。照射后当天,各组肺组织病理镜检均未见阳性,单纯照射组肺泡上皮有多量细胞核呈棕黄色阳性,阳性组及亚低温治疗组有较多细胞核呈棕黄色,亚低温预防组有极少量细胞核呈棕黄色。观察显示单纯照射组发生细胞凋亡更加明显,各干预组有所下降,亚低温预防组凋亡细胞最少。各组镜下观察如图7。
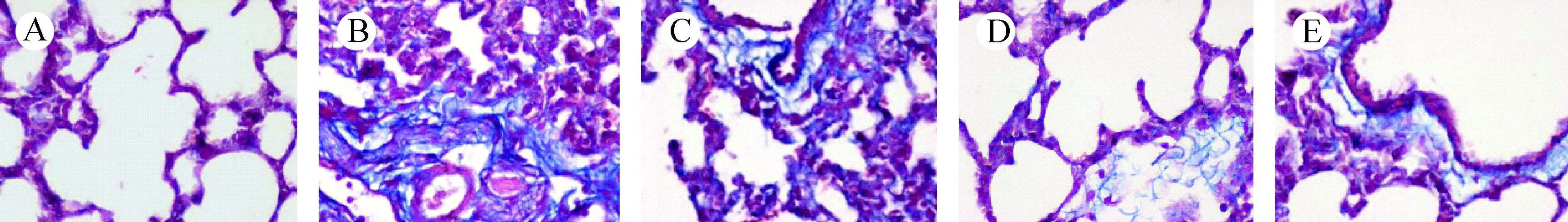
注:A.空白对照组;B.单纯照射组;C.阳性对照组;D.亚低温预防组;E.亚低温治疗组。图5 照射后第14天肺组织病理变化(Masson染色,×400)Note. (A) Control group. (B) Model group. (C) Amifostine group. (D) Mild hypothermia prevention group. (E) Mild hypothermia treatment group.Figure 5 Pathological changes in the rat lung tissues at 14 d after irradiation(Masson staining, ×400)
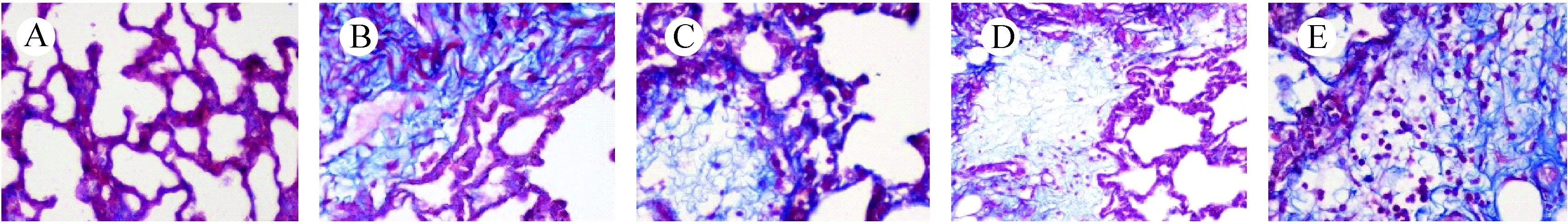
注:A.空白对照组;B.单纯照射组;C.阳性对照组;D.亚低温预防组;E.亚低温治疗组。图6 照射后第35天肺组织病理变化(Masson染色,×400)Note. (A) Control group. (B) Model group. (C) Amifostine group. (D) Mild hypothermia prevention group. (E) Mild hypothermia treatment group.Figure 6 Pathological changes of the rat lung tissues at 35 d after irradiation(Masson staining, ×400)
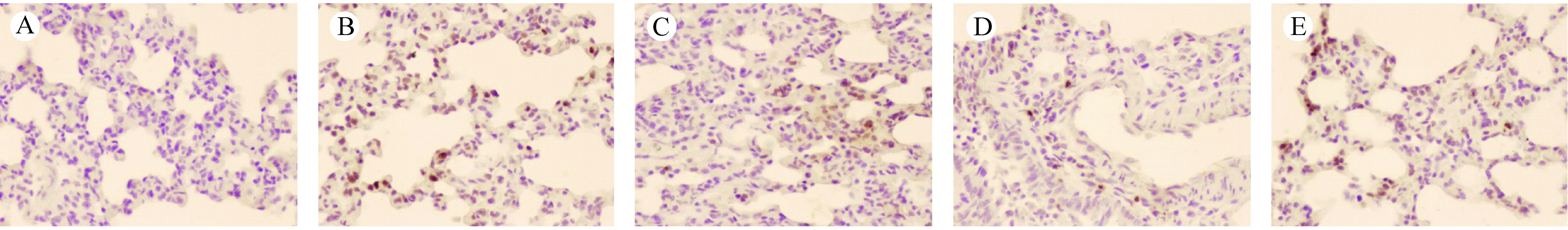
注:A.空白对照组;B.单纯照射组;C.阳性对照组;D.亚低温预防组;E.亚低温治疗组。图7 照射当天肺组织细胞凋亡(TUNEL染色,×200)Note. (A) Control group. (B) Model group. (C) Amifostine group. (D) Mild hypothermia prevention group. (E) Mild hypothermia treatment group.Figure 7 Cell apoptosis in the lung tissues on the day of irradiation(TUNEL staining, ×200)
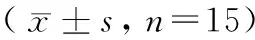
表1 不同时间点大鼠各实验参数比较Table 1 Comparison of the experiment parameters of rats at different time points n=15)
注:与单纯照射组比较,*P< 0.05;与空白对照组比较▲P< 0.05。
Note. Compared with Model group,*P< 0.05. Compared with Blank group,▲P< 0.05.

表2 肺组织匀浆中TNF-α含量Table 2 Tumor necrosis factor α content in lung homogenates at different time points n=10)
注:与单纯照射组比较,*P< 0.05。
Note. Compared with Model group,*P< 0.05.
3 讨论
放射性肺损伤有两种表现形式:放射性肺炎和放射性肺纤维化。关于这两种形式的出现时间及关联一般认为[7],放射性肺纤维化是由急性放射性肺炎发展而来,是损伤的第二个阶段。通过实验,照射后第14天时单纯照射组肺组织炎症反应明显,亚低温干预能减轻组织炎症,照射后第35天时单纯照射组有明显的纤维化出现,氨磷汀和亚低温干预都能减轻纤维化的程度,有防护放射性肺损伤的作用。
放射性肺损伤的发病机制主要为:经过射线照射后超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等自由基清除酶活性降低,会使自由基清除出现障碍导致自由基的大量蓄积,进而引发一系列生物膜脂质过氧化反应损伤肺实质;同时肺组织受到射线刺激后会释放大量的炎症细胞因子,诱导淋巴细胞等炎性细胞的渗出,其中TNF-α是体内多种细胞因子的启动因子[8],可以诱导IL-6等其他细胞因子的合成释放,产生瀑布效应,并能够激活血小板、中性粒细胞等,进一步释放氧自由基、脂质代谢产物等介质,加重肺组织损伤。亚低温治疗在心脑血管等外科手术中应用多年,对正常组织及各项生理指标几乎没有影响[9]。本实验中,通过亚低温的干预能明显提高辐照大鼠的SOD活力,作为体内最重要的抗氧化酶,改善机体清除自由基的能力意义重大;还原型谷胱甘肽是一种含巯基的还原剂[10],可以通过减少氧自由基的含量发挥治疗放射性肺损伤的作用,实验中亚低温治疗组及氨磷汀阳性组都能够很好的提高辐照后大鼠的GSH含量,效果相近;丙二醛是自由基作用于脂质发生过氧化反应的终产物,能间接反应机体氧化的程度,实验各干预组能明显降低其含量,达到保护的作用,但各干预组保护效果相近,差异不明显;作为放射性肺损伤的细胞前炎症因子,TNF-α在辐照初期改变较大,氨磷汀及亚低温干预能够很大程度的减少其激活,降低损害机率;放射性肺损伤发生后,适度的细胞凋亡可以清除肺泡腔及间质中异常增殖的炎性细胞以恢复肺组织正常结构,但是过度的细胞凋亡,尤其是肺泡上皮细胞等框架细胞的过度凋亡会导致组织结构的破坏,产生纤维化[11],单纯照射组中肺组织细胞大量凋亡,平衡破坏,而各干预组能够降低凋亡细胞数,抑制凋亡。
氨磷汀是一种细胞毒性保护剂,通过抑制射线产生的过氧化物作用而减轻肺损伤,其防护作用在临床上已经被广泛认可,但是在临床应用过程中会出现胃肠道功能失调、低血压、低钙性手足搐愵等不良反应[12],这也就需要我们去找到更好的防护方法。本次实验很好的复制了大鼠放射性肺损伤模型,并且通过干预发现,氨磷汀组和亚低温治疗组在抗氧化及抗炎症等方面都有明显的防护作用,说明亚低温治疗在放射性肺损伤防治方面或可达到替代氨磷汀的实验要求,为将亚低温应用于临床胸部肿瘤患者的放疗防护提高了实验基础。
亚低温治疗方法在放射性肺损伤防护方面具有保护作用,但是具体的作用机制还不清楚,而且最佳的临床应用条件也需要进一步摸索,这也为以后的研究提供了的思路。

