人溃疡性结肠炎与大鼠模型的组织病理学变化比较及机制探讨
鲁香凤,张书信,傅丽元,戴欣,孙浩
(1. 北京中医药大学东直门医院; 2. 病理科; 3. 肛肠科,北京 100700)
溃疡性结肠炎(ulcerative colitis,UC)是一种主要累及直肠、结肠黏膜、黏膜下层的慢性非特异性肠道炎症和溃疡性疾病,常伴不典型增生,部分可发生癌变,一般认为与感染、食物因素、免疫缺陷、分泌的粘液异常、基因缺陷和心理不正常等因素有关[1-2],是现代难治病。
国内外多位学者研究均认为葡聚糖硫酸钠(dextran sulfate sodium,DSS)复制UC模型是最近似人UC的模型[3-6],但与人UC之间的区别与联系尚未见报道。为进一步研究UC发病机制及中药疗效机制,我们采用DSS复制大鼠UC模型,并观察张书信治疗UC有效方剂[7]的预防治疗作用,发现疗效不佳,为探讨其原因,将DSS复制大鼠UC模型与人UC进行了比较,发现二者在病因、早期大肠黏膜病变、脉管病变及血栓形成、隐窝腔内容物、黏膜溃疡形成过程及机制、间质浆细胞数量、隐窝干细胞损伤的时期及程度、中医证型等方面均有所不同,现总结如下。
1 材料与方法
1.1 材料
1.1.1 实验动物
6周龄SPF级SD雄性大鼠20只,体重(200±20)g,购于北京维通利华实验动物技术有限公司【SCXK(京)2016-0011】,饲养于北京中医药大学东直门医院中药药理学实验室屏障环境动物室【SYXK(京)2015-0001】。所有操作均符合实验动物伦理学要求(伦理审批号:17-21)。
1.1.2 实验试剂
DSS相对分子量为(36~50)×103,购自美国MP Biomedicals公司;大便潜血试剂盒(北京雷根生物技术有限公司);3.5%水合氯醛(国药集团化学试剂有限公司);无水酒精(北京贞玉民生药业有限公司);4%多聚甲醛(北京索莱宝科技有限公司)。
1.1.3 实验仪器
5 ml注射器;剪刀;钳子;玻璃平皿;玻璃烧杯等;全自动脱水机(Thermo Excelsior AS,德国);石蜡切片机(HM325型轮转式切片机,德国);光学显微镜(AX1O Lab.A1,德国);图像采集系统(RPT-PathQC,中国)。
1.1.4 临床材料
选取北京中医药大学东直门医院诊治的人UC 9例,其中1例为部分肠管切除,8例为结肠镜活检。
1.2 方法
1.2.1 5% DSS配制及造模方法[8]
将DSS以5%质量体积比(w/v)溶解于去离子水中,每日现用现配。20只大鼠分为正常组和模型组各10只,模型组大鼠自由饮用5% DSS 10 d,正常组饮用去离子水10 d。
1.2.2 动物观察方法
观察大鼠毛泽、活动、食量、大便性状及肛门局部情况等,并测量大鼠体重及大便潜血(邻联甲苯胺法)等。
1.2.3 标本取材、组织处理及染色方法
实验到期后,大鼠禁食不禁水12 h,抽血后取全部大肠并量取长度,用9%生理盐水冲洗肠内容物。人UC 8例为结肠镜下取黏膜病变区活检2~3块,1例为手术切除部分肠管。
所有标本均经4%中性甲醛固定,常规石蜡包埋切片(厚度约4~5 μm),HE染色。
1.2.4 病理学观察方法
大体观察:肠壁厚度、外膜病变、大肠黏膜糜烂溃疡及结节等。
光镜观察:大肠黏膜炎症、隐窝脓肿及结构、糜烂溃疡等。
2 结果
2.1 大鼠实验结果
2.1.1 一般状况
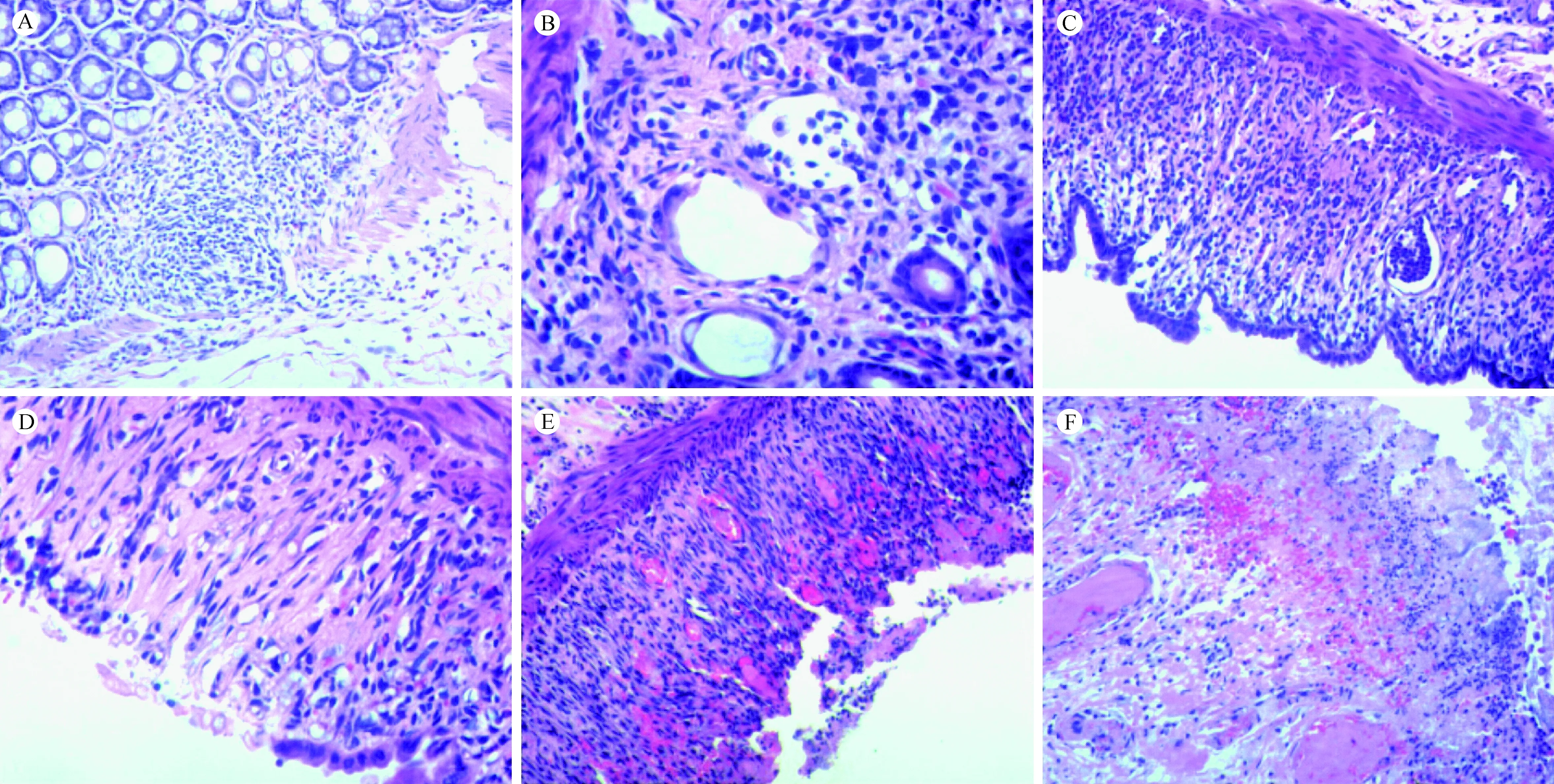
注:A.早期病变始于大肠黏膜固有层下1/3隐窝消失,其周围隐窝扩张。B.大肠黏膜中下2/3层隐窝消失,其旁部分隐窝扩张,少数隐窝腔内以巨噬细胞为主。C.大肠黏膜全层隐窝消失,偶见隐窝脓肿,部分表面上皮呈绒毛状。D.大肠黏膜全层隐窝消失,部分表面上皮变性坏死并脱落,炎症较轻。 E.大肠黏膜糜烂溃疡,固有膜多个血管腔内可见血栓形成。F.大肠黏膜溃疡深及黏膜下层伴出血,黏膜下多个血管腔内可见血栓形成。图1 DSS模型组大肠黏膜病理变化(HE染色,A、B、C、D、F ×200;E×100)Note. (A) Early lesions begin with the disappearance of the lower 1/3 of crypts in the lamina propria in the large intestine, with dilatation of the surrounding crypts. (B) The crypts in the lower 2/3 layer of the large intestine disappear, and the adjacent partial crypts expand. Macrophages are mainly observed in the cavities of a few crypts. (C) The full layer crypts of the large intestine disappear, with occasional crypt abscesses and villous surface epithelia. (D) The full-thickness crypts of the large intestine disappear, and the partial surface epithelium become necrotic, with reduced inflammation. (E) Mucosal erosion and ulceration of the large intestine, with thrombosis in the majority of blood vessels in the lamina propria. (F) Ulcer of the colorectal mucosa and submucosa, with hemorrhage and thrombosis in numerous vessels in the submucosa. (HE staining).Figure 1 Colorectal mucosal lesions in dextran sulfate sodium (DSS) model group(HE staining. A, B, C, D, F ×200. E×100)
正常组:大鼠活动、食量及二便均正常,毛发光泽,粪便质地较硬,暗褐色,呈椭球形,体重增长较快。
DSS模型组:造模第3天,动物活动减少,反应迟缓,毛发欠光泽;第4天5只出现软便,2只狂躁;第5天部分动物出现粘液便,肛周污秽,个别反应迟钝;第6天部分反应迟钝;第7天部分动物肛门潮湿,个别大便伴点状出血;第9天部分动物潜血(+)或肉眼血便,个别大便变细,体重下降。
2.1.2 大体观察
正常组:大肠总长度约12.5~23 cm,黏膜淡红、光滑完整,皱襞清晰,无出血点。
DSS模型组:大肠总长度约8.5~20 cm,部分肠壁增厚,黏膜可见多个大小不等溃疡,针尖样或不规则形,切面灰白色,质中,部分黏膜皱襞变平,部分近肛门处黏膜呈结节状隆起,病变以直肠和左半结肠为主。
2.1.3 光镜观察
(1)正常组:大肠黏膜上皮细胞排列整齐紧密,隐窝结构正常,杯状细胞多,偶见或少量炎细胞浸润。
(2)DSS模型组:多数动物大肠黏膜早期病变始于固有膜下1/3隐窝萎缩消失(图1 A),其旁可见隐窝脓肿伴/不伴隐窝扩张(图1B),逐渐向中表层及周围扩展,直至全层隐窝萎缩消失,部分隐窝腔内为单核巨噬细胞,局部表面上皮呈绒毛状(图1C),仅少数病例始于中上1/3隐窝,隐窝消失区炎症较轻,早期仅见单核巨噬细胞,未见或极少浆细胞,然后表面上皮出现变性坏死并脱落(图1D),随之黏膜糜烂溃疡形成,常伴出血,固有膜间质纤维母细胞增生,与表面垂直(图1E),固有膜及黏膜下层可见多个血管内纤维素血栓形成,偶见血栓伴机化,随着病变进展,溃疡表面纤维素及中性粒细胞渗出由少到多,并见细菌及霉菌(图1F),部分病例溃疡广泛,深达黏膜下层;1只黏膜下小血管壁伴纤维素样坏死;多数病例淋巴小结上方可见黏膜溃疡,间质炎症主要累及黏膜和黏膜下层,少数累及全层,局部上皮呈轻度不典型性,未见癌变;部分黏膜下层因高度水肿伴或不伴出血而显著增宽;部分黏膜下及浆膜面纤维化,1只肠壁固有肌层局灶纤维化;局部扩张的淋巴管内可见淋巴细胞淤积,近肛侧端黏膜及黏膜下层可见淋巴组织增生、淋巴小结及集合淋巴小结形成。
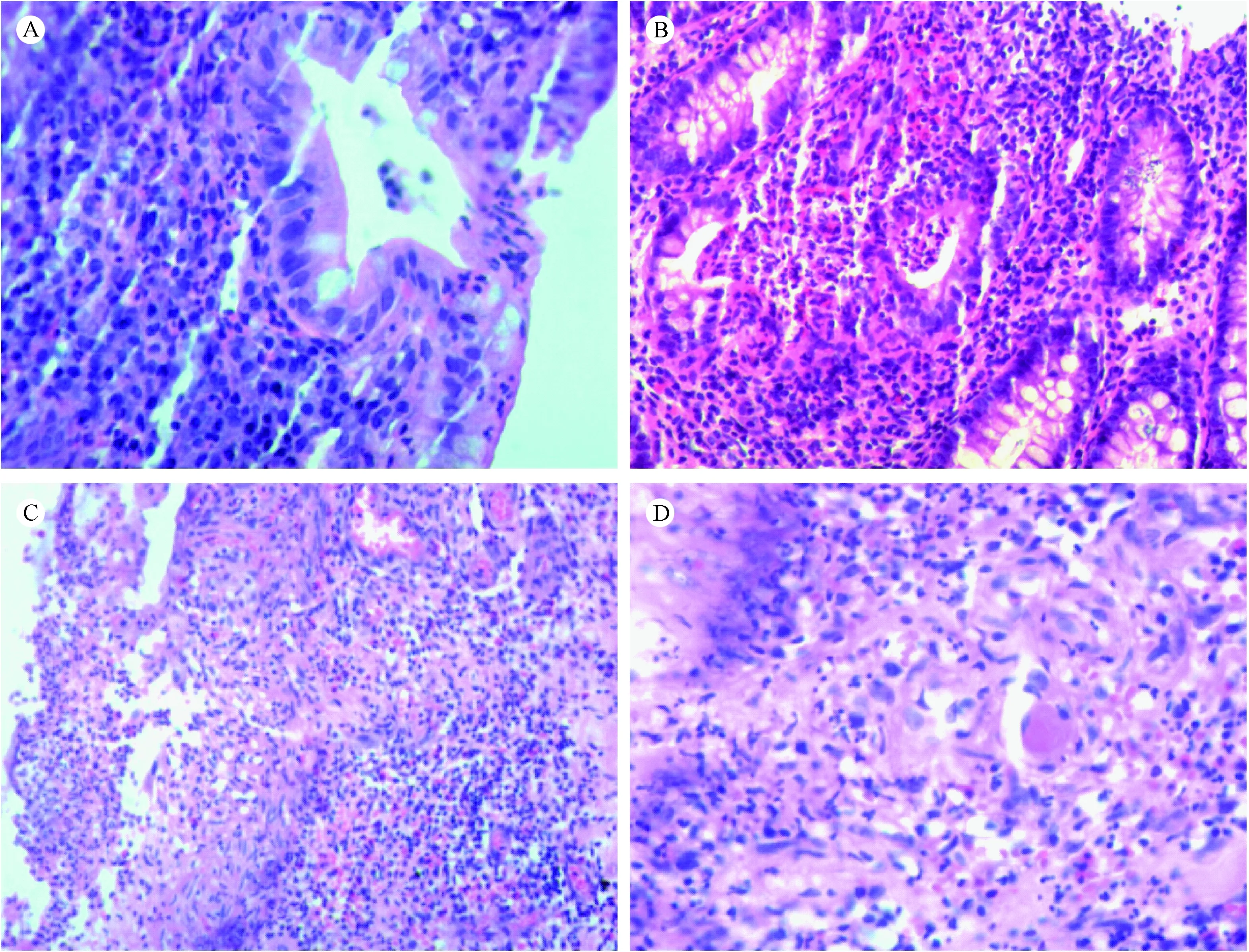
注: A.早期中性粒细胞浸润表面上皮和浅层黏膜隐窝。 B.隐窝脓肿破坏隐窝形成隐窝溃疡。C.大肠黏膜急性期溃疡。D.大肠黏膜溃疡处血管内偶见微血栓形成。图2 人UC大肠黏膜病理变化(HE染色, ×200)Note.(A) Early infiltration of neutrophils the surface epithelia and superficial mucosa crypts. (B) The crypt abscess destroys the crypts and forms crypt ulcers. (C) Acute stage ulcers of the colorectal mucosa. (D) Formation of microthrombi in the blood vessels of the UC of the large intestine.Figure 2 Colorectal mucosal lesions in human ulcerative colitis (UC)(HE staining, ×200)
2.2 临床病例观察结果
2.2.1 临床资料
共9例,其中男性4例,年龄自35-77岁,平均63.5岁;女性5例,年龄自31~61岁,平均43.8岁;8例为肠镜活检,1例(男性,73岁)为手术切除部分肠管。
2.2.2 大体所见
1例为横结肠及降结肠肠管一段,长约23.5 cm,大肠黏膜呈天鹅绒状,病变连续,可见多个大小不等的溃疡,最大者直径约0.8 cm,最小者针尖大,溃疡底平坦,边缘隆起,切面灰白色,质韧脆,部分区呈息肉样;其余8例活检均为粟粒大灰白色软组织。
2.2.3 光镜所见
均见大肠黏膜慢性炎、隐窝炎(图2 A)、隐窝脓肿(图2B)、隐窝结构紊乱及萎缩、糜烂溃疡(图2C)及腺体轻度不典型增生等,8例活检组织均未见血栓;肠管切除病例急性期和消散期病变共存,固有膜偶见血管内微血栓,未见机化(图2D),局部固有肌层内血管内膜明显增厚,可见血栓形成并机化,溃疡旁可见炎性息肉和/或腺瘤形成,局部隐窝萎缩区炎症不明显;消散期中性粒细胞减少,特别是隐窝脓肿减少,乃至消失,局部表面上皮再生,隐窝分支不规则,甚至短缩,其基底部与黏膜肌的距离增加,浆细胞增多;局部可见异型增生腺体浸及黏膜下层,局部肌层可见血管脂肪纤维组织增生,黏膜下及浆膜面可见纤维化,局部伴结肠黑变病,固有肌层及浆膜面均可见陈旧性出血;局部淋巴管扩张,但未见淋巴细胞淤积,局部伴淋巴小结及集合淋巴小结形成。
3 讨论
DSS复制大鼠UC模型与人UC有如下异同之处:
3.1 临床表现
人UC病程长,临床表现为便血、痉挛性腹痛和腹泻等,常伴营养缺乏和贫血等;DSS模型病程短,有粘液便、大便带血或血便,体重不同程度减轻等。
3.2 大肠黏膜组织病理学变化
二者均存在隐窝干细胞损伤,不同之处有:①早期大肠黏膜病变及溃疡形成过程:多数DSS模型早期病变始于固有膜增殖区隐窝萎缩消失;而人UC早期病变始于表面上皮及浅层隐窝急性炎,典型病变为增殖区的隐窝炎和隐窝脓肿[9],隐窝脓肿一方面把脓液排入肠腔,另一方面向固有膜和黏膜下层破溃,炎症遂向纵深扩散,使该处组织坏死形成溃疡[1]。②脉管病变、部位及程度:DSS模型固有膜及黏膜下层较多小血管内可见血栓形成,局部淋巴管内淋巴细胞淤积;而人UC固有膜及固有肌层内均偶见血栓,局部血管内膜明显增厚,淋巴管内未见淋巴细胞淤积。③隐窝腔内容物:人UC隐窝腔内均以中性粒细胞为主,而DSS模型少部分隐窝腔内以单核巨噬细胞为主,类似人克罗恩病(Crohn’s disease,CD)的改变。④病期及间质浆细胞数量:DSS模型均属急性期,浆细胞缺乏或极少,而人UC病例均存在大肠黏膜慢性炎的基础病变,浆细胞较多;Finkelstein等[9]认为间质浆细胞少是早期CD的特征之一。⑤腺体不典型增生发生率:DSS模型明显较低,而人UC发生率为100%,手术切除病例尚伴炎性息肉及腺瘤形成。
3.3 病因
DSS模型的病因是单一因素,相当于人体肠道内含有毒有害物质的内容物;而人UC的诱因尚有精神刺激、饮食、过度劳累及感染等。
3.4 发病机制
3.4.1 相似机制
①细胞毒作用:DSS和人体肠道内含有毒有害物质的内容物,均可直接损伤大肠上皮细胞,不需要T或B细胞的存在[4,10];人UC中存在着肠上皮紧密联接的破坏[11],DSS诱导结肠炎小鼠结肠紧密连接蛋白和紧密连接相关蛋白-1表达下降[12]。②血管损伤、外周血高凝状态及微循环缺血缺氧等[13-14]:张宸豪等[15]体外研究发现DSS可抑制血管内皮细胞增殖并诱导细胞凋亡;血管内皮细胞损伤,内膜粗糙,血小板粘附,继而纤维素血栓形成,血液循环不畅,血供不足,隐窝上皮因缺血缺氧而变平萎缩,甚至消失,使肠黏膜通透性增大,病原体进入肠黏膜固有层后诱导中性粒细胞和巨噬细胞的激活,通过氧依赖性和氧非依赖性机制发挥杀菌和细胞毒作用,导致靶细胞破坏,并产生抗体、补体和免疫复合物等,沉积于肠道微循环,造成血管损伤。③细菌感染及/或肠道微生态显著失衡[16-18]。④隐窝阻塞:可直接损害隐窝细胞[19]。⑤免疫机制;⑥致癌作用:DSS和人体肠道内容物均可直接或间接刺激肠黏膜引起炎症[20],日久可发生癌变[21]。
3.4.2 不同机制
①DSS首先损伤血管,致使增殖区隐窝干细胞萎缩消失,不能产生新细胞并向黏膜表面移行、分化和成熟,导致全层隐窝消失,继而上皮破坏脱落,黏膜溃疡形成;另外,巨噬细胞数量增多并吸收DSS后释放溶酶体酶,也可直接损害隐窝细胞[19];而人UC病变始于大肠黏膜细菌感染,因患者机体免疫功能低下或异常、肠道屏障防御机制薄弱不能及时将之清除,或使肠道正常菌群结构和功能破坏,导致血管损伤,继发隐窝干细胞受损。②人UC血管损伤程度较DSS模型轻,故人UC典型病变较DSS模型出现慢,但DSS复制大鼠UC急性期模型在停用DSS数天后病变可逐渐恢复,而人UC则病程较长久,很难自愈。
综上所述,二者大肠黏膜组织病理学变化及发病机制均有异同,DSS首先损伤血管致使隐窝干细胞受损萎缩,炎症是继发病变,而人UC则相反,隐窝干细胞损伤是二者的共同点,也是UC的本质,“治病必求其本”,故治疗的重点应该是修复受损隐窝干细胞功能,阻止或保护干细胞不再受损,促进其存活和分化。按照中医辨证论治原则,药证相符的中药才有效,对人UC某种证型有效的方剂对DSS模型疗效不明显应是中医证型不相符及/或发病机制不同所致。关于DSS模型的中医证型探讨以后再做详细报道,采用该模型研究临床有效药物疗效及其机制需辨证分析其结果。

