比格犬内皮祖细胞对组织工程骨的血管化和成骨效果
吴骁伟,尹 琎,韦颍昕
华中科技大学同济医学院附属同济医院 1胸外科 2血液科,武汉 4300303中国医学科学院 北京协和医学院 北京协和医院基本外科,北京 100730
内皮祖细胞(endothelial progenitor cells,EPCs)在心脑血管疾病、外周血管疾病以及创伤愈合的治疗方面均发挥重要作用,为缺血性疾病的研究和治疗提供了新的思路和途径。随着组织工程骨血管化的必要性被逐渐认识,EPCs复合成骨细胞构建已经成为体外预血管化常用的方法之一,并取得了较好的效果[1- 2]。目前常用的联合EPCs构建组织工程骨的模型主要集中在鼠兔等小动物体内,大动物体内的复合构建研究相对较少[3- 4]。本研究采用EPCs和骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)作为种子细胞在比格犬体内建立了组织工程骨的模型,观察了EPCs对组织工程骨血管化和成骨效果的影响,以期为将来在大动物体内构建血管化组织工程骨提供新的思路和理论依据。
材料和方法
材料雄性比格犬12只,12月龄,体质量13~15 kg,清洁级别CV级,购自北京玛斯实验动物技术有限公司。β磷酸三钙(β-tricalcium phosphate,β-TCP)(奥林巴斯,日本),低糖DMEM培养基(Hyclone,美国),FBS(Hyclone,美国),Hank’s缓冲液(Hyclone,美国),Ficoll淋巴细胞分离液(G&E,瑞士),0.25% 胰蛋白酶-0.02%(Gibco,美国),DPBS(Hyclone,美国),青/链霉素(Gibco,美国),β-磷酸甘油钠(Sigma,美国),维生素C(Sigma,美国),地塞米松(Sigma,美国),4% 多聚甲醛固定液(优博奥生物科技有限公司),10%中性福尔马林(益利精细化学品有限公司)。HistoStarTM组织包埋机(Thermo,美国),Thermo Excelsior ES全自动组织脱水机(Thermo,美国),病理切片机HM325(Thermo,美国),Binder ED400烘箱(Binder,德国),GE Lightspeed VCT64(GE,美国),Tescan XM 5136扫描电镜(泰思肯,美国)。
BMSCs和EPCs的分离、培养及鉴定采用密度梯度离心法分离、培养比格犬骨髓来源的BMSCs,体积比为10% FBS的低糖DMEM培养基培养扩增至P2代,更换成骨诱导培养基(10-8mol/L地塞米松、0.01 mol/L β-磷酸甘油钠、0.05 g/L 维生素C、10% 胎牛血清、1% 双抗),每3 d换液1次,持续诱导14 d,倒置相差显微镜下连续观察细胞形态变化。4% 多聚甲醛固定,碱性磷酸酶(alkaline phosphatase,ALP)染色试剂盒染色;体积分数为95%的乙醇固定1 h,2%茜素红染色;4% 多聚甲醛固定,骨桥蛋白、骨钙蛋白细胞免疫组织化学检测检测。
采用贴壁换液法分离、培养比格犬骨髓来源的EPCs,接种到事先包被纤维连接蛋白(5 mg/ml)培养皿中,1 h后吸取培养皿内的培养基(内含有细胞)至新的包被有纤维连接蛋白的10 cm培养皿内,细胞培养箱内孵育培养。48 h后收集悬浮的细胞离心后去上清,10 ml EGM- 2培养基重悬细胞后接种于包被有纤维连接蛋白的培养皿中培养。4 d后吸走培养基,PBS洗涤2次,换液。7 d后倒置相差显微镜多个细胞克隆形成,倒置相差显微镜下连续观察体外培养过程中EPCs的贴壁生长、增殖以及细胞形态。进行EPCs功能特征的检测(摄取DiI-ac-LDL和结合FITC-UEA- 1荧光双染实验)[5]。
细胞支架复合物制备β-TCP支架制备成薄圆柱形规格(直径12 mm×高度10 mm)。料奥斯泛朗-OSferionu(β-TCP)- 1230,成品为直径为12 mm,高为30 mm的标准圆柱形,采用小型台锯子[惠利得(HUILIDE)T4型)]加工成底面直径为12 mm,高为10 mm大小的圆柱。超声清洗(重复5次,每次10 min)后放入电热恒温干燥箱,80 ℃ 烘烤24 h,高温高压灭菌后备用。
电镜扫描支架材料及细胞支架复合物单纯TCP支架材料真空干燥、喷金镀膜后置于Tescan XM 5136扫描电镜下扫描观察;BMSCs/TCP细胞支架复合物在接种BMSCs 4 d后二醛固定,乙醇系列脱水,喷金镀膜后置电镜下扫描观察BMSCs贴壁生长及细胞外基质分泌情况;EPCs/TCP细胞支架复合物在接种EPCs 4 d后,采用同样步骤观察EPCs贴壁生长及细胞外基质分泌情况;EPCs/BMSCs/TCP细胞支架复合物在接种BMSCs和EPCs 14 d后采用同样步骤观察。
动物模型制备及分组雄性比格犬,麻醉、铺巾、切开、分离下肢肌肉。放置各组细胞支架复合物以及空白TCP支架于肌肉袋内,周围的筋膜包裹缝合,逐层关闭。术后肌肉注射青霉素(80 万U/次,每天2次,连续3 d)以预防感染。实验用比格犬12 只,分为:(1)BMSCs/TCP组(n=10,5 只比格犬,双侧下肢肌肉内植入):将体外扩增的P2代比格犬BMSCs接种于β-TCP[接种密度2.0×107cell/ml,(300±30)μl/支架,6×106个细胞/支架],成骨诱导培养基(0.01 mol/L β-磷酸甘油钠、10-8mol/L地塞米松、0.05 g/L VitC、10% FBS、1% 双抗)体外培养2周后植入比格犬下肢肌肉内;(2)EPCs/BMSCs/TCP组(n=10,5 只比格犬,双侧下肢肌肉内植入):相同方法接种BMSCs于β-TCP支架,完成后再接种EPCs[接种密度 2.0×107cell/ml,(300±30)μl/支架,6×106cells/支架],成骨诱导培养基和内皮细胞培养基(EGM- 2培养基)混合体外培养(体积比为1∶1),2周后植入比格犬下肢肌肉内;(3)空白β-TCP组(n=4,2 只比格犬,双侧下肢肌肉内植入):空白的β-TCP支架植入比格犬下肢肌肉内作空白对照组。
CT扫描及图像分析分别在术后3、6个月对各组构建的组织工程骨进行CT扫描,管电压:120 kV,管电流135 mA,螺距15(0.984),旋转时间0.33 s,探测器准直5 mm,扫描层厚:1.25 mm,层间距:5 mm,扫描范围从比格犬胫骨踝关节至膝关节(以确保组织工程骨在扫描范围内)。采用GE软件AW4.4扫描数据进行三维重建,观察新骨形成和支架降解情况,测量组织工程骨的CT值并计算出相对CT值,具体为:在骨窗三维图像中随机截取10个横断面,每个断面随机划分4个区域并读出相应的CT值,各组测得的CT值减去单纯β-TCP组的CT值得到相对CT值[6]。其原理如下:CT值和骨的密度(在组织工程骨中代表新生骨的密度)呈正比,CT值越大其成骨量越大,呈现线性关系。各组的CT值由新生骨的CT值和剩余支架的CT两部分组成,将各组CT值(BMSCs/EPCs/TCP 组和BMSCs/TCP组)减去同期的单纯支架(TCP)的CT 值,即为相对CT值,代表了各组新生骨的成骨量。
HE染色术后6个月取材,脱钙、脱水。标本自上而下轴向切为上、中、下3段,脱水后包埋,连续切片,厚度为5 μm,HE染色,观察中段所形成的新生血管以及成骨情况。低倍镜连续拍摄各组HE切片,采用软件合成连续切片为1张完整切片,Image-Pro Plus 6.0.软件对HE染色组织切片中的成骨面积(组织红染区域)进行统计分析,高倍镜下观察各组HE切片边缘和中心区域的血管化和成骨效果[7]。
免疫组织化学染色行α平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)免疫组织化学染色分析各组血管生成的分布情况以及统计切片横截面的血管数量,具体为:选取支架中心和支架边缘4个高倍镜视野(200×)共8个视野拍照,对阳性血管结构进行数量统计,同法分别对外周区域和中心区域的成骨面积进行数量统计分析。
统计学处理采用SPSS 17.0统计软件,实验数据以均数±标准差表示,组间比较采用配对t检验,P<0.05为差异有统计学意义。
结 果
BMSCs分离、培养和成骨诱导情况P0代BMSCs分离培养5 d后,镜下可见数个集落样细胞克隆,形态似成纤维细胞,呈现纺锤形,高倍镜下见部分细胞具有明显核分裂相。培养至8 d后,细胞集落数逐渐增多,BMSCs传代后生长迅速,具有多个触须突起。体外成骨诱导14 d后,茜素红染色阳性、有橘红色钙结节形成,骨钙蛋白(osteocalcin,OCN)和ALP染色阳性(图1)。
骨髓来源EPCs的分离和培养情况EPCs培养至14 d时细胞逐渐融合,呈典型血管样结构,荧光显微镜下可见到摄取了Dil标记的低密度脂蛋白的EPCs呈红色,结合了FITC标记的 UEA- 1 的EPCs呈现绿色(图2)。
细胞-材料复合物的制备及电镜扫描检测电镜扫描β-TCP支架,内部结构类似松质骨骨小梁,孔径约为100~400 μm,孔与孔之间相互连通。BMSCs接种β-TCP并成骨诱导培养至4 d,BMSCs迅速增殖、伴有细胞外基质(extracellular matrixc,ECM)分泌,ECM逐渐填充于孔隙中,并形成连接,此时ECM填充不够均匀,分泌量少。EPCs接种β-TCP支架后使用EGM- 2培养基体外培养至4 d,孔隙内可见少量EPCs黏附,ECM分泌不明显;EPCs/BMSCs/TCP培养至第14 天,电镜观察可见EPCs、BMSCs生长旺盛,ECM分泌旺盛,细胞与ECM形成饱满的索状连接(图3)。
CT扫描结果术后3个月,EPCs/BMSCs/TCP组的相对CT值为(366.67±19.51)HU,明显高于BMSCs/TCP组的(163.0±30.81)HU(t=2.10,P=0.0006);术后6个月,EPCs/BMSCs/TCP组的相对CT值为(553.34±26.86)HU,也明显高于BMSCs/TCP组的(241.34±21.57)HU(t=2.11,P=0.001);BMSCs/TCP组(t=2.10,P=0.0255)和 EPCs/BMSCs/TCP组(t=2.10,P=0.0006)术后6个月的相对CT值均明显高于该组术后3个月的相对CT值。
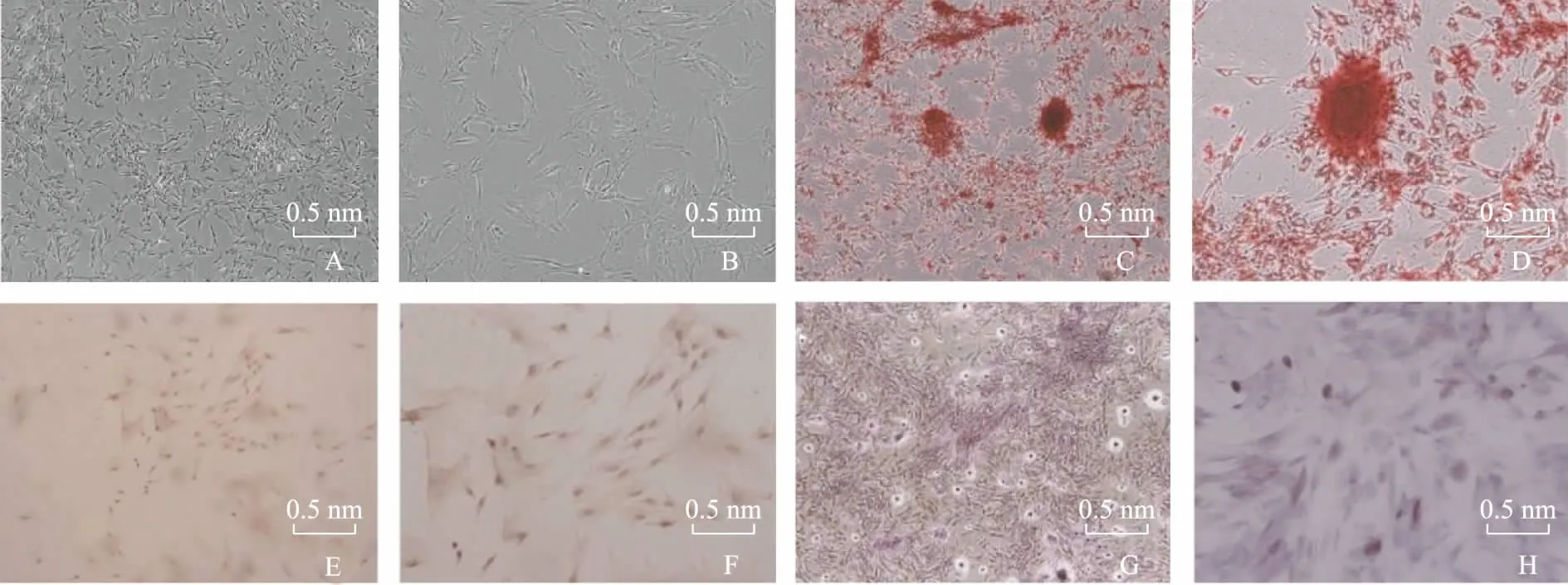
BMSCs:骨髓间充质干细胞;OCN:骨钙蛋白;ALP:碱性磷酸酶
BMSCs:bone marrow mesenchymall cells;OCN:osteocalcin;ALP:alkaline phosphatase
A、B.倒置相差显微镜;C、D. 茜素红染色;E、F.OCN染色;G、H.ALP染色
A,B. inverted phase-contrast microscopy;C,D. alizarin red staining;E,F. OCN staining;G,H.ALP staining
图1BMSCs分离培养及成骨诱导鉴定
Fig1Isolation and culture of BMSCs and identification of osteogenic induction

EPCs:内皮祖细胞
EPCs:endothelial progenitor cells
A1.倒置相差显微镜下明场观察可见EPCs在铺被matrigel的表面形成血管样结构;A2.摄取DiI-ac-LDL的EPCs形成血管样结构;B1.摄取DiI-ac-LDL的EPCs呈现红色荧光;B2.高倍镜下摄取DiI-ac-LDL的EPCs呈现红色荧光;C1.结合FITC-UEA- 1的EPCs呈现绿色荧光;C2.高倍镜下结合FITC-UEA- 1的EPCs呈现绿色荧光
A1.the vascular structure of EPCs on the surface of matrigel under inverted phase-contrast microscope;A2.the vascular structures were of EPCs that absorbed DiI-ac-LDL;B1.EPCs showed red fluorescence after absorbing DiI-ac-LDL;B2.EPCs showed red fluorescence at high magnification after absorbing DiI-ac-LDL;C1.EPCs showed green fluorescence after absorbing FITC-UEA- 1;C2. EPCs showed green fluorescence at high magnification after absorbing FITC-UEA- 1
图2EPCs分离培养及鉴定
Fig2Isolation,culture,and identification of EPCs

TCP:磷酸三钙
TCP:β-tricalcium phosphate
A、B.空白支架;C、D.接种BMSCs 4 d后;E、F.接种EPCs 4 d后;G、H.联合EPCs和BMSCs接种14 d后
A,B.the blank TCP scaffold;C,D.4 days after BMSCs inoculation;E,F.4 days after EPCs inoculation;G,H.14 days after EPCs combined inoculation with BMSCs
图3扫描电镜观察不同细胞在TCP支架材料上的黏附生长情况
Fig3The adhesion and growth of different cells on TCP scaffold(scanning electron microscopy)
血管化和成骨效果
组织学表现:EPCs/BMSCs/TCP组在支架内部均匀分布有血管样结构,管腔内含大量红细胞;免疫组织化学染色显示管腔及其内部红细胞为棕色;在支架边缘和中心部位均可见到一定量新生骨形成,新生骨排列有序,分布均匀,形成的骨基质比较薄,不能连接为粗大条索样骨小梁结构,边缘和中心支架降解均不明显。BMSCs/TCP组在支架边缘可见血管样结构,内有红细胞充盈,中心区域血管较少,分布不均匀;免疫组化染色显示血管腔结构及红细胞为棕色;在支架边缘可见一定量新生骨形成,形成条索状连接,边缘区域支架降解明显;中心区域几乎无新生骨形成,仅有纤维组织生长,支架降解不明显。空白TCP组在支架边缘可见散在分布的血管样结构;免疫组织化学染色显示血管腔及红细胞为棕色,中心区域血管分布较少;在支架边缘和中心均无明显的新生骨形成,材料空隙内仅有纤维组织生长,支架降解不明显(图4、5)。
血管生成数量:EPCs/BMSCs/TCP组的外周、中心和整个支架的血管数量分别为(21.67±1.45)、(23.33±2.60)和(45.00±1.16)支,均明显高于BMSCs/TCP组的(8.67±0.88)(t=2.07,P=0.0016)、(9.33±0.67)(t=2.07,P=0.0065)和(18.00±1.00)支(t=2.07,P=0.001);BMSCs/TCP组与空白TCP组整个支架的血管数量差异无统计学意义[(18.00±1.00)支比(16.67±2.40)支;t=2.07,P=0.636)]。
成骨面积:单纯TCP组无成骨形成。EPCs/BMSCs/TCP组的成骨面积为(1 322 000±141 300)像素,明显高于BMSCs/TCP组的(874 900±49 430)像素(t=2.10,P=0.04)。BMSCs/TCP组边缘区域的成骨面积明显高于中心区域[(170 000±42 320)像素比(613 900±90 290)像素;t=2.10,P=0.02)];EPCs/BMSCs/TCP组边缘区域和中心区域的成骨面积差异无统计学意义[(37 6400±20 160)像素比(310 400±6917)像素;t=2.10,P=0.07)]。

图4术后6个月成骨效果,箭头为血管样组织及其内部红细胞团(HE)
Fig4Bone formation 6 months after surgery(the arrow indicates the vascular tissue and the red blood cells inside it)(HE)

A.正常组织内血管;B.空白支架组;C.BMSCs/TCP组;D.EPCs/BMSCs/TCP组
A.blood vessels in normal tissue;B.blank TCP group;C.BMSCs/TCP group;D.EPCs/BMSCs/TCP group
图5α-SMA免疫组织化学染色结果
Fig5Results of immunohistochemical staining
讨 论
肿瘤、外伤、感染以及先天畸形等原因引起较大尺寸骨缺损的治疗一直是临床治疗的难题[7]。骨组织工程的兴起和发展为治疗大尺寸骨缺损提供了新思路,但是种子细胞在大尺寸支架材料内的有效成活一直是困扰研究者的难题之一。目前常用的促进组织工程骨的血管化方法主要有:血管束植入[8]、筋膜包裹、使用促血管化生长因子[9- 10]、联合血管内皮细胞等,但上述各种方法均存在一些不足,如手术操作难度大、筋膜瓣制备复杂、创伤较大、生长因子释放控制较难、血管内皮细胞不易获取等。EPCs是内皮细胞的前体细胞,来源于骨髓,在某些生理或病理因素刺激下,可从骨髓动员到外周血参与损伤血管的修复[11]。研究发现,EPCs不仅参与胚胎期的血管生成,也存在于脐带血、外周血及骨髓血中,参与出生以后的血管发生。目前对于EPCs的研究主要集中在治疗缺血性疾病等领域,有关其应用于组织工程骨种子细胞的研究较少。本研究采用比格犬来源的EPCs和BMSCs共同作为种子细胞在比格犬下肢肌肉内构建组织工程骨(tissue-engineered bone,TEB),通过比较各组TEB的血管数量和成骨量,评估了EPCs在比格犬体内对BMSCs血管化成骨效果的影响。结果发现,EPCs/BMSCs/TCP组生成的血管数量和成骨量明显多于BMSCs/TCP组,说明在比格犬体内EPCs确实促进了BMSCs的血管化和成骨效果。
通过对EPCs/BMSCs/TCP组和BMSCs/TCP组血管生成的数量分析发现,EPCs/BMSCs/TCP组在组织工程骨内部有效地增加了血管数量,推测其可能原因如下:EPCs可能通过整合[12]、融合[13]、旁分泌[14]等机制参与了新生血管生成和内皮细胞更新。以往研究表明,将体外标记的EPCs移植到缺血动物模型后,可在缺血组织新生血管壁内或再生的血管内皮层检测到带有标记的细胞[15]。除了EPCs的整合、融合功能以外,体外培养的EPCs还具有分泌血管内皮因子(vascular endothelial factor,VEGF)、肝细胞生长因子、胰岛素样生长因子的能力[16],可促进成熟血管内皮细胞增殖、迁移,增强了血管生成的能力[17]。此外有研究通过在动物体内联合EPCs构建血管化的组织工程骨,证明了EPCs在动物体内增强组织工程骨血管化的作用[3,18- 19]。
本研究通过比较EPCs/BMSCs/TCP组的边缘和中心区域成骨面积发现,其边缘和中心区域的成骨面积无明显差异,HE染色提示该组骨基质分布非常均匀,分析其可能原因如下:EPCs/BMSCs/TCP组无论是在边缘区域还是中心区域都有着比较均匀的血管分布,均匀分布的血供为成骨细胞的成骨提供了一个有利的微环境,使BMSCs均匀成骨[20]。然而,EPCs/BMSCs/TCP组虽然具有非常均匀的成骨区域分布,但是通过HE染色观察发现,其所形成的新生骨骨基质比较薄,贴附于TCP空隙的表面,如果其在体内时间延长,可能会有更好的成骨效果,联合EPCs构建大尺寸的组织工程骨有待于进一步的长期观察。

