硼掺杂金刚石薄膜电极在酸碱盐中的电化学性质研究
许青波,王传新,代 凯,钟 艳,王旭杰,王 涛,王升高
(武汉工程大学材料科学与工程学院 湖北省等离子体化学与新材料重点实验室,武汉 430073)
0 引言
近年来,硼掺杂金刚石(BDD)电极由于其具有宽电化学窗口、低背景电流、高氧演化潜力、低表面吸附性、显著的化学稳定性和较强的矿化能力等优势而受到越来越多的关注[1-4]。因此,BDD电极已经应用于许多领域,如电分析和传感器技术[5-6]、电合成[7]、废水处理[2]。先前的研究已经证明,在电解水的过程中,BDD电极表面可以产生大量的羟基自由基(OH)[8-9],这是已知的第二强的氧化剂并且伴随着一个非常高的氧化还原电位。生成的OH极活泼,无选择性,能与大多数有机物发生强烈反应,产生脱氢、羟基化和羧化衍生物,最终被矿化成CO2、H2O和无机离子[10]。此外,利用BDD电极对有机物(R)的主要降解机理进行了研究。其反应过程可以表达为式(1)、式(2)。
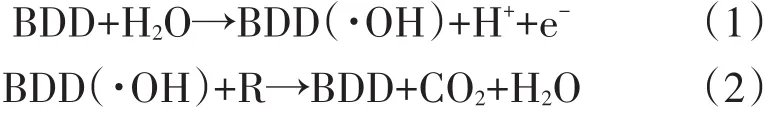
广阔的潜在电化学窗口使得BDD薄膜电极可以用于检测具有高正或负氧化还原电势的化合物,并且可以提供极好的微观结构稳定性[11]。BDD薄膜电极还显示了多氧化还原系统的可逆电子传递动力学的准可逆过程,从而为长期的稳定性提供了有利条件。迄今为止,BDD电极应用有效地降解多种有机废物,如耐火材料有机废水(苯酚、邻苯二甲酸二甲酯、苯醌等)[12-15],高色度的染料废水(刚果红、黑五染料和橙G)[16-19],有潜在毒性的制药废水和生活污水[20-23]等,并且取得了良好的效果。
为了更好地制备硼掺杂金刚石器件,对不同丙酮流量下的BDD薄膜的生长特性以及在不同浓度的酸碱盐溶液中的电化学特性进行了研究。采用扫描电子显微镜对BDD薄膜表面形貌进行了表征,结合XRD对金刚石薄膜的结构进行了分析,以及利用电化学工作站研究了BDD电极的电化学特性。
1 实验条件及参数
在自制的热丝化学气相沉积(HFCVD)装置中进行了硼掺杂金刚石薄膜实验。工作气体为高纯H2,纯度为99.999%;以丙酮为碳源、硼酸三甲酯((CH3O)3B)为硼源,通过氢气鼓泡的形式分别将源气体载入反应室中。为保证碳源和硼源的比例调控方便,分别将其置于冰水混合(0℃)条件下,控制源气体的饱和蒸气压恒定。采用P型单晶硅片为实验衬底,在实验前需要去除样品表面的有机杂质将样品放在丙酮溶液中超声处理3 min,随后将硅片放在金刚石微粉悬浊液中进行超声处理10 min,使衬底表面形成微划痕以有利于形核,最后在丙酮溶液中清洗干净。采用两根直径为0.5 mm的钽丝作为热灯丝,将热丝温度维持在约2 300℃;形核气压为1.5 kPa;形核阶段设定氢气流量为160 mL/min,设定(丙酮+氢气)流量为70 mL/min;形核时长为10 min。生长阶段试验参数如表1所列,表中衬底温度通过红外光学高温计测量。

表1HFCVD硼掺杂金刚石生长实验参数Table1 Experimental parameters of growth of HFCVD boron-doped diamond
电解实验中,采用制备的BDD薄膜电极为工作电极,铂片为辅助电极,Ag/AgCl作为参比电极,三电极间距为1.0 cm,温度为25℃,电解液为5×10-6~5×10-2mol/L的H2SO4、1×10-3~1×10-1mol/L的NaOH溶液和3×10-3~1×10-1mol/L的NaCl溶液。
2 实验结果与分析
2.1 丙酮体积分数对金刚石薄膜表面状态的影响
图1为不同丙酮流量下BDD薄膜的表面和断面SEM图,(a)、(b)、(c)的碳源流量分别为40 mL/min、60 mL/min、80 mL/min。随着碳源浓度的增加,金刚石薄膜的形貌出现了明显的变化,在丙酮流量为40 mL/min时,金刚石表面呈现出大量的(111)和(110)晶面生长,晶粒粒径较小约6.25 μm,二次形核量较少,并且生长速率缓慢约为2.78 μm/h;在丙酮流量为60 mL/min时,金刚石以(111)晶向生长为主,呈现出金字塔状的八面体生长模式,金刚石颗粒大小均匀、结构致密晶型完整,成膜质量好,晶粒棱角清晰晶界明显,晶粒粒径约7.08 μm,二次形核量较多,生长速率约为4.86 μm/h;在丙酮流量升高到80 mL/min时,金刚石二次形核量出现明显的升高,晶粒粒径迅速减小到约4.16 μm,生长速率上升约为6.32 μm/h,从断面可以看出金刚石生长缺陷增加,结构疏松多孔、非金刚石相含量升高。
图2为不同丙酮流量下金刚石膜的XRD谱线图,在图中43.9°和75.3°附近存在尖锐的金刚石衍射峰分别对应为(111)晶面和(220)晶面。可以清晰地观察到,随着丙酮流量的增加,金刚石(111)晶面的峰值先增强后减小,(110)晶面先增多后减少。并且硼掺杂金刚石薄膜在低丙酮流量(40 mL/min)下金刚石(110)晶面的峰值强度大于(111)晶面的峰值强度,说明在低丙酮流量下金刚石(110)晶面的生长占主导作用。这与SEM图中观察到的结果相吻合。
实验结果表明,丙酮流量对BDD薄膜的生长有重大的影响,当丙酮流量过低时H原子的浓度含量相对较高,不仅对sp2的石墨相具有良好的刻蚀作用,对sp3状态的金刚石也出现了严重的刻蚀效果,导致在较高的丙酮流量下,金刚石薄膜的生长速率过慢,形核作用减弱,并且金刚石薄膜生长在过量硼源的影响下晶体结构变的不完整,薄膜质量变差电阻较高。随着丙酮流量的提高,生成的含碳活性基团数量增多,形核密度提高,金刚石薄膜的生长速率增大,金刚石的晶型较完整,薄膜质量较高电阻降低。当丙酮流量过高时,H原子浓度相对较低,对金刚石生长过程中的非金刚石相的刻蚀作用减弱,导致金刚石薄膜生长杂质含量提高,缺陷增多生长速率明显增大,由于含碳活性基团数量的大幅度提高,金刚石生长的二次形核现象明显,晶粒粒径较小,并且硼源比例减小薄膜电阻升高。所以采用在丙酮流量为60 mL/min时制备的硼掺杂金刚石薄膜作为电化学实验的测试电极。

图1 不同丙酮流量下BDD薄膜的表面和断面SEM图Fig.1 surface and section SEM of BDD film under different acetone flow

图2 不同丙酮流量下金刚石膜的XRD谱线图Fig.2 XRD pattern of diamond film under different acetone flow rates
2.2 不同浓度的电解质对电化学窗口的影响
电化学窗口是衡量电极材料的电催化能力的重要指标,电化学窗口越宽广,尤其是阳极的析氧过电位越高,越有利于高电位下氧化反应的发生及强氧化性中间体的合成,BDD电极具有很宽的电势窗口和很低的背景电流,但在不同的电解质中具有不同的电化学窗口。采用丙酮流量为60 mL/min下沉积的硼掺杂金刚石为电极,电解H2SO4、NaOH和NaCl溶液,对不同浓度的酸碱盐电解质的电化学窗口(U)、氧化还原电位以及电极电流强度的影响进行了研究。
图3为丙酮流量为60 mL/min下沉积的硼掺杂金刚石电极,电解不同浓度的H2SO4溶液的电化学循环伏安曲线,扫描速率均为100 mV/s。在电解浓度为5×10-2mol/L的H2SO4溶液(pH=1)时,电极的析氢过电位为-1.188 V,析氧过电位为1.896 V,所以对应电化学窗口为3.084 V,背景电流为50 μA;在电解浓度为5×10-4mol/L的H2SO4溶液(pH=3)时,电极的析氢过电位为-1.221 V,析氧过电位为1.791 V,所以对应电化学窗口为3.012 V,背景电流为50 μA;在电解浓度为5×10-6mol/L的H2SO4溶液(pH=5)时,电极的析氢过电位为-1.253 V,析氧过电位为1.772 V,所以对应电化学窗口为3.025 V,背景电流为50 μA;随着H2SO4浓度的变化,电化学窗口的变化并不显著,但电解质溶液的析氢析氧过电位随H2SO4浓度的减小而减小,说明H+的浓度越高析氢反应越容易,析氧反应越困难。

图3 不同浓度H2SO4溶液中的BDD薄膜电极的循环伏安特性曲线(扫描率:100 mV/s)Fig.3 Cyclic voltammograms of the BDD film electrodes in different concentrations of H2SO4solution(scan rate:100 mV/s)
图4为丙酮流量为60 mL/min下沉积的BDD电极,电解不同浓度的NaOH溶液的电化学循环伏安曲线,扫描速率均为100 mV/s。在电解浓度为1×10-3mol/L的NaOH溶液(pH=11)时,电极的析氢过电位为-1.524 V,析氧过电位为1.141 V,所以对应电化学窗口为2.665 V,背景电流为50 μA;在电解浓度为1×10-2mol/L的NaOH溶液(pH=12)时,电极的析氢过电位为-1.683 V,析氧过电位为1.067 V,所以对应电化学窗口为2.750 V,背景电流为50 μA;在电解浓度为1×10-1mol/L的NaOH溶液(pH=13)时,电极的析氢过电位为-1.711 V,析氧过电位为0.834 V,所以对应电化学窗口为2.545 V,背景电流为50 μA;随着NaOH浓度的变化,电化学窗口的变化并不显著,但电解质溶液的析氢析氧过电位随NaOH浓度的减小而减小,说明OH-的浓度越高析氧反应越容易,析氢反应越困难。
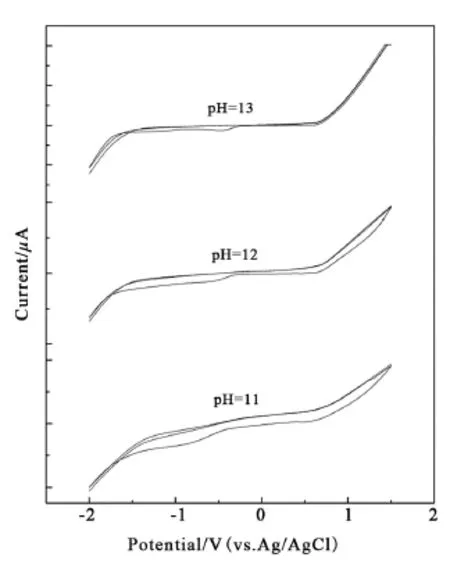
图4 不同浓度NaOH溶液中的BDD薄膜电极的循环伏安特性曲线(扫描率:100 mV/s)Fig.4 Cyclic voltammograms of the BDD film electrodes in different concentrations of NaOH solution(scan rate:100 mV/s)
图5为丙酮流量为60 mL/min下沉积的BDD电极,电解不同浓度的NaCl溶液的电化学循环伏安曲线,扫描速率均为100 mV/s。在电解浓度为3×10-3mol/L的NaCl溶液(pH=7)时,电极的析氢过电位为-1.526 V,析氧过电位为1.505 V,所以对应电化学窗口为3.031 V,背景电流为50 μA;在电解浓度为1×10-2mol/L的NaCl溶液(pH=7)时,电极的析氢过电位为-1.688 V,析氧过电位为1.567 V,所以对应电化学窗口为3.225 V,背景电流为50 μA;在电解浓度为1×10-1mol/L的NaCl溶液(pH=7)时,电极的析氢过电位为-1.737 V,析氧过电位为1.506 V,所以对应电化学窗口为3.243 V,背景电流为50 μA;随着NaCl浓度从3×10-3mol/L增加到1×10-2mol/L,电化学窗口有明显的增大;NaCl浓度从1×10-2mol/L增加到1×10-1mol/L,电化学窗口趋于稳定。并且氧化峰和还原峰的形状基本呈现出对称的形态,氧化峰电流和还原峰电流的比值近似等于1,表明BDD电极表面进行的是一个准可逆电化学反应,电极保持了高度的稳定性。

图5 不同浓度NaCl溶液中的BDD薄膜电极的循环伏安特性曲线(扫描率:100 mV/s)Fig.5 Cyclic voltammograms of the BDD film electrodes in different concentrations of NaCl solution(scan rate:100 mV/s)
在标准液中水的理论分解电压E理论为1.229 V,实验所测得的电化学窗口远大于理论分解电压,这是因为在不同的电极材料上存在不同的H2和O2析出超电势[24-25]。在实验中发现NaOH溶液的电化学窗口相对于H2SO4溶液的电化学窗口,析氢过电位与析氧过电位出现了明显的右移,这与电解水时的标准电极电势[24]变化趋势相吻合,在酸性介质中,阳极电极电势为1.229 V(2H2O-4e-=O2↑+4H+),阴极电势为0 V(4H++4e-=2H2↑);在碱性介质中,阳极电极电势为0.401 V(4OH--4e-=O2↑+2H2O),阴极电势为-0.828 V(4H2O+4e-=2H2↑+4OH-)。与中性的NaCl溶液电化学窗口相比较中性溶液的电化学窗口更宽,在其他报道[26]中有相似的结果,推测在中性介质中与酸性碱性介质中的电极反应机理均不相同所导致。在H2SO4溶液、NaOH溶液和NaCl溶液中研究了BDD电极的电化学窗口,得出BDD电极的电化学窗口大小在不同溶液中宽度是不一样的,但是均表现出较宽的电化学窗口,虽然与电解液的浓度有关,但是电化学窗口差值并不明显,说明BDD电极具有很强的电化学氧化性能。
3 结论
为了更好地制备硼掺杂金刚石器件,研究了丙酮流量对金刚石薄膜微观结构及其在酸碱盐介质中的电化学性质。随着丙酮流量的提高,BDD薄膜的生长速率逐渐提高,在一定流量范围内,BDD薄膜的致密性和晶粒粒径随丙酮流量的提高而提高。当丙酮流量超过一定范围时,BDD薄膜的致密性降低、缺陷增多、非金刚石相含量提高。通过对比,当丙酮流量为60 mL/min时生长的BDD薄膜结构完整、晶粒粒径较大、致密性良好、生长速率较快。与此同时,将制得的BDD薄膜在酸碱盐介质中进行了电化学测试,测量了BDD电极在不同浓度的H2SO4溶液、NaOH溶液和NaCl溶液中的电化学窗口,结果表明不同溶液中的BDD薄膜电极的电化学窗口是不一样的,相同溶液中电化学窗口的宽度随溶液浓度的变化不大。在所有的溶液特别是在中性溶液中具有非常宽广的电化学窗口,具有很强的电化学氧化性能。

