烟草K+通道NtSKOR基因的克隆及表达分析
卓 维,陈 倩,杨尚谕,李佳皓,彭 双,王 静,李立芹
(1.四川农业大学 农学院,四川 成都 611130; 2.作物科学国家级实验教学示范中心,四川 成都 611130)
钾是植物生长所必需的矿质元素之一,在调节植物细胞光合作用、气孔调节、蛋白质合成、氧化代谢和抗逆性等生理过程中起积极作用,严重缺钾时植物不能正常完成生活史[1-3]。钾离子(K+)广泛分布于植物组织和器官中,其总量在新鲜植物组织细胞内高达100~200 mmol/L,在植物干质量时可占总含量的2%~10%[4-5]。K+是作物产量与品质形成的限制因素。
烟草属于茄科(Solanaceae)烟草属(Nicotiana),是我国重要的模式植物和农林经济作物。同时,它也是典型的喜钾植物,其烟叶中积累的K+含量高低是衡量烟叶品质优劣的重要指标之一,具体表现在钾素提高烟叶燃烧性、改善烟叶颜色,促进糖类和芳香类物质的合成与积累等[6]。但是与国外优质烟叶相比,我国烟叶钾含量普遍偏低,钾素资源相对贫乏,除低钾胁迫以外,干旱、盐碱、冷害等非生物胁迫也严重影响烟草的产量和质量[7]。
钾离子通道是植物吸收与转运钾离子的细胞膜蛋白[8]。根据蛋白的结构与功能,可分为Shaker、KCO与CNGC这3个家族。其中,Shaker家族是研究最深入的钾转运家族之一,该蛋白家族成员在介导植物钾营养吸收、转运和维持细胞K+动态平衡过程发挥重要作用[9-10]。植物中完整的Shaker钾离子通道含6个跨膜结构域(S1~S6),其中S4可感受跨膜的电压变化,从而控制通道的开合。S5与S6之间的环状结构高度保守,是离子传导孔区[11]。Shaker家族按照电压依赖性及K+运输方向等差异分为内整流型、外整流型和弱内整流型3种类型。而SKOR(Stelar K+outwaed rectifier)属于Shaker通道家族的外整流型,可介导K+外流至胞外,但目前针对它的研究较少。SKOR基因最早从拟南芥中克隆到,研究发现,它在根中柱组织特异表达,能被脱落酸抑制,同时介导根细胞中K+向木质部外流的转运[12]。目前,尚未发现在烟草中研究SKOR的功能。对于其他外整流型K+通道基因,第一个从植物细胞中筛选出的是KCO1,主要在低亲和吸收系统中发挥作用,该基因广泛分布于植物体内。研究发现,长叶红砂RtKCO1在根、茎、叶中表达,且在25~50 mmol/L KCl处理下表达量显著增加,推测该基因编码低亲和性K+通道[13]。后在拟南芥保卫细胞中发现GORK基因,GORK与SKOR同源性很高,在气孔关闭时,二者可介导保卫细胞K+外流,实现钾的根-冠分配[14]。
为进一步探讨外整流K+通道SKOR基因的功能,本研究从普通烟草K326中克隆到一个NtSKOR基因,利用生物信息学对NtSKOR蛋白进行相关分析,同时运用qRT-PCR研究其组织表达水平,以及6种非生物逆境胁迫对SKOR基因表达丰度的影响,为以后研究SKOR提高烟叶中钾含量以及烟草抗逆性的研究奠定一定基础。
1 材料和方法
1.1 试验材料及试剂
试验植物材料为烟草栽培品种K326(Nicotianatabacumcv.K326),由四川农业大学农学院提供。
大肠杆菌感受态DH5α购自Vazyme Biotech公司;目的基因的克隆及回收使用的TRIzol试剂、高保真Pfu酶、PMD19-T载体和限制性内切酶,以及qRT-PCR使用的SYBR Green Master mix和cDNA合成试剂盒等试剂购自TaKaRa,DNA凝胶纯化回收试剂盒购自天根公司;引物合成与测序由上海生工生物工程有限公司完成。
1.2 试验方法
1.2.1 试验材料处理 挑选均一饱满的烟草种子表面消毒、布种,消毒方法和配置培养基方法参考张雪薇等[15]方法进行,配置NaCl(200 mmol/L)、PEG-6000(5%)、ABA(1 μmol/L)、H2O2(10 mmol/L)和低钾10 μmol/L K+培养基。处理相应时间(0,3,6,12,24 h)后进行整株取样,提取RNA后分析NtSKOR在6种非生物逆境胁迫下的表达模式。提取烟草K326幼苗的根、茎、叶以及盛花期的花RNA,反转录为cDNA后分析NtSKOR在各个组织的表达情况。
1.2.2 烟草NtSKOR基因的克隆 参考GenBank收录的美花烟草(Nicotianasylvestris)NsSKOR序列(XM_009764356.1),采用同源克隆的方法,设计全长引物NtSKOR-F和NtSKOR-R,扩增反应程序为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min 40 s,34个循环。目的片段纯化后与pMD19-T载体16 ℃连接过夜,连接产物转化大肠杆菌DH5α感受态,随后在含有氨苄青霉素(Ampicillin)的LB固体平板上进行筛选,菌落PCR检测筛选阳性克隆,送至上海生工生物工程有限公司进行测序。
1.2.3 烟草NtSKOR蛋白生物信息学分析 利用ExPASyProt Param tool分析NtSKOR蛋白的理化性质;用SOPMA和SWISS-MODEL软件预测蛋白的二、三级结构和磷酸化位点;运用PRED-TMR进行目的基因的跨膜区分析;运用MEGA 5以邻近法构建系统进化树。
1.2.4 烟草NtSKOR基因的表达分析 根据基因序列,采用Primer Premier 5.0设计qRT-PCR引物NtSKOR-qF和NtSKOR-qR,采用烟草的18S rRNA为内参进行表达差异研究(表1)。qRT-PCR反应结束后,用2-ΔΔCt方法计算基因相对表达水平。

表1 引物序列Tab.1 Primer sequences
2 结果与分析
2.1 NtSKOR基因克隆
以烟草K326叶片cDNA为模板进行PCR扩增,电泳结果显示,在2 000~3 000 bp的位置上有清晰的条带(图1)。将该条带回收纯化后与pMD19-T载体进行连接,转化大肠杆菌DH5α,用菌落PCR筛选阳性克隆,结果显示,1-7为阳性克隆(图2)。将鉴定出的阳性克隆随机挑选3个送至测序公司进行测序,测序结果显示,目的片段大小为2 484 bp。
2.2 NtSKOR基因的生物信息学分析
2.2.1 NtSKOR编码蛋白的理化性质 蛋白质理化性质分析显示,NtSKOR基因共编码827个氨基酸,其中亮氨酸Leu(11.0%)含量最高,色氨酸Trp(1.2%)含量最低,带负电荷氨基酸(Asp + Glu)105个,带正电荷氨基酸(Arg + Lys)100个。该蛋白预测的分子量为94.75 ku,理论等电点pI为6.52,其亲水性平均指数为-0.149,该蛋白属于亲水性蛋白。
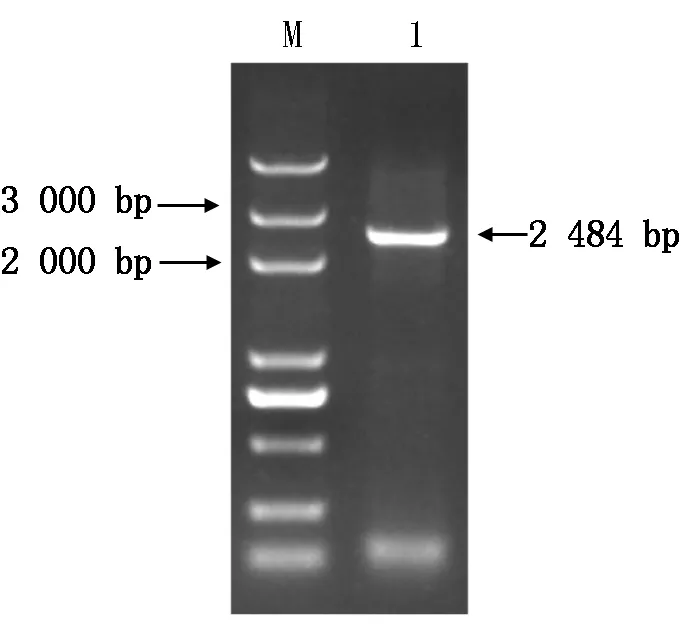
M.Marker 5 000 bp;1.NtSKOR基因。 M.Marker 5 000 bp; 1.NtSKOR gene.

M.Marker 5 000 bp;1-7.NtSKOR基因菌落PCR;8.阳性对照。 M.Marker 5 000 bp; 1-7.NtSKOR colony PCR product; 8.Positive control.
2.2.2 NtSKOR蛋白的二级、三级结构预测 利用SOPMA对NtSKOR编码的蛋白进行二级结构预测发现,该蛋白中43.41%的氨基酸参与α-螺旋(Alpha helix),26.96%的氨基酸参与无规则卷曲(Random coil),19.23%的氨基酸参与延伸链(Extended strand),10.40%的氨基酸参与β-转角(Beta turn),由此可见,该蛋白二级结构的最大元件为α-螺旋。运用 SWISS-MODEL对NtSKOR的三级结构进行了预测,用RasTop软件进行显示,并将结果与二级结构预测进行比对,结果较为统一(图3)。

图3 NtSKOR 蛋白的二级结构、三级结构预测Fig.3 Secondary structure and tertiary structure prediction of NtSKOR protein
2.2.3 NtSKOR编码蛋白的跨膜区及磷酸化分析 运用PRED-TMR对NtSKOR编码蛋白的跨膜区进行预测分析,结果表明,NtSKOR所编码的827个蛋白中含有6个跨膜区(S1~S6)(图4)。S1跨膜区从第86-105位氨基酸结束,S6跨膜区从第687-704位氨基酸结束。
利用NetPhos3.1 Server在线工具对NtSKOR蛋白磷酸化位点进行分析,结果显示,NtSKOR中含有41个丝氨酸(Serine)激酶磷酸化位点,22个苏氨酸(Threonine)激酶磷酸化位点和9个酪氨酸(Tyrosine)激酶磷酸化位点(图5)。说明此蛋白能被激酶所磷酸化,从而参与其他生理过程的调控。

S1~S6为NtSKOR蛋白质跨膜结构的氨基酸序列。 S1-S6 is the amino acid sequence of the transmembrane structure of NtSKOR protein.
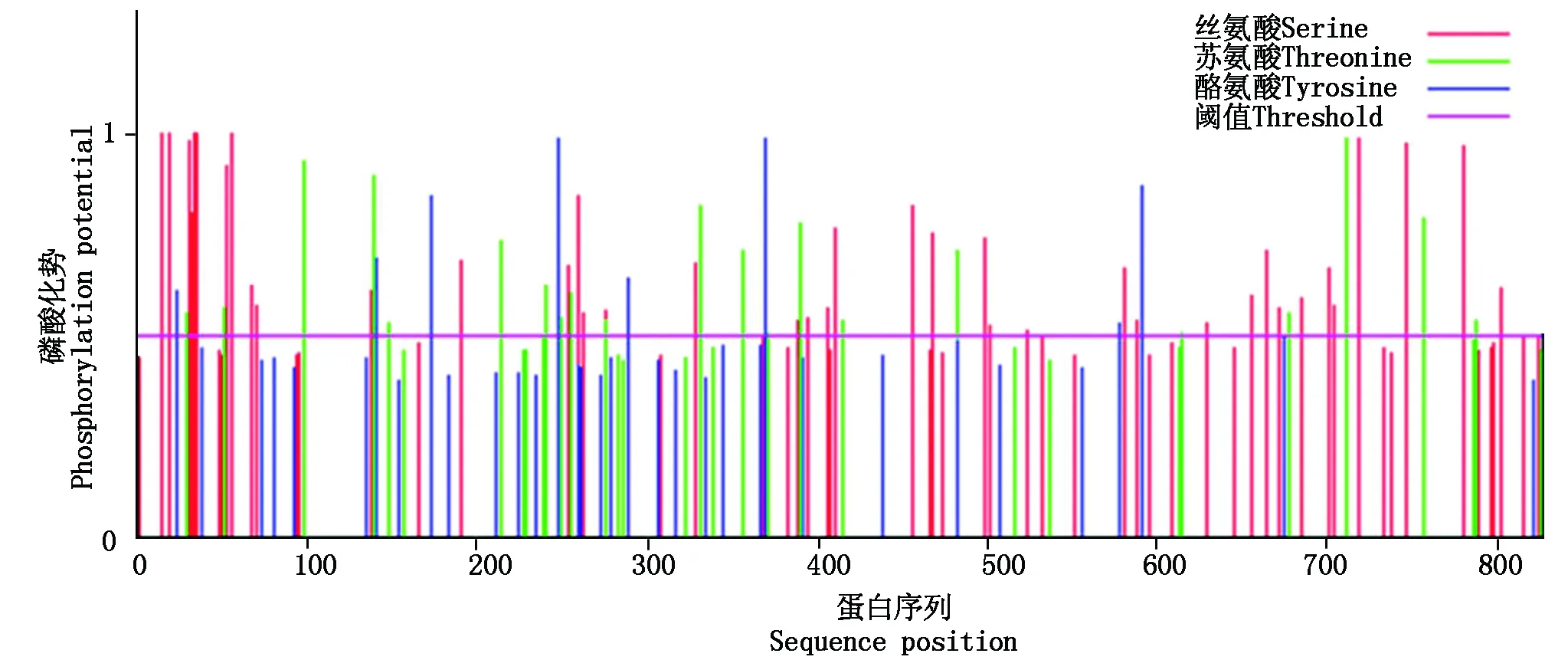
图5 NtSKOR蛋白的磷酸化位点分析Fig.5 Predicted phosphorylation site of NtSKOR protein
2.2.4 NtSKOR同源性分析 把NtSKOR编码的氨基酸序列在NCBI数据库中进行Blast比对,按照相似性程度高低选择19个基因编码的氨基酸序列(包括NtSKOR)构建系统进化树(图6),结果表明,NtSKOR与美花烟草(XP_009762658.1)、绒毛状烟草(XP_009609577.1)、甜椒 (XP_016573164.1)等具有较高的氨基酸序列同源性,分别为99%,96%,89%;与橡胶树 (XP_021654878.1)和锦葵(XP_021298261.1)的同源性最低,分别为73%和74%。
2.3 NtSKOR的组织表达分析
采用qRT-PCR反应分析NtSKOR的组织表达情况,结果表明,NtSKOR在烟草根、茎、叶、花中均有表达,但主要是在根中表达,茎和叶中表达稍低,在花中的表达量最低。其中,根中表达量是在茎中的1.23倍,是叶中的1.83倍,是花中的13.11倍。说明烟草NtSKOR主要在根中表达 (图7)。

图6 NtSKOR进化树分析Fig.6 The phylogenetic tree analysis of NtSKOR

不同处理间不同小写字母表示差异显著。图8同。 Different treatments with Different lowercase mean significant difference. The same as Fig.8.
2.4 六种非生物逆境胁迫下 NtSKOR 的表达分析
采用qRT-PCR分析NtSKOR在6种处理后的表达情况。在低钾(10 μmol/LK+)处理后,该基因表达量在3~24 h下降,最低值为对照(0 h)的6.19%;高盐(200 mmol/L NaCl)、10 mmol/L H2O2和1 μmol/L ABA处理后,NtSKOR表达量在3~24 h逐渐增加,最高值都出现在24 h,分别为对照(0 h)的1.86,3.11和18.69倍;在5% PEG-6000处理后,该基因表达先升高后降低,最高值出现在6 h,为对照(0h)的2.56倍。但冷处理(4 ℃)下,NtSKOR表达量在3~12 h随处理时间增加而下降,最低值出现在12 h,仅为对照的16.20%,但24 h时出现大幅度上升,为对照的76.13%。试验结果说明,NtSKOR能够响应逆境胁迫,受到NaCl、PEG-6000、H2O2和ABA诱导,也受到低钾和4 ℃处理抑制(图8)。
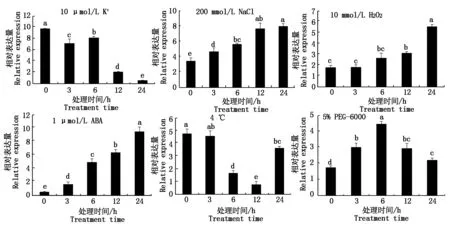
图8 NtSKOR在6种非生物逆境胁迫下的相对表达量分析Fig.8 Analysis of relative expression of NtSKOR under six abiotic stresses
3 讨论
植物吸收K+经木质部流入地上部分的过程主要起作用的是Shaker家族外整流K+通道[16-17]。其功能是当植物受到高浓度钾胁迫时,可通过增加其转录水平,合成通道蛋白排除多余的钾离子;而当植物受到钾饥饿胁迫时,钾通道基因表达量下降,转录受到抑制,防止所必需的钾离子流失[18-20]。SKOR是拟南芥去极化激活的K+通道,最早有研究者提出假说:盐胁迫下,木质部薄壁细胞中积累Na+会引起薄壁细胞质膜去极化,从而激活外整流K+通道蛋白(SKOR)选择性离子(NOR)活性,进而将K+装载到木质部向地上部运输,后在拟南芥中分离得到AtSKOR基因,证明了这一结论[21]。其他研究发现,SKOR对细胞外pH值和H2O2敏感,pH值变化可以改变活化的通道数量,H2O2能迅速增强SKOR的电流振幅和活性[22-23]。
但是长期以来,有关外整流通道蛋白的研究以及钾吸收主要集中在拟南芥上,其他植物研究较少[24]。本试验从普通烟草K326中克隆到一个NtSKOR基因的cDNA序列,该基因全长2 484 bp,编码827个氨基酸残基。NtSKOR蛋白能够被丝氨酸、苏氨酸和酪氨酸激酶磷酸化,与美花烟草、甜椒和番茄SKOR等具有较高同源性,同时含有(S1~S6)6个跨膜结构域。第6个跨膜螺旋S6与钾通道的门控相关,通过定点诱变AtSKOR基因,发现影响门控的突变聚集在S6内,S6跨膜区及其细胞内扩展区域与通道阻断剂的相互作用是调节门控的重要机制[25-26]。
本研究利用qRT-PCR分析NtSKOR在烟草K326不同组织中的表达水平,结果显示,该基因在根、茎、叶、花中均有表达,根中表达量最高,茎和叶中稍低。这与植物霸王ZxSKOR的组织表达情况一样,该基因主要在根和茎中表达,且ZxSKOR表达水平随叶片中K+的浓度增加而显著提高,认为在盐胁迫下根和茎中的ZxSKOR相互协调在K+的长距离运输起作用[27]。推测NtSKOR可能参与烟草根部K+离子的吸收与运输,以维持体内离子平衡。本研究发现,在低钾(10 μmol/L K+)处理后,该基因表达量在3~24 h逐渐下降;高盐(200 mmol/L NaCl)处理后,NtSKOR表达量在3~24 h逐渐增加,说明NtSKOR表达量受到低钾处理抑制和高盐诱导,推测与Shaker家族在响应低钾胁迫的适应机制相关。低钾浓度(1~200 μmol/L)下,NtSKOR基因转录受到抑制以防止K+流失。巴西橡胶树HbKCO1在钾饥饿和高钾胁迫下表达模式与外整流K+通道适应机制相符合,30 mmol/L KCl高钾处理后HbKCO1表达量上升,低钾处理后表达量下降[28]。同时,烟草NtSKOR基因表达受高盐诱导,这与霸王ZxSKOR的表达模式相同,50 mmol/L NaCl处理下,基因表达丰度随处理时间延长逐渐增加[29]。猜测该表达模式与维持植物体内正常K+/Na+平衡相关,但是基因表达与K+吸收之间的联系,不同的植物表达模式不一样[30-31]。在小花碱茅PtSKOR的研究中发现,小花碱茅地上部分K+的含量不受外界盐分浓度及处理时间的影响,这是维持植株地上部高K+/Na+值的重要原因之一[32]。黑果枸杞LrSKOR的耐盐机制表明,黑果枸杞Na+和K+主要分布在地上部分,但根中K+/Na+的值比叶片中高,从而表现出相对较强的耐盐能力[33]。
本试验选择6种不同的处理以研究NtSKOR的表达模式,在不同的胁迫条件,该基因表达情况不同,推测SKOR基因面对相同或不同的逆境存在不同的应答机制,可能是存在翻译后水平调控,也有可能是与不同蛋白相互作用的结果。所以,烟草NtSKOR蛋白在吸收钾素和对抗非生物逆境胁迫中的具体作用,尚待进一步研究。今后可构建GFP融合表达蛋白,确定其亚细胞定位,构建原核表达载体表达蛋白,深入研究NtSKOR基因的功能,为从分子水平阐明NtSKOR蛋白在非生物逆境胁迫特别是低钾胁迫中的作用机制提供科学依据。

