盐胁迫下12个甜荞新品种生理特性及FtNHX1 基因表达差异的比较
张佳松,陆启环,李发良,杨宏楹,徐 婵,宋琎楠,王雅琦,杨洪兵
(1.青岛农业大学 生命科学学院,山东省高校植物生物技术重点实验室,山东 青岛 266109; 2.四川省凉山州农业科学研究所 高山作物研究站,四川 凉山 616150)
荞麦又称乌麦、甜荞、花荞、荞子等,为蓼科(Polygonaceae)荞麦属(FagopyrumMill.)一年生草本植物,籽粒呈三棱圆形,又叫三角米[1];荞麦在全球分布很广,但主要集中在北半球,我国是荞麦主要生产国之一,主要分布在山区,我国常见栽培品种有甜荞麦(FagopyrumesculentumMoench)和苦荞麦(Fagopyrumtataricum(L.) Gaertn.)2种,北部为甜荞主产区,西南部为苦荞主产区。荞麦富含蛋白质、脂肪及芦丁、槲皮素、荞醇等黄酮类物质,具有较高的营养和药用价值[2-3]。荞麦因含有丰富的黄酮类化合物而成为功能性食物,黄酮类化合物属于多酚类,具有多种有益的生物学效应,健康食品一直是人们的热门话题,荞麦种子作为功能食物已在世界各地广泛应用[4]。
土壤盐渍化已经成为影响农业生产和生态环境的主要非生物逆境因素之一,我国的盐渍化土壤主要分布在平原地区,地下水资源较为丰富,具有较大的生产潜力和良好的开发价值[5]。盐分过多会造成植物生理干旱、离子毒害和生理代谢紊乱等多种危害,给农业生产带来很大损失,人们通过物理化学和生物改良等综合技术措施治理盐渍土壤已经刻不容缓[6]。
本研究以12个甜荞新品种为试验材料,盐胁迫下通过测定种子发芽率、幼苗生理指标及FtNHX1基因表达量来比较它们的耐盐特性,旨在为荞麦耐盐品种筛选及有效利用盐碱地资源提供依据。
1 材料和方法
1.1 试验材料
12个甜荞新品种平荞2号、定甜荞3号、赤甜荞1号、TQ11-3、T407-8、通荞2号、云甜荞1号、蒙0825、甜荞1307-179、平选03-122、TQ11-6和赤甜荞2号,由四川省凉山州西昌农科所高山作物研究站提供。
1.2 种子发芽率测定
挑选籽粒饱满、大小一致的甜荞种子121粒,1 g/L高锰酸钾消毒10 min,去离子水吸涨5 h,种子均匀摆放在铺有滤纸培养皿中,NaCl胁迫浓度为100 mmol/L,26 ℃培养箱培养,每天同一时间记录发芽数,5 d后计算发芽率每个处理设3次重复。
发芽率(Gr)=n/N×100%,n为发芽数,N为种子总数。
1.3 幼苗生理指标测定
甜荞幼苗采用1/2 Hoagland营养液培养,自然光照,昼夜温度26 ℃/ 18 ℃,相对湿度60%左右,培养至两叶一心期开始100 mmol/L NaCl胁迫处理,3 d后测定相关生理指标。采用TTC法测定根系活力[7];参照侯冬花[8]的方法测定质膜透性;参照侯福林[9]的方法测定MDA含量;参照高树涛等[10]的方法测定SOD活性。幼苗在NaCl胁迫处理前测定鲜质量,处理5 d后再测一次鲜质量,2次测定的差值即为鲜质量增加量。每个处理设3次重复。
1.4 RNA提取及FtNHX1表达量分析
提取高质量RNA是对植物组织进行分子水平研究的必要前提[11],TRIzol是一种新型RNA抽提试剂,内含异硫氰酸胍等物质,能迅速破碎细胞,抑制细胞释放的核酸酶,适用于从细胞和组织中快速分离RNA[12]。取样品0.1 g,按照TRIzol试剂盒步骤提取RNA,电泳检测其质量,分光光度计测定RNA浓度后,取等量总RNA进行反转录,合成cDNA,参考荞麦FtNHX1序列设计引物,引物序列见表1。采用荧光定量PCR仪(Agilent Technologes Stratagene Mx3000p)进行实时荧光定量PCR,参照郭强等[13]的方法计算FtNHX1基因的相对表达量。
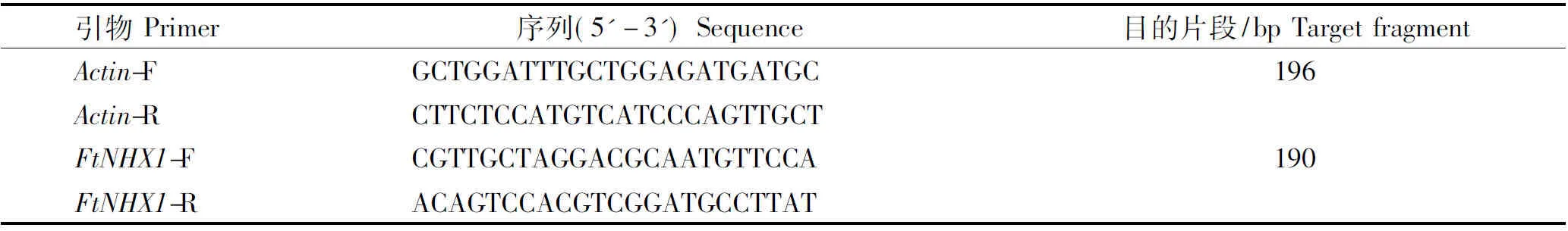
表1 荧光定量PCR所用引物Tab.1 The primers for Real-time PCR
2 结果与分析
2.1 盐胁迫对12个甜荞新品种种子发芽率的效应
由图1可知,盐胁迫下,12个甜荞新品种的种子发芽率均有不同程度的降低,其中,定甜荞3号、赤甜荞1号和甜荞1307-179的种子发芽率降低幅度相对较大,分别比对照降低了36.44,37.10,30.45百分点,说明这3个品种的种子对盐胁迫的耐受程度较低;TQ11-3、通荞2号、云甜荞1号、蒙0825和TQ11-6种子发芽率降低幅度较小,分别比对照降低了12.81,12.98,13.11,14.43,13.86百分点;而平荞2号和T407-8种子发芽率与对照间无显著差异,说明这2个品种的种子对盐胁迫具有较高的耐受程度。
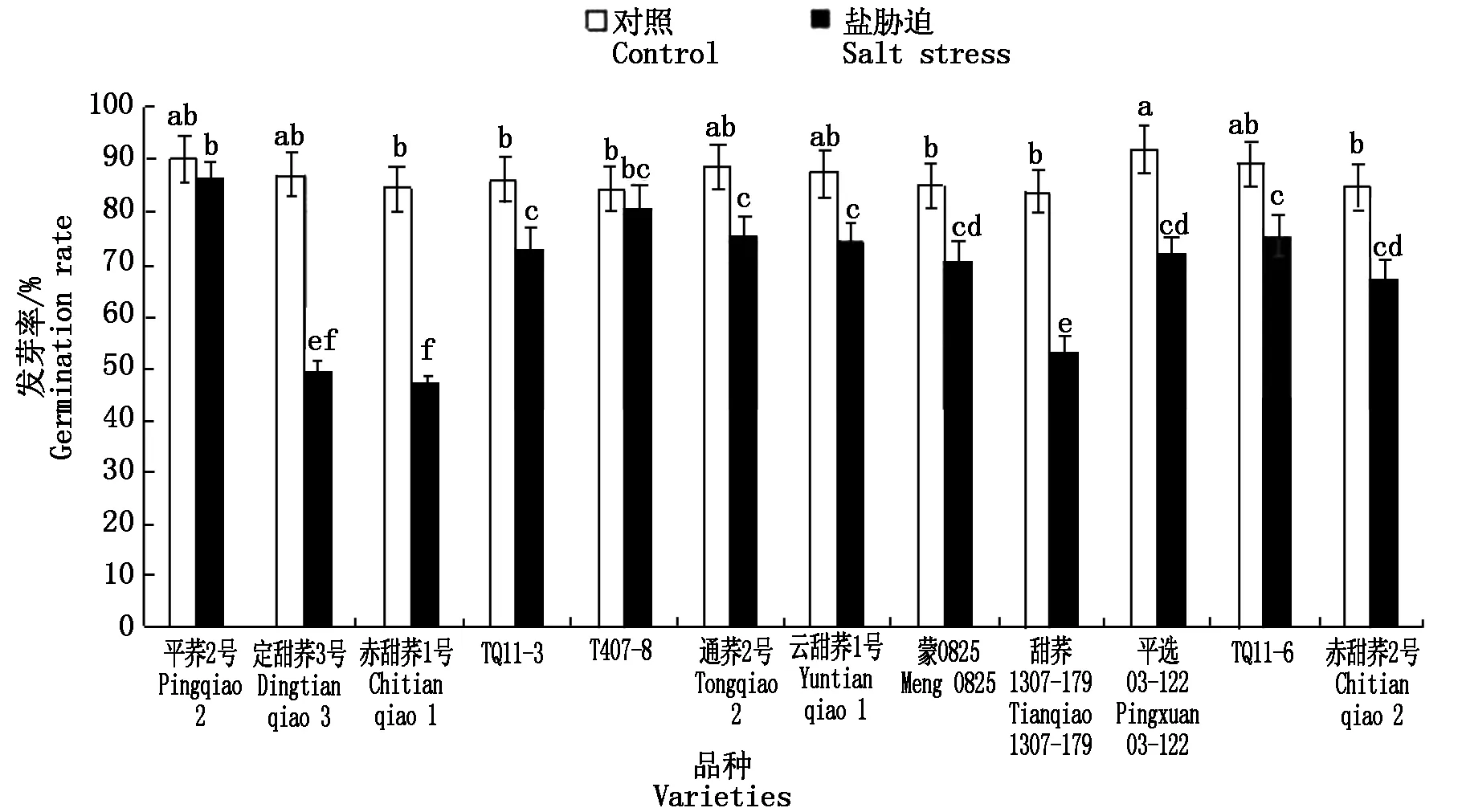
图柱上不同字母表示处理间在0.05水平上差异显著。图2-7同。 Values followed by Different letters are significantly Different at the 0.05 probability level. The same as Fig.2-7.
2.2 盐胁迫对12个甜荞新品种幼苗鲜质量的效应
由图2可知,盐胁迫对12个甜荞新品种幼苗鲜质量有明显不同的影响,盐胁迫下,平荞2号、T407-8和云甜荞1号幼苗鲜质量呈显著增加趋势,分别比对照增加了48.91%,71.48%和28.98%,说明盐分对这3个甜荞品种的幼苗生长具有明显促进效应,特别是对T407-8幼苗生长的促进效应更为突出;而定甜荞3号、赤甜荞1号和TQ11-6幼苗鲜质量显著降低,分别比对照降低了41.60%,47.49%和20.68%,其中,赤甜荞1号降低幅度最大,说明盐胁迫对赤甜荞1号幼苗生长的抑制作用较大;其他6个甜荞品种幼苗鲜质量与对照无显著差异,说明盐胁迫对这6个甜荞品种幼苗生长的影响较小。
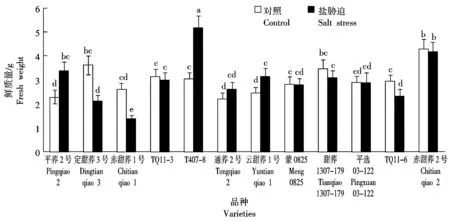
图2 盐胁迫对12个甜荞新品种幼苗鲜质量的效应Fig.2 Effect of salt stress on fresh weight of twelve new common buckwheat variety seedlings
2.3 盐胁迫对12个甜荞新品种幼苗根系活力的效应
根系活力反映植物根系吸收与代谢能力强弱,是衡量根系功能的主要指标之一,根系活力高低能直接影响植株抗逆性及地上部茎叶的生长和作物产量[14-15]。图3显示,与对照相比,盐胁迫下,12个甜荞新品种幼苗的根系活力均呈显著降低趋势,其中,定甜荞3号、赤甜荞1号、甜荞1307-179和TQ11-6的幼苗根系活力降低幅度较大,分别比对照降低了46.67%,47.44%,30.02%和32.68%,特别是定甜荞3号和赤甜荞1号根系活力降低更为明显;而平荞2号、T407-8和云甜荞1号根系活力降低幅度相对较小,分别比对照降低了15.50%,13.75%和14.52%,说明盐胁迫对这3个甜荞品种幼苗根系功能的影响较小。
2.4 盐胁迫对12个甜荞新品种叶片质膜透性的效应
电解质外渗率是目前用于评价细胞膜透性的一种常用指标,电解质外渗率常用相对电导率表示,相对电导率与质膜透性呈正相关[16-18]。由图4可知,盐胁迫下,12个甜荞新品种叶片质膜透性均有不同程度的增加,其中定甜荞3号、赤甜荞1号、TQ11-3、通荞2号、蒙0825、甜荞1307-179和赤甜荞2号叶片质膜透性显著增加,分别比对照增加了46.04,63.19,36.29,25.48,41.78,42.43,38.10百分点,特别是赤甜荞1号叶片质膜透性增加幅度最大;而其他5个甜荞品种叶片质膜透性与对照无显著差异,说明盐胁迫对这5个甜荞品种叶片细胞膜透性影响较小。
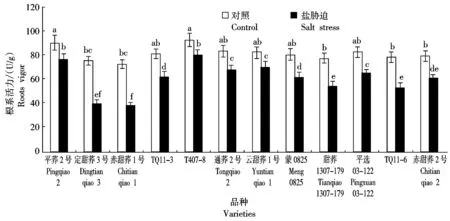
图3 盐胁迫对12个甜荞新品种幼苗根系活力的效应Fig.3 Effect of salt stress on roots vigors of twelve new common buckwheat variety seedlings
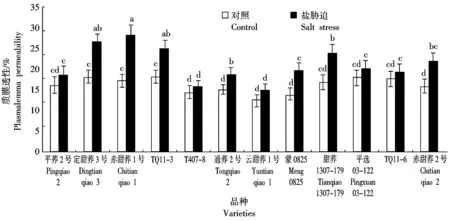
图4 盐胁迫对12个甜荞新品种叶片质膜透性的效应Fig.4 Effect of salt stress on leaf plasmalemma permeability of twelve new common buckwheat varieties
2.5 盐胁迫对12个甜荞新品种叶片MDA含量的效应
MDA是细胞膜脂过氧化的产物,其含量高低可以显示植物受逆境伤害的程度[19]。如图5所示,盐胁迫下12个甜荞新品种叶片MDA含量均显著高于对照,其中,定甜荞3号、赤甜荞1号、甜荞1307-179和TQ11-6增加幅度极大,分别比对照增加了554.85%,592.85%,424.46%和411.28%,说明盐胁迫下这4个甜荞品种叶片细胞膜脂过氧化程度较高;TQ11-3、蒙0825、平选03-122和赤甜荞2号增加幅度也较大,分别比对照增加了323.34%,391.58%,383.47%和382.21%;而平荞2号、T407-8、通荞2号和云甜荞1号增加幅度相对较小,分别比对照增加了222.12%,235.18%,267.69%和289.82%,说明盐胁迫下这4个甜荞品种叶片细胞膜脂过氧化程度相对较低。
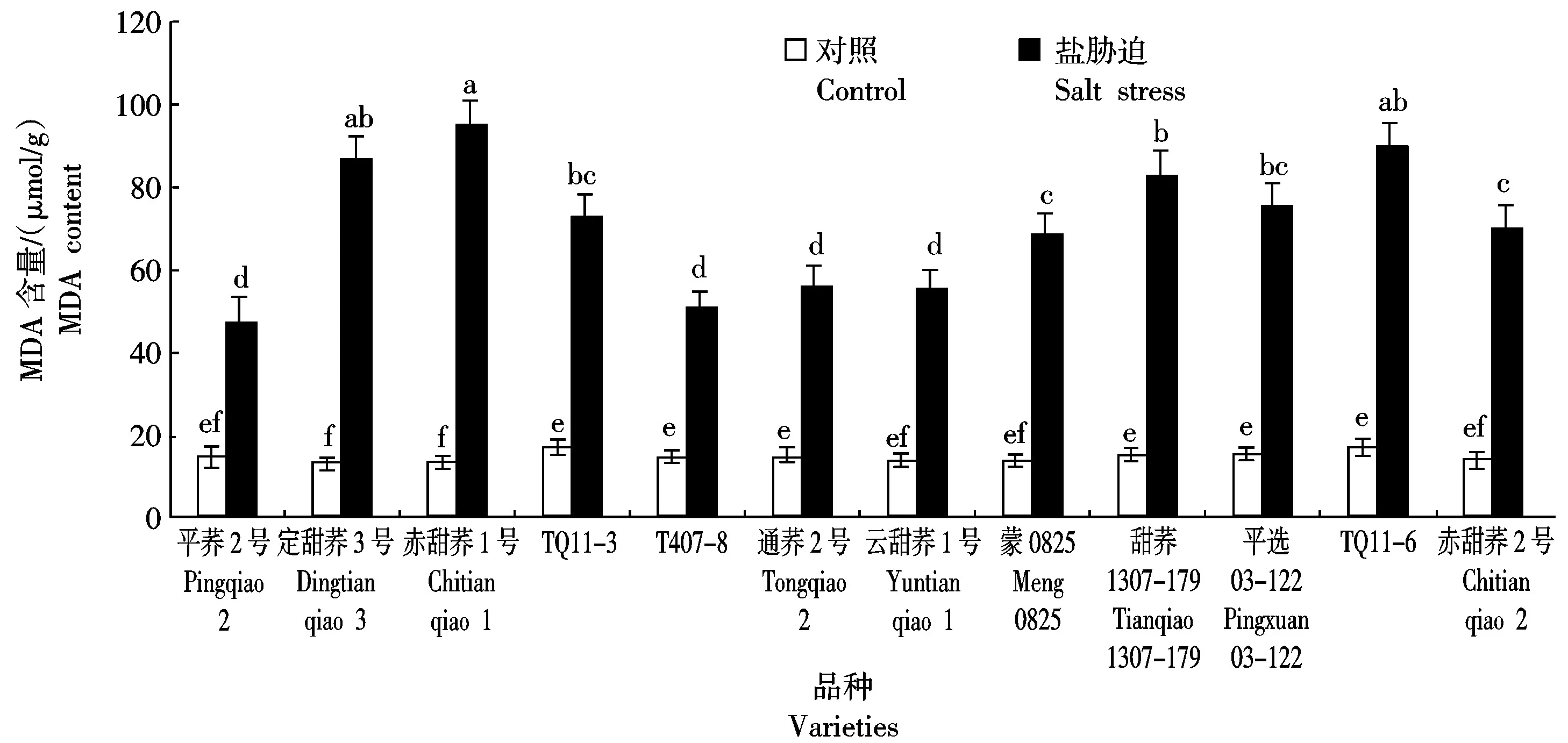
图5 盐胁迫对12个甜荞新品种叶片MDA含量的效应Fig.5 Effect of salt stress on leaf MDA content of twelve new common buckwheat varieties
2.6 盐胁迫对12个甜荞新品种叶片SOD活性的效应
SOD是一种普遍存在于动植物体内的酶,可以清除体内超氧阴离子自由基。逆境胁迫下,植物体内积累大量超氧阴离子等有害物质,导致SOD活性增强,SOD活性显著升高是植物受到胁迫的一个重要指标[20]。由图6可知,盐胁迫下12个甜荞新品种叶片SOD活性有明显不同的变化趋势,其中,平荞2号、T407-8和通荞2号叶片SOD活性显著增加,分别比对照增加了26.55%,38.41%和22.13%,说明这3个甜荞品种的抗逆性较强;而定甜荞3号和赤甜荞1号叶片SOD活性显著降低,分别比对照降低了24.99%和33.40%,说明这2个甜荞品种的抗逆性较弱;其他7个甜荞品种叶片SOD活性与对照相比无显著差异。
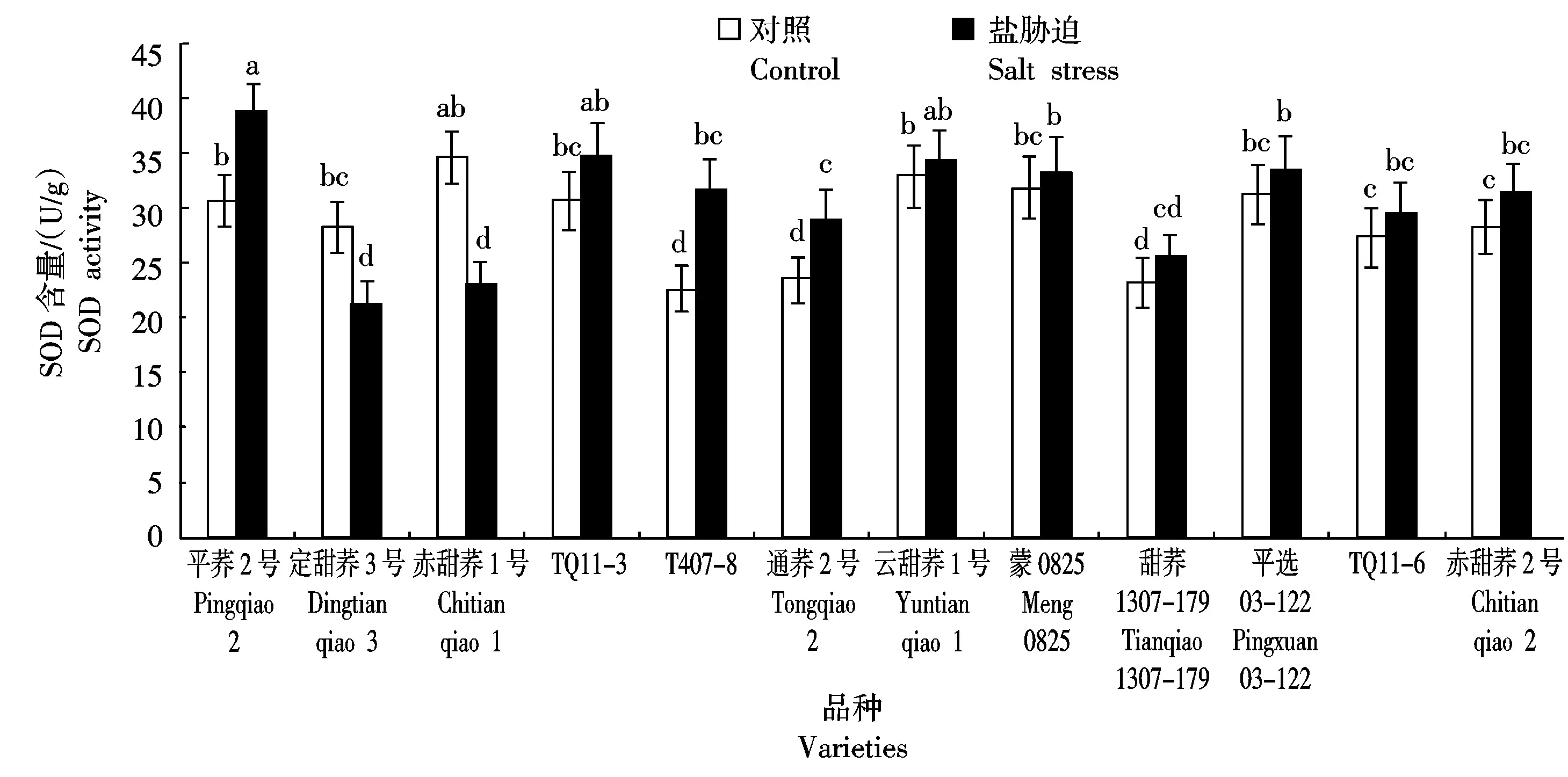
图6 盐胁迫对12个甜荞新品种叶片SOD活性的效应Fig.6 Effect of salt stress on leaf SOD activities of twelve new common buckwheat varieties
2.7 盐胁迫对12个甜荞新品种根部FtNHX1表达量的效应
Na+/H+逆向转运蛋白是负责Na+、H+交换的一种跨膜运输蛋白,在植物细胞离子运输中发挥重要作用,是植物耐盐的关键因子[21]。由图7可知,盐胁迫下,12个甜荞新品种根部FtNHX1表达量呈现出明显不同的变化趋势,其中,平荞2号、T407-8、通荞2号、甜荞1307-179和赤甜荞2号根部FtNHX1表达量显著增加,分别比对照增加了84.12%,58.51%,68.37%,51.42%和67.33%,平荞2号增加幅度最大,说明这5个甜荞品种根部FtNHX1表达受盐胁迫正调控,盐胁迫下这5个甜荞品种根部拒Na+能力增加显著;而定甜荞3号根部FtNHX1表达量显著降低,比对照降低了21.38%,说明定甜荞3号根部FtNHX1表达受盐胁迫负调控,盐胁迫下其根部拒Na+能力降低显著;其他6个甜荞品种根部FtNHX1表达量与对照相比无显著差异,说明盐胁迫对这6个甜荞品种根部FtNHX1表达量影响较小。
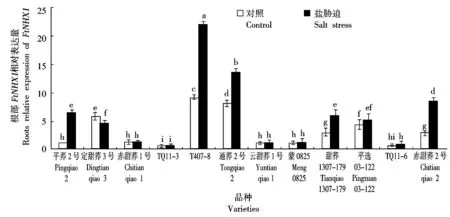
图7 盐胁迫对12个甜荞新品种根部FtNHX1表达量的效应Fig.7 Effect of salt stress on roots relative expression of FtNHX1 in twelve new common buckwheat varieties
3 讨论与结论
随着工业污染的加剧及化肥的不当使用,土壤次生盐渍化现象日益严重,盐渍化是影响植物生长发育和农作物产量的主要环境胁迫因子之一,植物耐盐性研究受到广泛重视,大多数作物种子萌发和早期幼苗阶段对盐胁迫最为敏感[22-24]。因此,种子发芽期的耐盐性鉴定也就成为研究重点。朱毅等[25]研究发现,随着盐浓度的增加,柳枝稷种子萌发受到抑制;孙小芳等[26]将NaCl胁迫对棉花种子萌发和幼苗生长的伤害概括为3个方面:一是渗透胁迫,高盐浓度造成棉花种子吸水进程迟缓,发芽势小,种子萌动慢;二是离子毒害;三是盐分对酶活性的抑制。本研究中,盐胁迫下定甜荞3号和赤甜荞1号种子发芽率及幼苗鲜质量降低幅度较大,说明对盐胁迫较为敏感;而平荞2号和T407-8种子发芽率与对照间无显著差异,且盐胁迫下这2个甜荞品种幼苗鲜质量显著增加,说明盐胁迫对平荞2号和T407-8生长具有明显促进效应,这2个甜荞品种的耐盐性较强。
植物细胞正常代谢过程中,细胞内活性氧产生和清除处于动态平衡状态,活性氧水平很低,不会伤害细胞,当植物受到胁迫时,活性氧累积过多,这个平衡就会被打破,活性氧的化学性质极其活泼,氧化能力很强,可与植物组织中几乎全部生物大分子进行反应,导致膜脂过氧化,膜的完整性被破坏[27];丙二醛(MDA)是膜脂过氧化的产物,MDA含量与过氧化伤害程度密切相关,MDA含量变化是膜系统受伤害的重要标志之一[28]。本研究中,盐胁迫下定甜荞3号、赤甜荞1号和甜荞1307-179叶片质膜透性和MDA含量增加幅度较大;而平荞2号和T407-8叶片质膜透性与对照间无显著差异,且叶片MDA含量增加幅度相对较小,说明盐胁迫对这2个甜荞品种的叶片膜结构伤害较小,平荞2号和T407-8的耐盐性较强。
陈炳东等[29]研究发现,低浓度盐胁迫下油葵根系活力明显增加,而高浓度盐胁迫下其根系活力显著下降。胁迫条件下植物体内会产生大量活性氧基团(ROS),超氧化物歧化酶(SOD)是生物体内超氧阴离子自由基的重要清除剂,对机体氧化和抗氧化平衡起着关键作用,可以有效防止ROS对生物的伤害[30-31]。本研究中,盐胁迫下平荞2号和T407-8根系活力降低幅度较小,且这2个甜荞品种叶片SOD活性显著增加,说明这2个甜荞品种的抗逆性较强;而定甜荞3号和赤甜荞1号根系活力和叶片SOD活性降低幅度较大,抗逆性较弱。
根部是植物吸收Na+的首要和重要部位,Na+从土壤溶液进入植物根系表皮和皮层细胞的过程受Na+浓度差或电势差的控制,Na+在根部的净积累是Na+被动流入与主动输出达到动态平衡的结果,耐盐植物限制Na+向地上部转运与其根部对Na+的滞留有密切关系[32];NHX可将细胞质中Na+区隔化到液泡,在植物拒Na+过程中发挥重要作用[33]。本研究中,盐胁迫下定甜荞3号根部FtNHX1表达量显著降低,说明定甜荞3号根部FtNHX1表达受盐胁迫负调控,盐胁迫下定甜荞3号根部拒Na+能力显著降低;而平荞2号和T407-8根部FtNHX1表达量显著增加,说明这2个甜荞品种根部FtNHX1表达受盐胁迫正调控,盐胁迫下根部拒Na+能力显著增加,可以有效限制Na+向地上部运输,耐盐性强。
总之,通过对种子萌发、幼苗生长、根系活力、叶片质膜透性、MDA含量、SOD活性及FtNHX1基因表达量等指标的综合分析可知,平荞2号和T407-8为甜荞耐盐品种,定甜荞3号和赤甜荞1号为盐敏感品种。

