猪TAK1基因的cDNA全长克隆、 时空表达及亚细胞定位分析
李 瑞,徐海霞,2,吴 伟,王素莹,任梦可,张朋朋,2,徐永杰,2
(1. 信阳师范学院 生命科学学院,河南 信阳 464000; 2. 信阳师范学院 大别山农业生物资源保护与利用研究院,河南 信阳 464000)
转化生长因子β激活激酶1(Transforming growth factor-β-activated kinase 1,TAK1)是MEK(MAPK/ERK激酶)激酶家族成员之一,是细胞信号传导通路上游重要的调节蛋白[1]。TAK1可被细胞因子、生长因子、激素、UV等刺激信号所激活,通过活化 JNK、p38 和 NF-κB 信号通路来参与调节细胞的自我更新、分化、存活和炎症反应等重要生物学过程[2-5]。小鼠中敲除TAK1基因会导致胚胎死亡,表明TAK1在小鼠正常发育中起着关键作用[6-7];组织特异敲除TAK1基因小鼠模型的研究,进一步揭示TAK1可以参与血管发育、角质细胞分化、造血细胞和肝细胞的存活、软骨和免疫器官的发育等多个发育过程[3,8-11]。在骨骼肌生长发育中TAK1也起着重要的调控作用, 其在小鼠骨骼肌发育早期被激活并呈现较高水平的表达,主要通过活化p38 MAPK信号通路调节成肌细胞的增殖与分化[12-15]。而TAK1缺失的小鼠胚胎成纤维细胞中转染导入MyoD基因也不能诱导分化为成肌细胞,进一步表明TAK1为成肌分化所必需[12]。此外,Ogura等[2]报道,TAK1对维持肌肉卫星干细胞池和肌肉再生也发挥重要作用。TAK1是肌卫星细胞的存活和增殖所必需的调控因子,它可以在肌卫星细胞中激活JNK和 NF-κB信号通路, TAK1的缺失或失活会诱导肌卫星细胞的氧化应激并通过坏死性凋亡引起自发的细胞死亡。因此,TAK1是一个影响动物骨骼肌成肌分化和肌肉再生的重要基因,把其作为猪肌肉生长和肌肉品质相关的候选基因进行研究,在畜牧业生产中具有重要意义。目前,有关猪TAK1基因的序列、表达模式以及结构功能等方面的研究还较少,本研究利用PCR和RACE(Rapid-amplification of cDNA ends,cDNA末端快速克隆)技术克隆获得了猪TAK1基因的cDNA序列全长,并对TAK1基因序列进行了生物信息学分析,同时利用实时荧光定量PCR(qRT-PCR)技术检测了TAK1基因在中外不同猪种(梅山猪与大白猪)背最长肌不同发育时期以及大白猪不同组织中的表达情况;利用瞬时表达系统将猪TAK1基因与GFP融合表达,通过激光共聚焦显微镜分析其亚细胞定位情况,旨在探讨猪TAK1基因的结构与功能,同时也为下一步细胞水平的功能研究以及揭示其在猪肌肉生长发育中的调控作用奠定基础。
1 材料和方法
1.1 试验材料
1.1.1 样品采集 试验猪为来自于华中农业大学精品猪场的纯种大白猪和梅山猪,在相同饲养管理条件下饲养,采集7个不同发育时期的背最长肌(胚胎期65 d及出生后3,21,60,90,120,180 d,每个时期3头母猪),另外采集出生后120 d大白猪的大脑、心、肝、脾、肺、肾、胰腺、脂肪、骨骼肌、胃、小肠、卵巢、输卵管、皮14个组织,各样品采集后置于液氮中速冻,最后统一转移至-80 ℃冰箱保存。
1.1.2 主要试剂TaqDNA聚合酶、TRIzol、RNA酶抑制剂、pMD19-T载体、质粒DNA抽提试剂盒、反转录试剂盒、dNTP、DNA Marker、胶回收试剂盒、T4连接酶、限制性内切酶、SYBR Green Master Mix等分子生物学试剂均购自TaKaRa公司;SMARTerTMRACE cDNA kit、Advantage 2×PCR kit均购自Clontech公司;胎牛血清、DMEM/F12培养基均购自Gibco公司;Fugene®HD转染试剂购自Promega公司;DAPI购自碧云天公司;其余试剂为国产分析纯。
1.1.3 质粒菌株 pcDNA3.1(+)、pcDNA3.1(+)-EGFP表达质粒由信阳师范学院动物分子生物学实验室保藏,感受态细胞JM109购自Promega公司。
1.2 引物设计及合成
以人TAK1基因的cDNA(NM_145333.2 )为信息探针,利用NCBI网站Blast(BlastN)工具搜索获取猪的TAK1基因EST 序列,然后用DNAStar软件构建猪EST-重叠群 ,再以此序列为基础利用Premier 6.0软件设计分离猪TAK1基因cDNA全长的5′RACE、3′RACE、CDS区以及时空表达分析的引物(表1),引物在南京金斯瑞生物科技有限公司合成。

表1 猪TAK1全长cDNA序列克隆和qRT-PCR分析的引物信息Tab.1 The PCR Primers used for full-length cDNA cloning and qRT-PCR analysis of porcine TAK1
注:下划线表示添加的限制性酶切位点。
Note:The underlines are the sites of restriction enzyme digestion.
1.3 猪TAK1基因的cDNA克隆
1.3.1 RNA提取和反转录将冻存的样品在液氮中迅速研磨成粉末,取100 mg组织样用TRIzol法提取总RNA,用超微量分光光度计测定RNA的浓度和纯度。以提取的总RNA为模板,用PrimeScript TR Master Mix试剂盒以Oligo(dT18)为引物合成cDNA第一链,同时利用SMARTerTMRACE cDNA kit构建猪肌肉组织RACE cDNA文库,具体操作按说明书进行 。
1.3.2 猪TAK1基因cDNA的克隆及测序 利用设计的猪TAK1基因CDS区引物,以反转录得到的cDNA第一链为模板进行PCR扩增,反应体系为20 μL: cDNA 2 μL,rTaqDNA聚合酶0.1 μL,10×PCR Buffer(含Mg2+) 2 μL,dNTP Mix(2 mmol/L)1.6 μL,上、下游引物(10 μmol/L)各0.8 μL,ddH2O 12.7 μL。PCR程序设置:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,36 个循环;72 ℃ 5 min。以构建得到的RACE cDNA文库为模板进行猪TAK1基因5′RACE、3′RACE扩增,反应体系为25 μL:ddH2O 17.3 μL,10×Advantage 2 PCR Buffer 2.5 μL,dNTP Mix(10 mmol/L) 0.5 μL,50×Advantage 2 ploymerase Mix 0.5 μL,RACE Ready cDNA 1.2 μL,通用引物UPM(10×)2.5 μL,3′RACE/5′RACE 引物0.5 μL。RACE PCR反应程序:94 ℃ 30 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 3 min,5个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 3 min,25个循环。PCR目的产物回收后纯化、克隆至pDM18-T载体,然后由测序公司(南京金斯瑞生物科技有限公司)完成序列测定。
1.3.3 猪TAK1基因的序列分析 分析方法参照文献[16]。首先,利用DNAStar软件将克隆得到的猪TAK1基因CDS区序列及完整5′和3′序列拼接成全长cDNA;然后利用GENSCAN 在线软件(http://genes.mit.edu/GENSCAN. htmL)分析猪TAK1基因的开放阅读框(ORF)和poly A位点,并利用EBI 的ProtParam 在线软件(http://www.expasy.org/cgi-bin/protparam)和NCBI在线工具CDD(http://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)对编码的蛋白质进行预测分析;最后,应用DNAMAN软件,对猪、牛、绵羊、人、恒河猴、大鼠、小鼠、兔、斑马鱼、爪蟾、火鸡11个物种TAK1基因的氨基酸序列进行同源性比较分析,并通过分子进化树软件MEGA 7.0,基于NJ(Neighbour-joining)法构建11个物种的TAK1蛋白系统发育树(Bootstrap设置为1 000)。
1.4 荧光定量PCR分析
根据猪TAK1基因的CDS序列设计特异引物(表1),以GAPDH为内参,采用SYBR Green法对猪TAK1基因在猪骨骼肌发育不同时期以及不同组织的表达量进行qRT-PCR分析。反应体系为20 μL:SYBR Green Master Mix 10 μL,cDNA模板0.5 μL ,上、下游引物(10 μmol/L)各0.6 μL,ddH2O 8.3 μL。反应在ABI 7300荧光定量PCR 仪上进行,反应程序为:95 ℃预变性5 min;95 ℃变性15 s,58 ℃退火30 s,72 ℃延伸15 s,40个循环;溶解曲线,65 ℃→95 ℃,每20 s升温1 ℃。2-ΔΔCT法计算mRNA的相对表达量, SPSS 14.0软件进行统计分析,One-way ANOVA法分析猪骨骼肌不同发育时期间的差异表达,t-test法分析不同猪品种间及不同组织间的差异表达。
1.5 真核表达载体pcDNA3.1-EGFP-TAK1 的构建、鉴定及转染
用分别添加EcoR Ⅰ和XhoⅠ酶切位点的上、下游引物扩增完整的猪TAK1基因CDS序列,然后将纯化后的扩增产物经EcoR Ⅰ和XhoⅠ酶切后回收目的片段,并添加真核表达载体pcDNA3.1(+)-EGFP与T4连接酶,于16 ℃连接过夜,然后转化至感受态细胞(JM109),筛选阳性克隆并进行DNA测序验证。将测序结果正确的菌液扩大培养,使用无内毒素质粒提取试剂盒提取pcDNA3.1(+)-EGFP-TAK1质粒。
将C2C12细胞接种至6孔板中,每孔加入2 mL无抗培养基,待细胞融合度达到30%~40%时,准备转染;向灭菌的1.5 mL离心管中加入200 μL Opti-MEM,再向其中加入6 μL Fugene®HD转染试剂,轻轻混匀,室温孵育5 min;然后向混合液中加入1 μg pcDNA3.1(+)-EGFP-TAK1质粒,轻轻混匀,室温孵育15 min;孵育结束后,将复合物逐滴加入到6孔板中,转染48 h后在倒置荧光显微镜下观察,收集细胞并提取RNA。同时转染的细胞经4% 多聚甲醛固定后,用细胞通透液室温通透细胞,再用DAPI染色,最后用激光共聚焦显微镜观察EGFP-TAK1在C2C12细胞中亚细胞定位情况。
2 结果与分析
2.1 猪TAK1基因的克隆及序列分析
以梅山猪骨骼肌5′RACE cDNA文库和3′RACE cDNA文库为模板,利用猪TAK1基因5′RACE特异引物和3′RACE特异引物分别进行PCR扩增,随后进行琼脂糖凝胶电泳检测(图1),结果显示,TAK1基因5′RACE有5条大于1 200 bp的条带,3′RACE有1条较清晰的800 bp左右的条带,将这6条带纯化回收后经测序比对发现,5′RACE中1 249 bp的带(图1箭头标示)为目的序列; 3′RACE的条带大小为812 bp(图1箭头标示),也与目的序列一致,并包含17 bp完整的poly A尾巴序列。以梅山猪骨骼肌cDNA为模板,用TAK1基因CDS区特异引物扩增该基因CDS全长,获得了1 740 bp的CDS序列。然后利用序列重叠将1 249 bp 的5′RACE序列、812 bp的3′RACE序列以及1 740 bp的CDS序列拼接得到猪TAK1基因2 163 bp的cDNA全长,该序列编码579个氨基酸,起始密码子“ATG”位于9-11 bp处,有脊椎动物典型的“ANNATG” 起始序列,终止密码子位于1 746-1 748 bp处,5′端非翻译区较短只有8 bp,3′端非翻译区有415 bp,末尾处有17 bp的 poly A尾巴序列,但目前未发现典型的“AATAAA”加尾信号(图2)。将该序列提交到GenBank,登录号为KU504629。
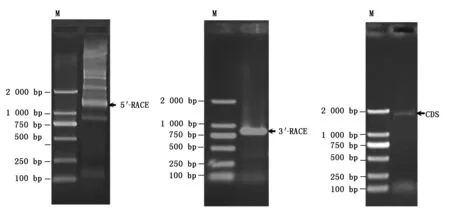
图1 猪TAK1基因克隆的琼脂糖凝胶电泳图 Fig.1 The electrophoresis of porcine TAK1 cDNA clone
利用EBI 的ProtParam软件和NCBI在线工具CDD对猪TAK1编码的蛋白质进行分析,结果显示,猪TAK1蛋白是由579个氨基酸组成,分子质量为64.1 ku,理论等电点为6.02,属于酸性蛋白;脂肪系数为71.12,总亲水性平均系数(Grand average of hydropathicity,GRAVY)为-0.540,属于亲水蛋白;不稳定指数为62.15,该蛋白不稳定。对其结构进行预测分析发现该蛋白有人类的TAK1结构特点,具有催化丝氨酸/酪氨酸磷酸化的STKc_TAK1结构域,另外还有多个保守的ATP结合位点、A-loop结构域、TAB1(TGF-beta activated kinase 1)结合位点(图3)。
利用GenBank数据库已有的TAK1的氨基酸序列:NP_766276.1(小鼠,Musmusculus)、NP_001075064.1(牛,Bostaurus)、XP_004011316.1(绵羊,Ovisaries)、XP_010705919.1(火鸡,Meleagrisgallopavo)、XP_006238028.1(大鼠,Rattusnorvegicus)、NP_003179.1(人,Homosapiens)、AFI35255.1 (恒河猴,Macacamulatta)、AAC14008.1(爪蟾,Xenopuslaevis)、AAT07829.1(斑马鱼,Daniorerio)、XP_002714631.1(兔,Oryctolaguscuniculus),构建分子系统进化树(图4)。结果表明,猪TAK1的氨基酸序列同其他物种具有很高的同源性,与人、恒河猴、绵羊、牛、小鼠、大鼠、兔、火鸡、爪蟾、斑马鱼TAK1的氨基酸序列同源性分别为98.8%,98.8%,98.8%,98.6%,98.4%,98.3%,97.9%,91.5%,90.0%,71.0%,表明TAK1蛋白在不同物种的进化中非常保守。基于氨基酸序列的遗传进化树分析可知,猪TAK1与人、恒河猴、绵羊、牛等哺乳动物聚为一类,具有更近的亲缘关系,与爪蟾、斑马鱼等的亲缘关系较远。

方框为起始密码子和终止密码子;小写字母为核酸序列,大写字母为对应的氨基酸序列。 Framed letters indicate the initiation codon and termination codon; The lowercase and uppercase are nucleotide sequence and protein sequence respectively.
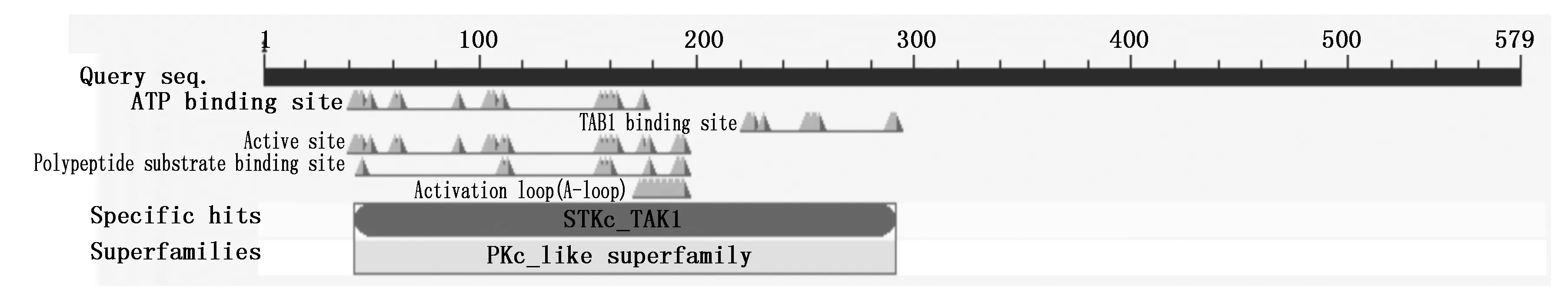
图3 TAK1蛋白保守序列的生物功能预测 Fig.3 Prediction of biological function of TAK1 conserved sequence
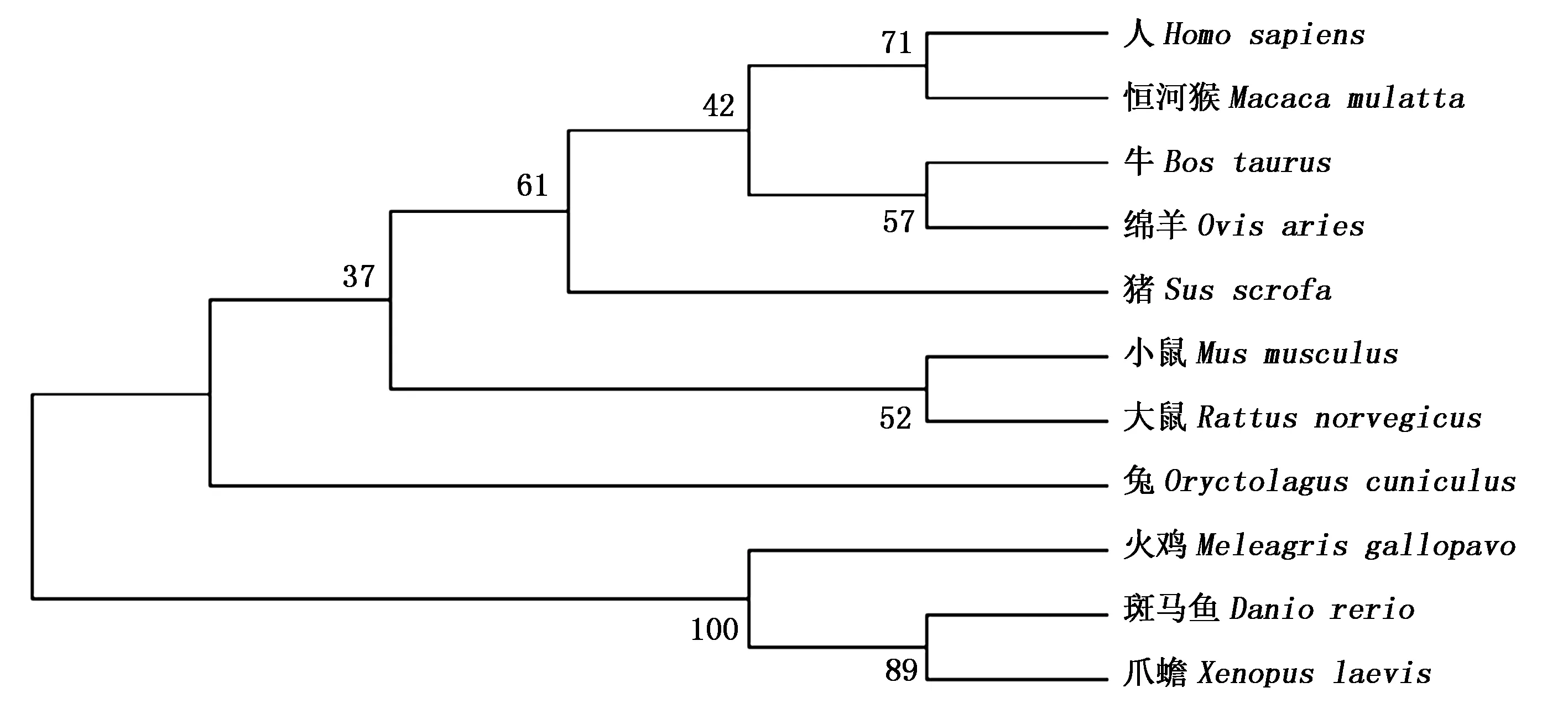
图4 基于氨基酸序列的TAK1基因系统发育树 Fig.4 The phylogenetic tree of TAK1 gene drawn with its amino acid sequence
2.2 猪TAK1基因的时空表达分析
利用qRT-PCR方法分析TAK1基因在大白猪(瘦肉型商品猪种)和梅山猪(脂肪型本地猪种)不同发育时期背最长肌中的表达情况(图5),结果表明,TAK1基因在2个品种猪背最长肌发育过程中具有类似的表达趋势,在胚胎期 65 d呈现最高的表达水平,随着生长发育而呈现下调趋势,并于出生后60 d表达量开始急剧减少,出生后180 d表达量达到最低;而同一时期品种间比较发现,TAK1基因在梅山猪各发育时期中的相对表达量均低于大白猪,其中出生后90 d,2个品种间差异不显著,其他时期差异均达到显著水平或极显著水平。TAK1基因在不同品种猪不同发育时期的背最长肌中的差异表达,表明在猪肌肉发育过程中,TAK1基因发挥着重要的调控作用。

65.胚胎期65 d;3~180.分别表示出生后3,21,69,90,120,180 d;图中含有相异小写字母和大写分别代表大白猪与梅山猪品种间差异显著(P<0.05)和极显著(P< 0.01)。
65.The 65 days of prenatal development stage; 3-180.The 3, 21, 69, 90, 120, 180 days of postnatal stage; Bar with Different lowercase letter and uppercase letters indicate significantly Different between Large White and Mashan pigs at the level of 0.05 and 0.01 respectively.
图5TAK1基因在猪背最长肌不同发育时期的表达
Fig.5ExpressionofporcineTAK1geneindifferentperiodoflongissimusdorsimuscledevelopment
此外,本研究还探究了TAK1基因在出生后120 d大白猪的大脑、心、肝、脂肪、背最长肌、胃、小肠、肺、脾、肾、胰腺、卵巢、输卵管、皮14个不同组织中的表达情况(图6),结果表明,TAK1基因在猪中具有组织特异性,其中脾脏中表达量最高,大脑和卵巢中表达量较高,心、肺、肾、脂肪、胃、小肠、输卵管、皮中表达量次之,肝和背最长肌中的表达量相对较低,胰腺中表达量最低。柱状图上方不同字母表示不同组织间差异显著(P<0.05)。
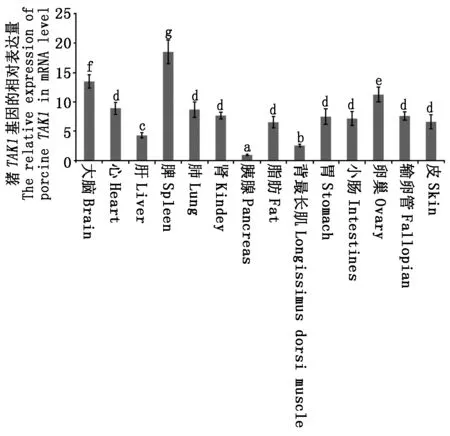
柱形图上方不同字母表示不同组织间差异显著(P < 0.05)。 Different letters donate significant differences between Different tissues (P < 0.05).
2.3 猪TAK1 基因融合表达载体的构建及亚细胞定位分析
为确定相关基因表达的蛋白质在细胞中发挥功能的具体位置,构建绿色荧光蛋白(GFP)与猪TAK1基因的融合表达载体,采用细胞转染技术将融合表达载体转染至小鼠C2C12成肌细胞中,转染48 h时效率最高,在激光共聚焦电子显微镜下观察TAK1和GFP融合蛋白的分布情况(图7),结果显示,融合蛋白仅在细胞质表达(绿色荧光),说明TAK1基因所编码的蛋白质定位于细胞质中。
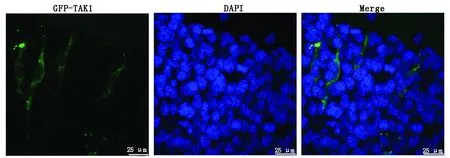
浅色为融合蛋白,深色为DAPI;Bar = 25 μm。 Light colour is the fusion protein, deep colour is DAPI; Bar = 25 μm.
3 结论与讨论
TAK1 作为MEK激酶家族的主要成员,在JNK、p38 和 NF-κB 等新报信号传导通路上游发挥作用,可能对细胞的自我更新、分化、存活起着重要的调节作用。目前,有关TAK1功能的研究主要是以人、小鼠、果蝇等为模型[2,16-17],在猪中鲜有报道。本研究成功地克隆得到猪TAK1基因的cDNA全长2 163 bp,编码579个氨基酸,与人、小鼠等物种TAK1基因比对发现,氨基酸同源性在98%以上,说明该蛋白质比较保守。经NCBI在线工具CDD对猪TAK1 蛋白进行保守结构分析,发现其在N端含有典型催化丝氨酸/酪氨酸磷酸化的STKc_TAK1结构域,而在该结构域内部还有TAB1(转化生长因子活化蛋白激酶1 结合蛋白)结合位点和A-loop结构域。先前的研究表明,TAB1可以与TAK1持续地结合并激活其激酶活性,进而引起TAK1在A-loop上的丝氨酸自身磷酸化从而彻底激活TAK1的活性[18-20],表明TAB1结合位点和A-loop结构域是TAK1的激活所必需的。这些保守的蛋白质结构域揭示了TAK1 在不同物种间行使的功能可能是一样的。
本研究通过qRT-PCR技术探讨了TAK1 基因在出生后120 d(成年期)大白猪14个不同组织中的表达情况,发现TAK1 基因在所检测的组织中均表达,但表达量存在显著差异,其在脾脏中表达量最高,在大脑和卵巢中也有较高表达,胰腺中表达量最低。猪TAK1的这种表达模式与人类、小鼠、比目鱼等物种的类似[21-23],即在脾脏、胸腺等免疫器官中高表达。先前的许多研究已证实TAK1 基因在免疫、炎症反应及生长发育过程中发挥着重要功能[9-12]。TAK1 基因对于哺乳动物细胞应对各种外界刺激至关重要,它可通过特定的信号转导途径激活NF-κB等转录因子,从而对来自微生物病原体或细胞因子的刺激做出应答与调节[1,6]。TAK1 基因还能通过TGF-β信号通路在大脑发育过程中调控轴突生长和神经元迁移[24-25]。TAK1 基因在不同组织中的差异表达,可能与其在不同组织中的功能不同密切相关。
TAK1 基因在猪背最长肌不同发育时期的表达结果表明,TAK1 基因在胚胎期65 d时特异的高表达,而出生后随着生长发育表达量下调,与在小鼠骨骼肌中的表达情况是一致的[12]。胚胎期65 d是猪骨骼肌次级纤维形成的一个关键时期,该阶段骨骼肌主要围绕初级肌纤维周围分化发育,次级肌管快速增加,胚胎期90 d之后肌纤维数目基本固定[26-27]。TAK1作为p38 MAPK信号通路的上游激活因子在成肌分化过程中起着关键调控作用,并且是IGF-1发挥肌源性作用所必需,沉默TAK1表达会抑制分化相关的p38 MAPK和Akt的激酶活性,进而抑制成肌分化[12-13],TAK1基因在猪胚胎期骨骼肌中高表达说明TAK1在猪肌形成特别是次级肌纤维形成过程中发挥着重要作用。此外,TAK1可以在肌卫星细胞中激活体JNK和 NF-κB信号通路,对维持肌肉卫星干细胞池和肌肉再生也起着重要作用[2],TAK1 基因在猪出生后表达量下调,可能与猪肌卫星细胞在出生后急剧减少有关。而不同时期(特别是在胚胎期和出生后3 d)2个猪品种间相比,TAK1 基因在大白猪中的表达量均高于梅山猪,这可能与TAK1参与调控成肌分化以及次级纤维形成有关,体型较大的大白猪次级肌纤维数目显著高于小型猪[28-29],而猪的产肉量主要由肌纤维数目和大小决定,因此,大白猪与梅山猪相比有较强的肌肉沉积能力。TAK1 基因可能与这2个猪品种肌肉沉积能力的差异有关,但具体的机制还有待于进一步深入探讨。
亚细胞定位是确定蛋白质功能的重要方法,本研究将构建pcDNA3.1(+)-EGFP-TAK1表达载体瞬时转染C2C12 细胞后成功表达EGFP-TAK1融合蛋白,激光共聚焦结果显示,TAK1蛋 白 主 要 在 细 胞 核 外 表 达,该 结 果 与TAK1 蛋白在细胞质中发挥其在多条信号转导途径充当激活因子的功能相一致。
本研究通过同源克隆和RACE 技术克隆得到了猪TAK1基因的全长,并且分析了该基因的序列特征、时空表达及亚细胞定位情况,为进一步研究其在动物肌肉发育中的作用机制奠定了基础。

