优质低蛋白饮食辅助复方α-酮酸片对血液透析患者血清hsCRP、IL-6水平及营养状况的影响
何艳 石秀祯
长江航运总医院肾内科,武汉 430010
据最新流行病学调查显示我国慢性肾病的患病率为10.80%,维持性血液透析是目前终末期肾病常用的治疗方案[1]。但长期血液透析会造成患者蛋白质丢失和营养不良,且患者多存在微炎症状态,导致感染、心脑血管病的发生风险明显增加[2]。因此,减轻或抑制机体炎症程度,改善患者营养状况对改善维持性血液透析患者的预后至关重要。有研究显示低蛋白饮食(0.6 g/kg·d)能够降低并发症,但仍会导致营养不良,因此本研究在此基础上采用改良后优质低蛋白饮食(0.8 g/kg·d)对患者进行治疗[3]。另有研究显示复方α-酮酸片能够补充机体所需氨基酸,减轻慢性肾衰竭患者的微炎症状态。目前,二者结合的临床报道较少[4]。因此,本研究拟观察优质低蛋白饮食联合复方α-酮酸片对患者营养状况及炎症相关因子超敏C反应蛋白(High sensitivity C reactive protein, hs-CRP)、白介素6(Interleukin 6, IL-6)的影响。
1 资料与方法
1.1 临床资料
纳入标准:1)血液稳定透析超过3个月;2)病情稳定,无明显血压波动;排除标准:1)合并其他慢性感染性疾病;2)近一个月内有急性感染史;3)严重心血管疾病患者;4)严重厌食者;5)对本研究所用药物中任何成分过敏者。研究方案经伦理学批注,患者知情同意。
选取2016年1月—2017年1月在本院接受维持性血液透析的肾功能不全患者90例,随机分为优质低蛋白组(低蛋白组)、优质低蛋白辅助复方α-酮酸片组(联合组),每组45例。低蛋白组男28例,女17例;年龄31~79岁,平均年龄(54.26±5.17)岁;透析时间1.25~5.05年,平均(3.55±1.02)年;慢性肾小球炎23例、糖尿病性肾病9例、高血压肾病10例、梗阻性肾病1例、多囊肾2例。联合组男30例,女15例;年龄33~76岁,平均(56.05±5.68)岁;透析时间1.50~5.18年,平均(3.60±1.13)年;慢性肾小球炎22例、糖尿病性肾病10例、高血压肾病8例、梗阻性肾病2例、多囊肾3例,两组一般资料,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
所有患者均给予降压、降脂、抗凝等常规治疗,并行常规碳酸氢盐血液透析,采用聚砜膜透析器和瑞典金宝AKl00透析机,每周3次,每次4 h,透析液成为为Na+140 mmol/L、K+2.0 mmol/L、Ca2+1.5 mmol/L,透析液温度为36.5℃,透析流量为500 mL/min。两组患者均给予0.8 g/kg·d的优质低蛋白饮食(根据个人饮食习惯和BMI值,由专职营养师制定个性化食谱,并记录饮食日记,期间可根据患者要求调整),联合组患者口服复方-α酮酸片(北京费森尤斯卡比医药有限公司,国药准字H20041442),4片/次,3次/天。两组患者均治疗6个月。
1.3 观察指标
采用主观综合性营养评估法(SGA)对患者治疗前及治疗6个月后进行营养状态评估,由肾病专科医师参照《慢性肾脏病蛋白营养治疗共识》中相关标准完成,评估结果分为营养良好、中度营养不良及重度营养不良3个等级。测量患者治疗前后身高、体重计算体质量指数(BMI)以及左侧上臂中点周长(MAC)、同侧肱三头肌处皮褶厚度(TSF)计算上臂肌围(AMC)=MAC-3.14×TSF。于治疗前及治疗后6个月测定血清总蛋白(Tp)、白蛋白(Alb)、前白蛋白(PA)、血红蛋白(Hb)、血清肌酐(Scr)、尿素氮水平(BUN)及hsCRP、IL-6水平。
1.4 统计学方法
应用SPSS21.0软件对实验数据进行统计处理,计量资料以均数±标准差()表示,采用独立样本t检验,计数资料以[n(%)]表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者营养状况比较
两组治疗前营养状况比较,差异无统计学意义(P>0.05);治疗后,联合组患者营养状况优于低蛋白组,但组间差异无统计学意义(P>0.05)。

表1 两组患者营养状况比较[n(%)]
2.2 两组患者治疗前后生化指标比较
两组治疗前血清生化指标比较,差异无统计学意义(P>0.05);两组治疗后血清Tp、PA水平比较,差异无统计学意义(P>0.05),联合组BUN、Scr水平明显低于低蛋白组(P<0.05),Alb、Hb水平明显高于低蛋白组(P<0.05)。
表2 两组患者治疗前后血清生化指标比较()
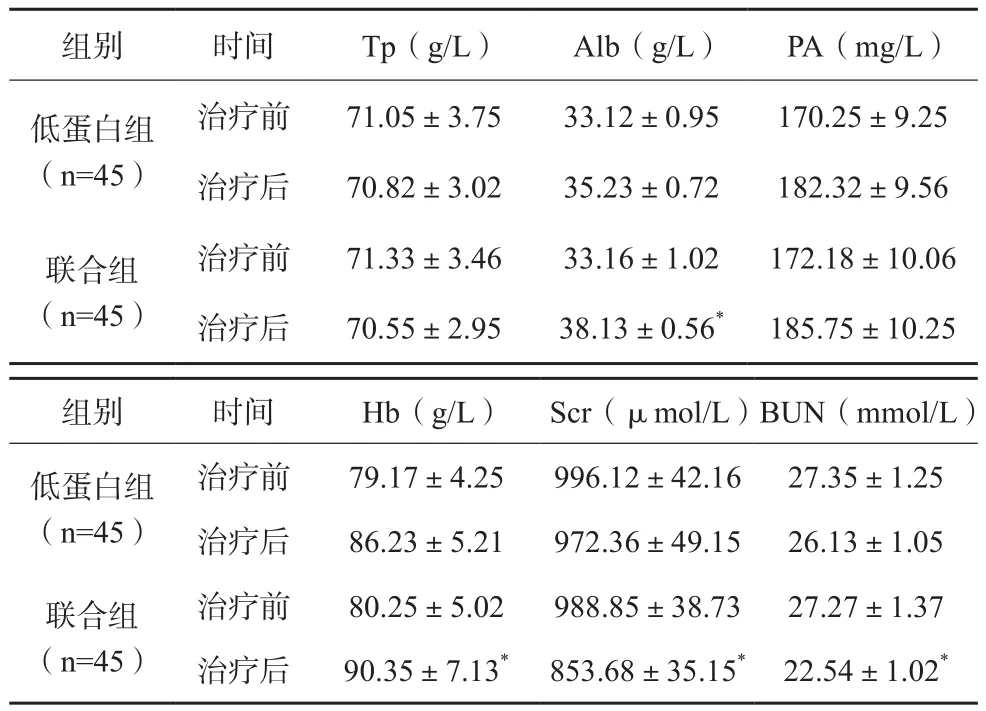
表2 两组患者治疗前后血清生化指标比较()
注:与低蛋白组比较,*P<0.05
组别 时间 Tp(g/L) Alb(g/L) PA(mg/L)低蛋白组(n=45)治疗前 71.05±3.75 33.12±0.95 170.25±9.25治疗后 70.82±3.02 35.23±0.72 182.32±9.56联合组(n=45)治疗前 71.33±3.46 33.16±1.02 172.18±10.06治疗后 70.55±2.95 38.13±0.56* 185.75±10.25组别 时间 Hb(g/L) Scr(μmol/L)BUN(mmol/L)低蛋白组(n=45)治疗前 79.17±4.25 996.12±42.16 27.35±1.25治疗后 86.23±5.21 972.36±49.15 26.13±1.05联合组(n=45)治疗前 80.25±5.02 988.85±38.73 27.27±1.37治疗后 90.35±7.13* 853.68±35.15* 22.54±1.02*
2.3 两组患者治疗前后人体测量学指标比较
两组患者治疗前BMI、AMC比较,差异无统计学意义(P>0.05);治疗后联合组患者BMI、AMC均高于低蛋白组,组间差异有统计学意义(P<0.05)。
表3 两组患者治疗前后人体测量学指标比较()
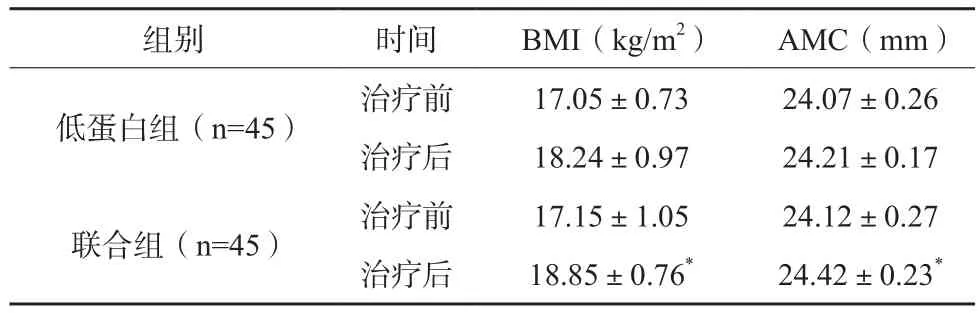
表3 两组患者治疗前后人体测量学指标比较()
注:与低蛋白组比较,*P<0.05
组别 时间 BMI(kg/m2) AMC(mm)低蛋白组(n=45) 治疗前 17.05±0.73 24.07±0.26治疗后 18.24±0.97 24.21±0.17联合组(n=45) 治疗前 17.15±1.05 24.12±0.27治疗后 18.85±0.76* 24.42±0.23*
2.4 两组患者治疗前后血清hs-CRP、IL-6水平比较
两组患者治疗前血清hs-CRP、IL-6水平比较,差异无统计学意义(P>0.05);治疗后联合组hs-CRP、IL-6水平均低于低蛋白组,组间差异有统计学意义(P<0.05)。
表4 两组患者治疗前后血清hs-CRP、IL-6水平水平比较()

表4 两组患者治疗前后血清hs-CRP、IL-6水平水平比较()
注:与低蛋白组比较,*P<0.05
组别 时间 hs-CRP(mg/L) IL-6(ng/L)低蛋白组(n=45) 治疗前 8.35±1.05 133.51±19.84治疗后 8.19±0.91 122.35±18.21联合组(n=45) 治疗前 8.44±1.36 127.95±22.46治疗后 5.29±0.82* 82.35±11.32
3 讨论
维持性血液透析患者营养不良-炎症反应综合症[5]为血清蛋白降低,蛋白质分解代谢增加,静息能量消耗增加,促炎因子及hs-CRP均在正常范围内不同程度升高的现象。研究认为,血液透析患者微炎症与营养不良互为因果关系[6-7]。
研究表明每次透析可造成蛋白丢失8 g左右,为保证营养,需增加蛋白质摄入[8],若蛋白摄入过量(0.12 g/kg·d)会导致蛋白分解,加重毒素潴留影响透析效果,同时可引发高磷血症,继发甲状腺功能亢进及肾性骨病等[9];摄入蛋白不足(0.6 g/kg·d)时会导致负氮平衡,造成患者免疫功能下降,引起微炎症反应,增加相关并发症发生风险,增加患者死亡率[10]。目前,国内尚无血液透析患者每天最佳摄入蛋白量的参考标准,约有23%~73%的患者存在不同程度营养不良[11]。本研究采用改良后的优质低蛋白饮食后患者营养不良状况较治疗前有改善,营养不良发生率由33.33%降至20.00%。
微炎症状态除增加患者感染等并发症发生风险外[12];且微炎症时机体炎症因子会加快肌肉分解代谢,加重营养不良[13]。据调查资料显示约有35%~65%的维持性血液透析患者存在微炎症[14],其主要表现为炎性因子hs-CRP和IL-6水平的小幅度升高[15]。复方α-酮酸是由酮代氨基酸钙、羟代氨基酸钙及5种氨基酸组成的复方制剂,其能够提供人必需氨基酸,减少尿毒症产物蓄积。研究指出复方α-酮酸片配合低蛋白饮食(0.6 g/kg·d)能够改善早期慢性肾病患者营养状况、减少尿蛋白排放量,对肾脏亦具有保护作用[16]。本研究联合方案治疗能够降低患者血清炎症因子水平,其营养状况改善情况亦优于单纯优质低蛋白饮食治疗组。
综上所述,优质低蛋白饮食辅助复方α-酮酸片能够提高维持性血液透析患者Alb、Hb、BMI、AMC水平,改善患者营养状况,亦能够降低血清hs-CRP、IL-6水平,改善微炎症状态,在提高患者生活质量方面具有重要临床意义。

