响应面优化西兰花副产物ITC提取及抗氧化性研究
(永城职业学院食品化工系,河南永城 476600)
西兰花(Brassica oleracea L.ver.Italica Plenck),属十字花科(Cruciferae)芸苔属(Brassica)甘蓝种的一个变种。流行病学研究表明,一般食用芸苔蔬菜,特别是西兰花,会降低许多非传染性疾病的风险。芸苔蔬菜类对健康促进作用通常主要归于其次生代谢产物水解产生的异硫氰酸酯(isothiocyanate,ITC),而硫代葡萄糖苷(简称硫苷glucosinolates,GS)则是其前体。近来研究表明,异硫氰酸酯能够改变环境致癌物质的代谢和排泄从而具有良好的抗癌作用[1],ITC预防癌变的第二种机制是能诱导癌细胞周期停滞和凋亡,从而抑制肿瘤的生长[2];此外ITC还具有抗癌、调节免疫活性、预防心血管疾病和保护中枢神经系统等作用[3-4]。由于ITC具有多重抗癌功效而被视为现代新型防癌、抗癌物质。
西兰花是十字花科主要的作物之一,然而在生产链的不同阶段产生了大量西兰花边角废料和副产品,其中叶和茎大约占西兰花的总重量的40%~50%左右[5]。西兰花总GS含量低于其他常见的芸苔蔬菜[6],其茎和叶GS含量也比西兰花种子含量低,但西兰花种子价格高达4 000元/kg[7],生产成本高昂;尽管其总GS含量较低,但西兰花收获后废弃物指数高,其产生大量有机固体废物用来提取GS具有经济可行性,易于实现产业化。这些西兰花副产物是构成高附加值化合物的重要来源,可以用于食品添加剂或开发新的功能性食品。而传统有机浸提西兰花ITC的工艺存在安全问题,或因温度过高导致产率低的问题[8-9];因此与传统提取技术相比,急需开发新的提取技术以缩短提取时间、减少溶剂消耗并提高提取率;超声辅助提取利用超声空化效应,促进细胞破裂增加溶剂的渗透,从而提高提取率[10-12]。
本试验以西兰花副产物为原料,通过超声波辅助提取ITC,采用比色法测定ITC含量,通过单因素试验研究超声功率、超声时间、料液比以及超声温度等因素对ITC提取率的影响,在单因素基础上进行响应面优化,得出最佳提取工艺参数。并将提取得到的ITC进行体外抗氧化活性研究,以期为西兰花副产物的综合开发利用提供科学依据。
1 材料和设备
1.1 材料和试剂
新鲜西兰花副产物(茎):市售。
乙醇、氯化铁、氯化亚铁、磷酸盐缓冲液、福利酚试剂、1,2-苯二硫酚(均为分析纯):南京化工厂;甲醇、乙腈(均为色谱纯):天津市光复科技发展有限公司;莱菔硫烷标准品、1,1-二苯基-2-三硝基苯肼(DPPH):Sigma,UK;2,4,6-三吡啶基三嗪:Bio-rad。
1.2 仪器
HH恒温水浴锅:金坛市中大仪器厂;VGT-1860 QTD固特超声单槽超声波清洗机:广东固特超声股份有限公司;FA2004N电子天平:上海舜宇恒平科学仪器有限公司;TG16台式离心机:长沙英泰仪器有限公司;烘箱:天津天有利科技有限公司。
2 试验方法
2.1 西兰花副产物预处理
将新鲜的西兰花茎洗净,用刀切成薄片(0.1 cm~0.3 cm)后迅速在90℃热烫5 min进行灭酶处理。将灭酶后得西兰花薄片在60℃下恒温干燥后粉碎过60目筛得到西兰花茎粉末(broccoli stem powder,BSP)备用。
2.2 ITC提取工艺
称取3份1 g BSP并加入10 mL蒸馏水于3个50 mL三角瓶中,在提取温度为40℃、超声功率为60 W条件下提取20 min。提取结束后在4 000 r/min条件下离心15 min,收集上清;沉淀再用10 mL蒸馏水水洗后离心,合并上清液过滤,测定样品ITC、总酚含量以及抗氧化活性。
2.3 ITC提取单因素试验
选择超声提取温度、超声提取时间、超声提取功率、料液比以及pH值为研究变量,考察超声提取温度、超声提取时间、超声提取功率、料液比以及pH值对西兰花副产物ITC提取产率的影响。
2.4 响应面分析试验
在单因素试验结果的基础上,根据Box-Benhnken的中心组合试验设计原理,选取超声功率、超声时间、提取温度和料液比4个影响最为显著的因素为自变量,采用四因素三水平的响应面试验设计,见表1。

表1 Box-Behnken试验设计Table 1 Experimental design and variables levels for Box-Behnken
2.5 西兰花ITC的测定方法
2.5.1 ITC标准曲线
ITC与1,2-苯二硫酚发生环化缩合反应生成1,3-苯并二硫代-2-硫酮在365 nm处有特征吸收峰;且该反应不受硫氰酸盐、氰酸盐、异氰酸盐等相关物质的干扰,同时该方法灵敏度高,测定下限低于1 nmol;因此采取该法简便可行。按照zhang等[13]的方法略有修改;将莱菔硫烷标准品用甲醇配制成1、10、20、30、40 μmol/L,分别取0.1 mL置于2 mL具塞管中依次加入 0.9 mL 0.1 mol/L pH 8.5 PBS 和 1 mL 8 mmol/L 1,2-苯二硫酚甲醇溶液,在60℃水浴振荡反应30 min后;于365 nm处测定吸光值。标准曲线方程如下:
y=0.925 7x+0.016 62,R2=0.997 2
式中:y为待测液在365 nm处的吸光度(A365);x为ITC含量,μmol/L。
2.5.2 样品ITC含量测定
取上清滤液0.1 mL置于试管中,依次加入0.9 mL 0.1 mol/L pH 8.5磷酸盐缓冲液和1 mL 8 mmol/L 1,2-苯二硫酚甲醇溶液,在60℃水浴振荡反应30 min后;于365 nm处测定吸光值。
2.6 ITC抗氧化能力测定
2.6.1 DPPH测定[15]
在 5 μL 样品中加入 245 μL 0.1mmol/L DPPH 甲醇溶液,于室温反应30 min后,在517 nm处测定样品和标准对照Trolox对DPPH自由基的清除能力,结果用mmol/mL Trolox相对值表示。
2.6.2 ABTS+自由基测定
根据Biegańskamarecik等[16]ABTS+法测定自由基清除活性。将0.007 mol/L ABTS+自由基溶液与0.002 mol/L过硫酸钾溶液以1∶0.5(体积比)混合在室温下避光放置12 h~16 h。测定前,将ABTS+自由基溶液用pH7.4的磷酸盐缓冲液稀释直到ABTS+自由基溶液达到0.700±0.020的吸光度。将提取上清液(50 μL)与5 mL稀释的ABTS+自由基溶液混合,37℃下反应5 min后在734 nm测定其吸光度A734,以PBS缓冲液用作空白。平行测定3次,根据以下公式算ABTS+自由基的清除率,结果用μmol/mL Trolox相对值表示。
ABTS+自由基清除率/%=[1-A/A0]×100
式中:A为样品吸光值;A0为空白吸光值。
2.6.3 ITC还原能力测定[15]
现配Ferric reduction ability power(FRAP)溶液:0.3 mol/L pH 3.6醋酸盐缓冲液、10 mmol/L溶于40mmol/LHCl的 2,4,6-三吡啶基三嗪溶液和 20mmol/L FeCl3以10∶1∶1体积比混合。取5μL样品中加入245μL FRAP溶液,于室温反应10 min后,在593 nm处测定样品和标准对照Trolox还原Fe3+的能力,结果用mmol/mL Trolox相对值表示。
3 结果与分析
3.1 单因素试验结果
3.1.1 超声功率对ITC提取量的影响
超声功率对ITC提取的影响见图1。
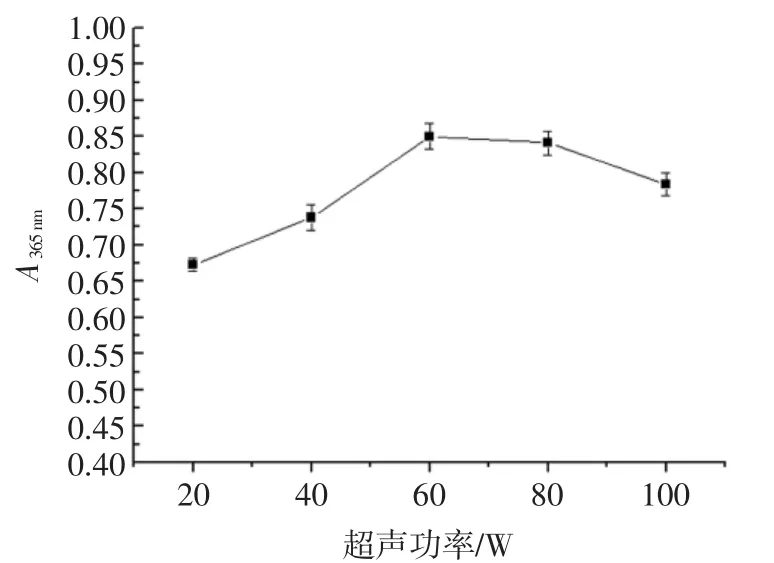
图1 超声功率对ITC提取的影响Fig.1 The effect of ultrasonic power on the extraction volume of ITC
由图1可知,超声功率由20 W~100 W过程中,ITC含量不断增大,在60 W时吸光度值最大为0.850(ITC含量为803 μmol/L),当超声功率继续增大时,ITC含量开始下降,原因是超声功率的增大使得ITC水解被破坏[17];由于在60 W和80 W测得的吸光度值无显著差异(n=3,p>0.05),考虑节约能源与工业化生产经济可行性等因素条件下超声功率选取60 W为宜。
3.1.2 超声时间对ITC提取量的影响
超声时间对ITC提取的影响见图2。

图2 超声时间对ITC提取的影响Fig.2 The effect of ultrasonic time on the extraction volume of ITC
由图2可知,超声时间由10 min~20 min过程中,ITC含量不断增大,在20 min时吸光度值最大为0.727(ITC含量为690 μmol/L),当进一步延长超声时间,ITC含量开始下降,可能是因为超声时间过长导致产物水解。因此超声时间选择15 min为宜。
3.1.3 提取温度对ITC提取量的影响
提取温度对ITC提取的影响见图3。
由图3可知,提取温度由20℃~60℃过程中,ITC含量快速增加后变得缓慢,而后开始下降,提取过程中因为超声的空化效应和芥子苷酶活性逐渐增大,ITC的含量急剧增大;当继续增大温度时,由于硫苷热不稳定性和酶活性下降,同时ITC开始发生降解,因而ITC含量开始下降[18];因此,提取温度选取30℃为宜。

图3 提取温度对ITC提取的影响Fig.3 The effect of extraction temperature on the extraction volume of ITC
3.1.4 料液比对ITC提取量的影响
料液比对ITC提取的影响见图4。

图4 料液比对ITC提取的影响Fig.4 The effect of solid-liquid ratio on the extraction volume of ITC
由图4可知,在增大提取液过程中,ITC含量不断增大后趋于水平,当提取液用量小时,ITC未能充分溶出;而当提取液用量不断增大时,ITC溶出率趋于饱和。当料液比为1∶20(g/mL)吸光度值最大为0.567(ITC 含量为 541 μmol/L),由于料液比为 1 ∶15(g/mL)和1∶20(g/mL)的吸光值在统计学上无显著性(p>0.05),因此,料液比选取 1 ∶15(g/mL)为宜。
3.1.5 pH值对ITC提取量的影响
pH值对ITC提取的影响见图5。
由图5可知,pH 5~8范围内有利于ITC的生成,当pH值小于5时,硫苷在黑介子酶作用下主要形成氰类物质,在pH 5~8范围内生成异硫氰酸酯类物质。由图可知pH 5~8范围内有利于ITC的生成,结合已有文献选择pH 7为宜[19]。

图5 pH值对ITC提取的影响Fig.5 The effect of pH on the extraction volume of ITC
3.2 响应面法优化ITC提取工艺
采用Design-Expert 8.0.6对试验数据进行回归分析,拟合二次多项式方程,用R2表示拟合度;采用F检验对响应面试验数据进行方差分析以评价模型的统计学意义。
3.2.1 Box-Behnken设计方案及试验结果
根据Box-Behnken的中心组合试验设计原理,依据单因素试验结果,选取超声时间、超声功率、提取温度和pH值作为主要因素,以ITC浓度(mmol/L)为响应值。依据Design-Expert 8.0.6软件设计试验方案,结果见表2。
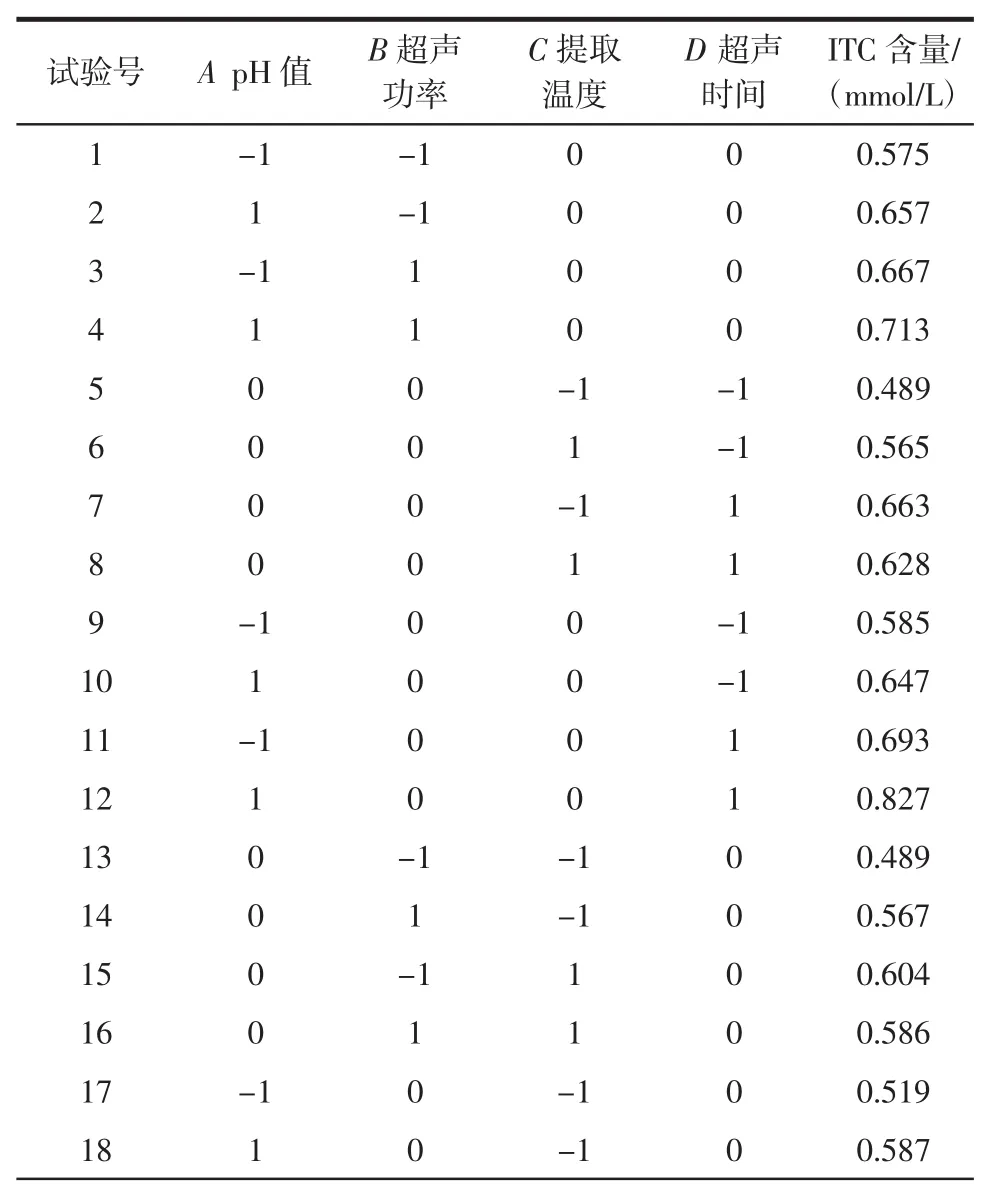
表2 Box-Behnken试验设计及试验数据结果Table 2 Box-Behnken design matrix and the experimental result

续表2 Box-Behnken试验设计及试验数据结果Continue table 2 Box-Behnken design matrix and the experimental result
3.2.2 模型建立及方差分析
运用Design-Expert 8.0.6对表2的试验数据进行多元回归分析,得到以硫苷含量(Y)为响应值的拟合方程:

回归方程的方差分析结果见表3。
由表3可知,pH(A)、超声功率(B)、提取温度(C)、超声时间(D)、超声时间和超声功率的交互项(BD)、pH 值二次项(A2)、超声功率二次项(B2)、提取温度二次项(C2)和超声时间二次项(D2)达到极显著水平(p<0.01);超声功率和提取温度交互项(BC)与提取温度和超声时间交互项(CD)达到显著水平(p<0.05)。这说明选取的试验因素对响应值不是简单的线性关系,还能看出各因素对ITC含量的影响大小顺序:D>A>B>C。
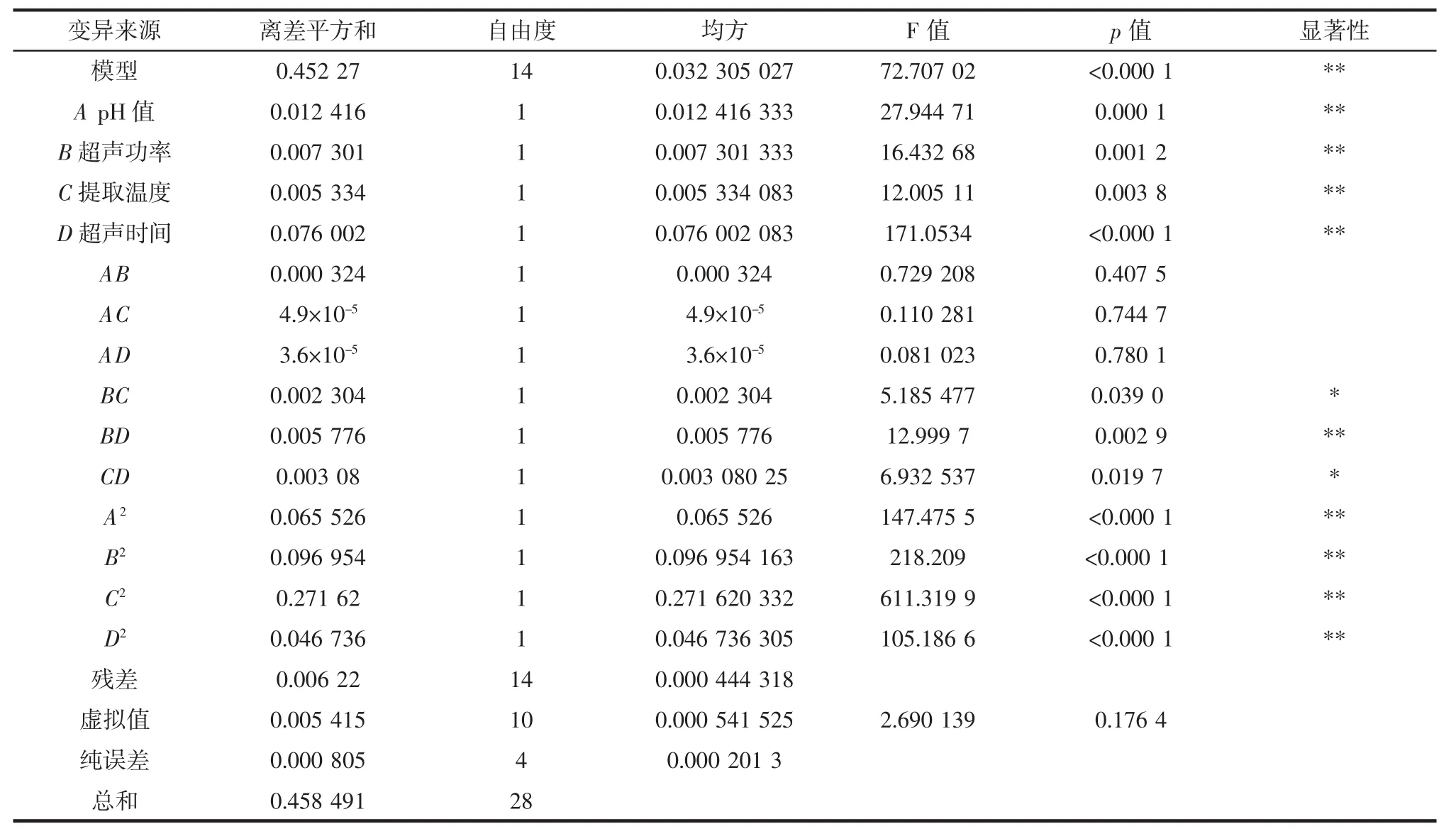
表3 响应面二次回归模型的方差分析Table 3 Analysis of variance for response surface quadratic regression equation
该模型的 R2值为 0.986 4(p<0.000 1),虚拟项不显著(p=0.176 4),说明通过二次回归得到的ITC含量模型与试验拟合度良好、误差小;模型的校正系数RAdj2=0.972 9,表明此回归模型可以解释97.29%响应值变化,说明此法可靠、具有可行性。
通过软件分析得最佳提取条件为:超声时间16.08 min、超声功率63.46W、提取温度40.05℃、pH 6.23,在此条件下ITC提取量的预测值为0.905 6 mmol/L。基于工业化实际可操作性等因素考虑,将最佳提工艺条件调整为:超声时间16 min、超声功率63 W、提取温度40℃、pH 6.2,在此条件下进行3次平行试验,提取的ITC含量为0.895 mmol/L,与理论值相对误差为1.2%,说明试验结果与模型符合良好。
3.2.3 因子交互作用分析
应用Design-Expert 8.0.6软件分析因素交互作用响应面及等高线图(见图6~图11),通过该组动态图即可对任何两个因素交互影响提取西兰花副产品ITC含量的效应进行分析与评价。所拟合的响应曲面和等高线图能较直观地反映各因素间的交互作用对响应值的影响,其中等高线呈圆形说明两个因素交互作用不显著,等高线呈椭圆说明两个因素交互作用显著。

图6 pH值和超声功率交互作用影响ITC提取量的曲面图和等高线图Fig.6 Response surface and contour plots for the effect of variables on the extraction volume of ITC versus pH and ultrasonic power
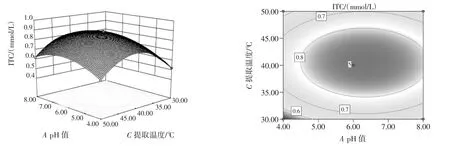
图7 pH值和提取温度交互作用影响ITC提取量的曲面图和等高线图Fig.7 Response surface and contour plots for the effect of variables on the extraction volume of ITC versus pH and extraction temperature
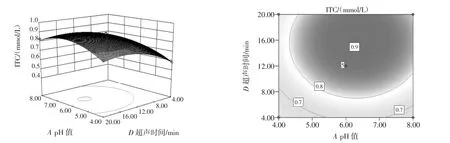
图8 pH值和超声时间交互作用影响ITC提取量的曲面图和等高线图Fig.8 Response surface and contour plots for the effect of variables on the extraction volume of ITC versus pH and ultrasonic treatment time
由图6~图11可以看出,每个响应曲面均为开口向下的凸形曲面,每个响应面都有极高值,出现在等高线的圆心处。其中pH值(A)和超声时间(D)的等高线图与圆形最接近,说明他们之间的交互作用对ITC含量提取的影响最小,其次是pH值(A)和超声温度(C)、pH值(A)和超声功率(B)。而等高线越扁平则表示两因素的交互作用越大,提取温度(C)和超声功率(B)的交互作用对ITC提取量的影响作用最大。

图9 提取温度和超声功率交互作用影响ITC提取量的曲面图和等高线图Fig.9 Response surface and contour plots for the effect of variables on the extraction volume of ITC versus ultrasonic power and extraction temperature
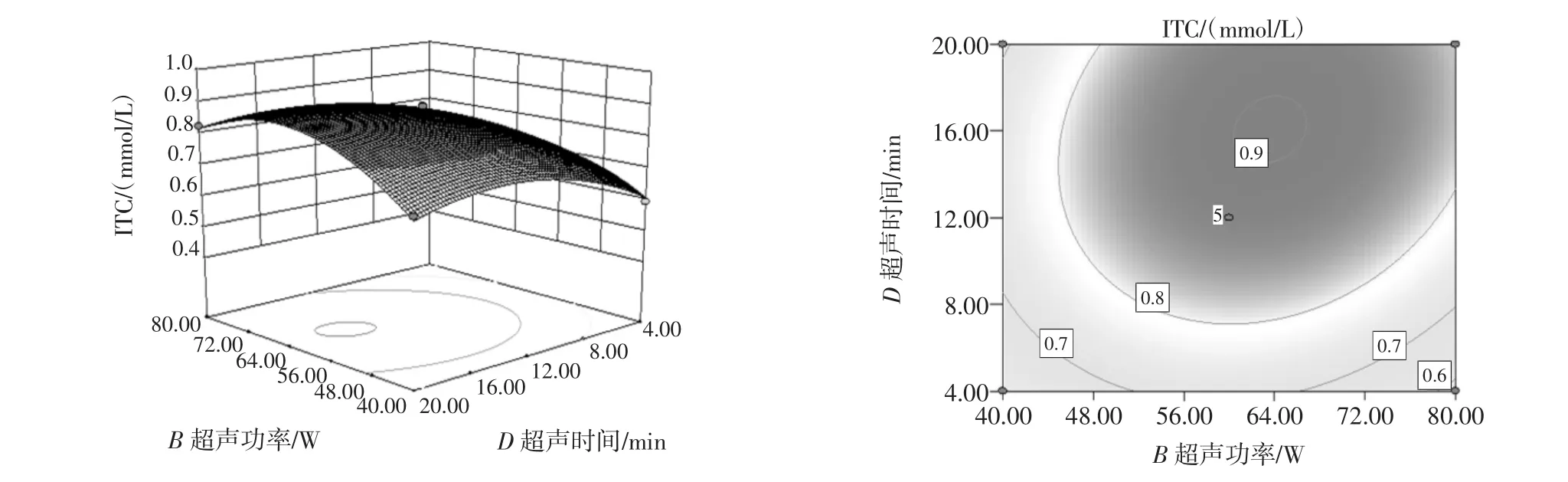
图10 提取温度和超声时间交互作用影响ITC提取量的曲面图和等高线图Fig.10 Response surface and contour plots for the effect of variables on the extraction volume of ITC versus extraction temperature and ultrasonic treatment time
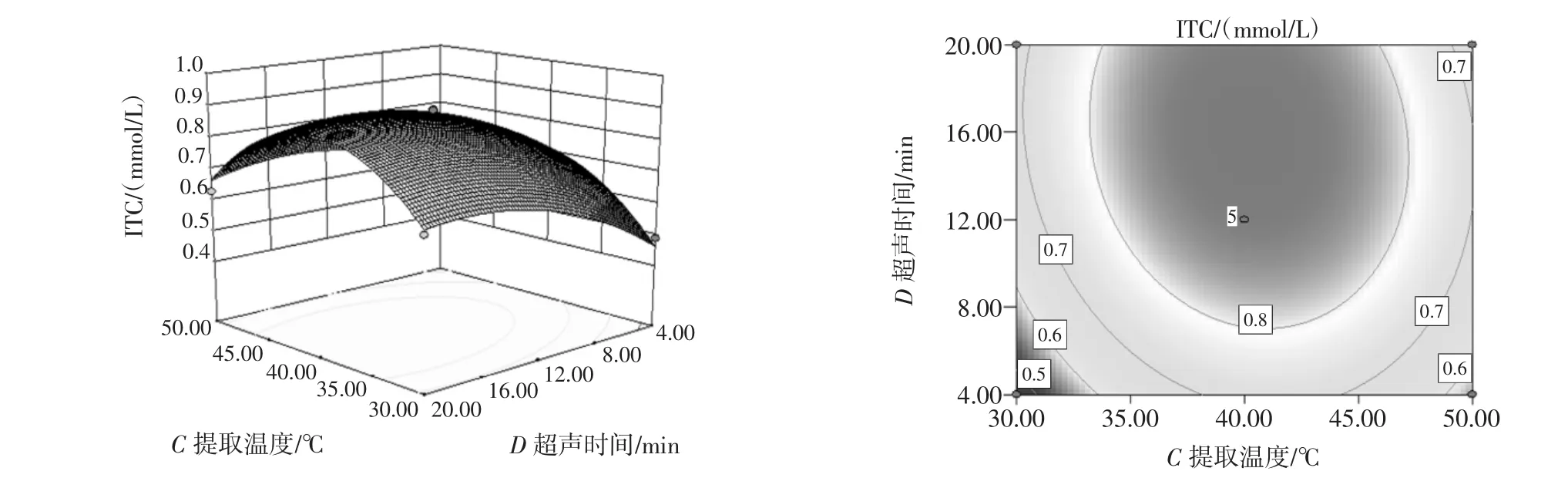
图11 提取温度和超声时间交互作用影响ITC提取量的曲面图和等高线图Fig.11 Response surface and contour plots for the effect of variables on the extraction volume of ITC versus ultrasonic power and ultrasonic treatment time
3.3 西兰花ITC抗氧化结果分析
西兰花ITC抗氧化能力分析见表4。

表4 ITC的抗氧化能力(当量mmol/L Trolox,n=3)Table 4 Antioxidants activities of ITC(mmol/L Trolox equivalent,n=3)
西兰花ITC抗氧化结果显示:西兰花ITC于100 mg/mL剂量对DPPH自由基的清除能力为0.623个Trolox当量(1 mmol/L Trolox的清除自由基的能力);清除ABTS+自由基的能力为0.463个Trolox当量;对铁离子的还原能力为0.573个Trolox当量。
4 结论
通过超声辅助提取西兰花副产物中的ITC,得出的最优工艺组合为:超声时间16 min、超声功率63 W、提取温度40℃、pH 6.2,在此条件下进行3次平行试验,提取的ITC含量为0.895 mmol/L,与理论值相对误差为1.2%,说明试验结果与模型符合良好。提取物ITC清除DPPH自由基的能力为0.623个Trolox当量、清除ABTS+自由基的能力为0.463个Trolox当量;对铁离子的还原能力为0.573个Trolox当量;表明该方法优化提取的ITC具有良好的抗氧化功能。