DCC与HER-2 mRNA在人胃癌组织的表达*
张 跃 翟 珂 李 蕊 王 鸿
(济宁市兖州区人民医院,济宁医学院附属医院兖州院区,济宁 272100)
胃癌是常见的恶性肿瘤之一,发病率居第4位、死亡率居第2位[1]。胃癌与遗传、体质等内在因素以及生活习惯等外界因素有关。现已明确与胃癌发生、发展关系密切的基因有癌基因人表皮生长因子受体2(HER-2)、抑癌基因结直肠癌缺失基因(deleted colorectal carcinoma,DCC)等。目前发现DCC基因是最长的抑癌基因,是一种信号传递受体[2]。目前研究表明,DCC基因在结直肠癌等组织表达明显减少或缺失[3],但在胃癌中的表达情况还未见报道。HER-2基因是表皮生长因子受体家族成员,在肿瘤发生、发展中起重要作用。胃的癌变是一个多因素、多步骤、多阶段发展过程,涉及癌基因、抑癌基因、凋亡相关基因等。本文研究了胃癌与癌旁正常组织中DCC及HER-2 mRNA的转录水平,并与患者临床及病理特征进行相关性分析。
1 资料与方法
1.1 一般资料
选取2016年1月至2016年6月期间于山东省肿瘤医院、济宁市兖州区人民医院胃肠外科经病理诊断确诊的胃癌患者,共52例。其中年龄为32~79岁;其中年龄≥60岁26例,<60岁26例;女18例,男34例。TNM分期参见《胃癌临床实践指南》(2013年 第2版):Ⅰ期12例、Ⅱ期6例、Ⅲ期22例、Ⅳ期12例。标本均取癌旁组织及癌组织,癌旁组织取距肿瘤边缘5cm以上,癌组织标本取自病灶中央且为非坏死组织。将标本置液氮中速冻后,迅速移入-80°C冰箱保存。
1.2 方法
1.2.1试剂 RNA提取试剂盒购自OMEGA公司;引物由上海生工生物工程股份有限公司合成;逆转录PCR试剂盒购自美国Promega 公司;Ex Taq酶及附带缓冲液、dNTPMix、Nuclease-Free Water、DL2000 DNA Marker、pMD19-T载体为宝生物工程(大连)有限公司产品。
1.2.2引物设计和合成 根据DCC及HER-2基因mRNA序列,利用软件Primer BLAST (NCBI)设计PCR引物如下:DCC mRNA上游引物 5’-CACTGCGCTTCCTCTCAGAA-3’,下游引物5’-CTGGCTTGTGGTGTCTGGAA-3’,扩增片段的长度为215bp;HER-2 mRNA上游引物序列为5’-GCCCTCATCCACCATAACAC-3’,下游引物序列为5’-TTCCTCCACGCACTCCTG-3’, 扩增片段的长度为234bp;内参甘油醛-3-磷酸脱氢酶(GAPDH)引物参考文献[4],上游引物5’-CCACCCATGGCAAATTCCATGGCA-3’,下游引物5’-TCTAGACGGCAGGTCAGGTCCAC-3’,扩增片段的长度为589bp。
1.2.3RT-PCR反应 提取标本总RNA,合成cDNA; PCR反应体系为10×Buffer 2.5μl,dNTP 2.0μl,上游引物0.5μl,下游引物0.5μl,ExTaq酶0.125μl,cDNA模板3μl,Nuclease-Free Water定容至25μl;PCR反应条件为95℃预变性 5min,DCC:(94℃ 30s,54℃ 30s,72℃ 90s)×32个循环,72℃终延伸10min;HER-2:(94℃ 30s,66℃ 30s,72℃ 45s)×32个循环,72℃终延伸10min。
1.2.4琼脂糖凝胶电泳 将PCR产物进行琼脂糖凝胶电泳,紫外透射反射仪观察目的条带,凝胶图像分析仪拍照分析。
1.3 DCC及HER-2 mRNA分析
1.3.1采用凝胶图像分析软件AlphaView-SA对图像进行分析处理 分别得到目的基因和GAPDH的积分密度值,扣除背景,得到净光密度值,然后按照下列公式分别计算目的基因 mRNA含量。目的基因 mRNA含量=(目的基因净光密度值)/ (GAPDH净光密度值)
1.3.2基因定性分析 表达阳性为目的基因扩增产物与Mark相对应位置出现一条亮带,反之为阴性表达。
1.4 统计学方法
采用SPSS20.0统计软件进行数据分析。
2 结果
2.1 目的基因扩增结果
由图所见,在215bp、234bp和589bp处各显示电泳条带,结果证实为DCC、HER和GAPDH基因。见图1、2。
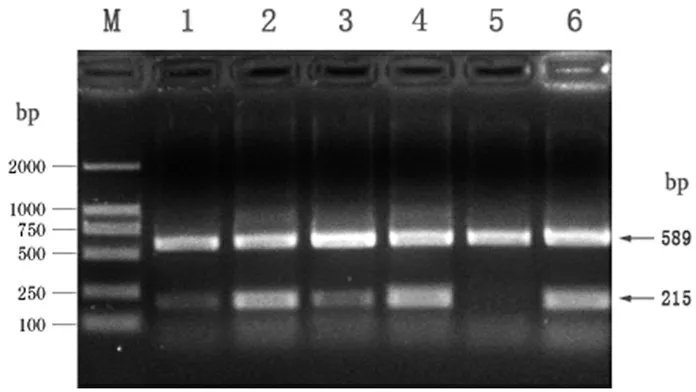
注:M,DL2000 DNA Marker;1,3,5:肿瘤组织; 2,4,6:癌旁组织
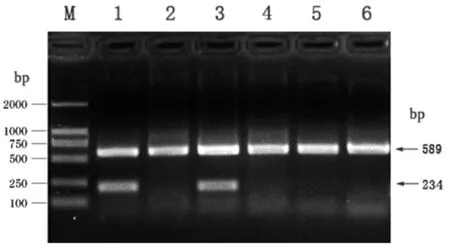
2.2 癌旁组织和胃癌组织DCC mRNA及HER-2 mRNA的表达
两者在胃癌及癌旁组织中表达差异有统计学意义(P<0.05)。见表1;DCC mRNA、HER-2 mRNA在胃癌组织转录水平分别为0.555±0.087、0.950±0.025。
2.3 胃癌组织中DCC mRNA与HER-2mRNA的转录水平与临床病理特征的关系
同一位患者以正常组织中DCC mRNA表达量为1,计算肿瘤组织中DCC mRNA相对表达量。详见表2。
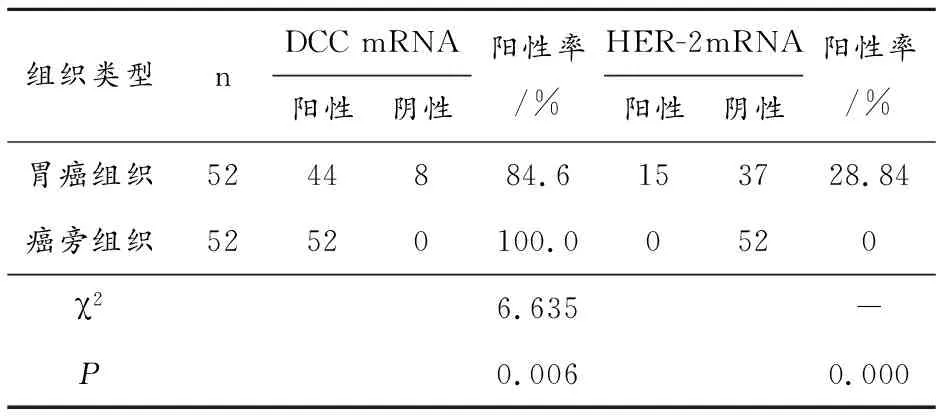
表1 胃癌组织及癌旁组织中DCC mRNA、HER-2 mRNA的表达比较
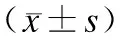
表2 胃癌组织中DCC mRNA及HER-2mRNA表达与临床病理特征的关系
3 讨论
Castets等[5]研究发现DCC蛋白可通过诱导癌细胞凋亡来抑制结、直肠恶性肿瘤的发展,从而起到预防和治疗癌症的效果。Melen等[6]研究表明,DCC蛋白在配体缺乏的环境中具有诱导细胞凋亡的作用,但在配体Netorin-1存在时,DCC蛋白则具有抗细胞凋亡作用。如果DCC基因缺失,不能编码DCC蛋白,细胞生长和分化发生障碍,细胞有可能发生恶变[7]。DCC基因在结、直肠肿瘤细胞中表达下调,其失活的主要机制是启动子甲基化和等位基因缺失[8]。有报道显示,在结、直肠肿瘤组织中用PCR直接扩增DCC基因某区域检测缺失率只有29%[9]。翟保平等[10]发现DCC基因在乳腺癌组织中的阳性表达率为38.2%,而在有淋巴结转移的乳腺癌组织中阳性表达率为23.3%,认为DCC基因表达下调与乳腺癌的发生和侵袭有关。本文结果显示52例胃癌患者中,DCC mRNA检出率在癌组织中为84.6%,正常组织中为100%,正常组织明显高于胃癌组织(P<0.05),与上述报道基本一致。说明胃癌的形成过程中出现了DCC基因表达缺失。
原癌基因HER-2通过基因扩增与过表达,通过一定的信号转导通路,影响细胞增殖、分化、凋亡,使得细胞增殖加速、恶性趋强,并有抗凋亡现象[11]。研究发现,在乳腺、胃、食管等恶性肿瘤组织中均检测出HER-2基因的过量表达。本文结果显示HER-2 mRNA在52例胃癌患者肿瘤组织检出率为28.8%,与上述报道基本一致。说明胃癌的形成过程中出现了HER-2基因过度表达,应用RT-PCR的检测方法提高了基因检测的阳性率,有望为胃癌的诊断提供依据。
DCC基因mRNA在淋巴结转移阳性的转录水平明显低于淋巴结转移阴性,HER-2基因mRNA在有淋巴结转移及浸润浆膜胃癌组织中的转录水平高于无淋巴结转移及浸润浆膜;结果提示HER-2基因mRNA的过表达与DCC基因mRNA的表达下调可能促进了胃癌细胞的浸润和转移。TNM分期的III期、Ⅳ期胃癌患者中DCC基因mRNA转录水平明显低于I期、II期患者 (P<0.005)。在低分化(未分化)胃癌患者DCC基因mRNA的转录水平明显低于高分化及中分化胃癌患者(P<0.05),而HER-2基因mRNA表达无相关性,提示随着肿瘤分化程度降低、分期越晚,DCC基因mRNA表达下调越明显。我们推测,HER-2的过表达与DCC mRNA表达下调是胃癌恶性程度增高的标志,但两者的相关性还有待进一步研究;同时,增强DCC基因在细胞中的表达,有可能成为胃癌基因治疗的措施之一。人源化的HER-2单克隆抗体已成功用于治疗晚期乳腺癌。因此,DCC及HER-2双基因联合检测在胃癌中的研究,可以为胃癌的基因治疗提供重要依据.

