Cu/CuO改性碳纳米管对亚甲基蓝的吸附特征
李德云,刘龙飞,李成亮*,吴科堰
(1.山东农业大学资源与环境学院,土肥资源高效利用国家工程实验室,山东 泰安 271018;2.贵州大学农学院,贵阳 550025)
随着工业不断发展,染料被广泛应用于许多行业,如纺织、皮革、造纸、塑料等[1-2]。染料废水成为水体的重要污染物,已造成一系列的环境污染问题。印染废水降低了水生植物的光合效率,影响水生生物的正常生长[3-4]。此外,染料还具有高毒性和潜在的致突变和致癌作用,直接威胁人和其他动物的安全[5-6]。因此,废水中染料的去除引起了人们的广泛关注。
目前处理染料废水的方法有生物降解[7]、电化学法[8]、氧化法[9]和吸附[10-11]等。其中吸附法具有效率高、成本低、操作简单并且对有毒物质不敏感等特点,是染料废水处理常用的一种技术[12]。碳纳米管具有比表面积大、孔隙率高、吸附容量大等特点,对水体多种有机和无机污染物质有很好的去除效果[13-16],在水体净化中有广泛的应用前景。通过改性能够提高碳纳米管的分散性,以及增加碳纳米管表面官能团含量[17],提高碳纳米管对污染物的吸附能力。目前已有研究者研究了磁性碳纳米管和NaClO改性碳纳米管对染料的吸附,研究结果表明改性后碳纳米管对染料的吸附量明显优于未改性碳纳米管[5,18-19]。
Cu是一种过渡金属,具有良好的电学和热学性能,近年来研究者们对Cu/CNTs复合材料进行了大量的研究,但多集中于Cu/CNTs复合材料的力学和电学性质[20-21],另外,Cu可以与有机物通过络合作用结合在一起,因此使用Cu对碳纳米管进行改性可能会提高碳纳米管对有机物的吸附作用。因此,本文研究了Cu/CuO改性碳纳米管(Cu/CuO-CNTs)与未改性碳纳米管(CNTs)对阳离子型染料亚甲基蓝的吸附行为,比较改性碳纳米管和未改性碳纳米管的对亚甲基蓝吸附量,并探究了环境因素,包括温度、pH、不同阳离子种类以及离子强度对吸附的影响。
1 材料与方法
1.1 实验仪器与试剂
恒温振荡培养器(SPH-200,上海世平实验设备有限公司),台式高速冷冻离心机(Allegra 64R,美国Beckman公司),pH计(PB-10,德国Sartorius公司),比表面积-孔径分析仪(ASAP2010,美国Micromeritics公司),超纯水系统(D24UV,美国Millipore公司),紫外-可见分光光度计(T6新世纪,北京普析通用仪器有限责任公司),元素分析仪(Vario EL cube,德国Ele⁃mentar公司),电感耦合等离子体质谱仪(iCAP Qc ICP-MS,美国Thermo Fisher Scientific公司)。
亚甲基蓝为分析纯,购自北京索莱宝科技有限公司;所选用的原始多壁碳纳米管购自深圳纳米港有限公司,管径:20~40 nm。
1.2 碳纳米管的改性
以乙酸铜作为Cu源,向500 mL去离子水中加入1.6 g乙酸铜,边搅拌边逐滴缓慢加入10 mL氨水(质量分数25%)。向上述溶液中加入1 g 80%(质量分数)硝酸处理后的碳纳米管浸泡17 h,离心后用真空干燥箱在70℃条件下干燥,得到中间产物。最后,在氮气保护条件下将中间产物置于500℃温度加热2 h[22]。
1.3 碳纳米管的表征
利用扫描电镜观察碳纳米管改性前后的表面形态,使用比表面积-孔径分析仪分析碳纳米管的孔径结构及分布,并使用XRD分析碳纳米管和纳米Cu的结构和晶型。
1.4 碳纳米管对亚甲基蓝吸附的批处理试验
1.4.1 吸附动力学试验
取24个离心管,称取碳纳米管10 mg置于离心管中,加入20 mL浓度为20 mg·L-1的亚甲基蓝溶液(背景溶液为0.01 mol·L-1NaCl溶液),25℃条件下在全温振荡培养器振荡,在反应时间5、15、30、45、60、90、120、240 min时分别取样,每次取3个离心管,离心取上清液,用紫外-可见分光光度计,在λmax=665 nm测量溶液中剩余的污染物浓度,计算碳纳米管对亚甲基蓝的吸附量。
1.4.2 等温吸附试验
称取碳纳米管10 mg于离心管中,加入20 mL浓度分别为10、20、30、40、50、60、80 mg·L-1的亚甲基蓝溶液,每组设三个重复,分别于25℃条件下振荡2 h,取样离心,用紫外-可见分光光度计测量溶液中剩余的亚甲基蓝浓度。
1.4.3 环境因素对吸附的影响试验
温度的影响:称取碳纳米管10 mg于离心管中,加入20 mL浓度分别为10~80 mol·L-1的亚甲基蓝溶液,分别于15、25、35℃条件下振荡2 h后测量溶液中剩余的亚甲基蓝浓度。
溶液pH的影响:称取碳纳米管10 mg置于离心管中,加入20 mL浓度为20 mg·L-1的亚甲基蓝溶液(背景溶液为0.01 mol·L-1NaCl溶液),用0.1 mol·L-1NaOH溶液和HCl溶液分别调节pH为3.13~10.77,25℃条件下振荡2 h后测量溶液中剩余的亚甲基蓝浓度。
离子强度的影响:称取碳纳米管10 mg于离心管中,加入20 mL浓度为20 mg·L-1的亚甲基蓝溶液,背景溶液分别为离子强度为10~200 mmol·L-1的NaCl溶液,振荡2 h后测量溶液中剩余的亚甲基蓝浓度。
2 结果与讨论
2.1 碳纳米管的表征
2.1.1 碳纳米管孔径分布及部分理化性质
与原始CNTs相比,改性后碳纳米管比表面积、微孔体积和微孔直径均降低(表1),主要由于碳纳米管表面的纳米Cu颗粒堵塞了碳纳米管的端口,致使内表面积减少、孔数量减少。从元素组成来看,经改性后碳纳米管中含有Cu元素,达到了材料整体质量的7.73%,此外改性后碳纳米管表面H和O元素的相对含量增加,表明改性后碳纳米管表面含H和O的官能团含量增加,如-COOH和-OH等。通过研究不同pH条件下两种碳纳米管的Zeta电位,表明在测定范围内CNTs的Zeta电位一直为负值,Cu/CuO-CNTs的零电位点为7.2,表明原始碳纳米管经改性后表面电位有一定程度的升高。
2.1.2 X射线衍射分析
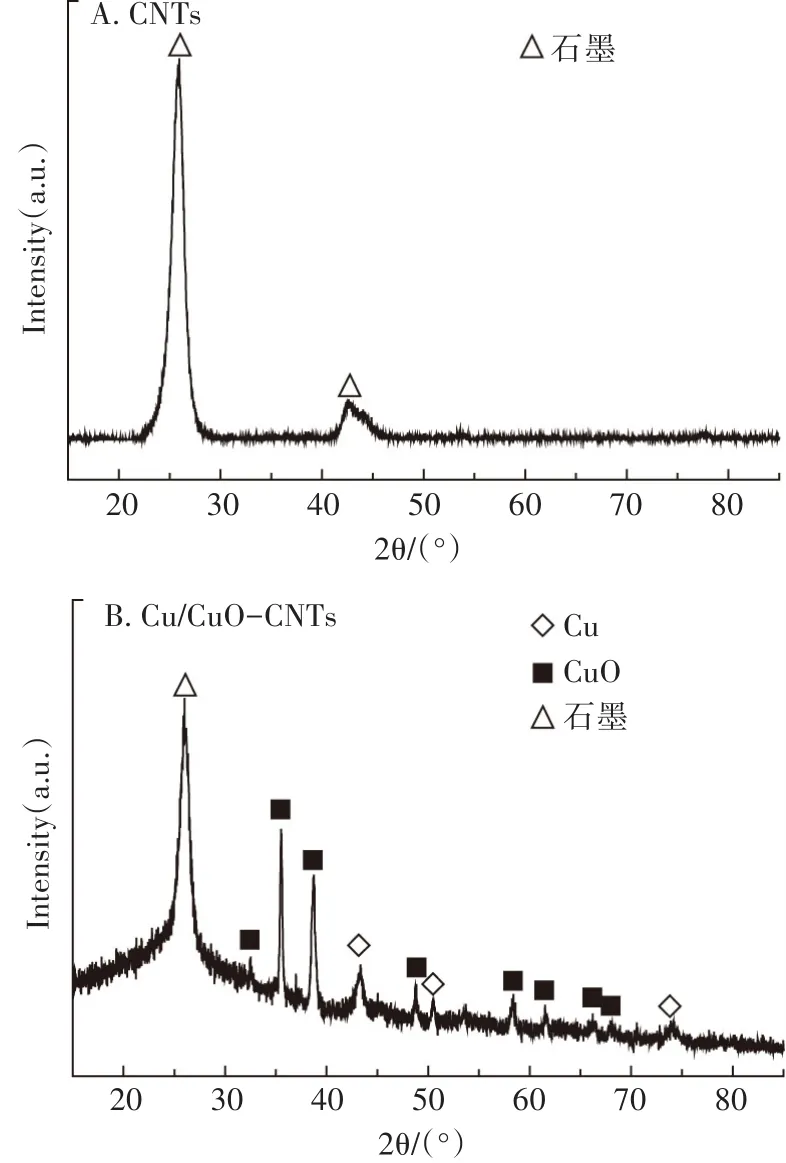
图1 Cu/CuO-CNTs和CNTs的XRD图谱Figure 1 XRD patterns of the Cu/CuO-CNTs and CNTs
对Cu/CuO-CNTs和CNTs进行了X射线衍射分析(图1),发现改性前后碳纳米管表面均出现了石墨的特征峰(2θ=26.1°),图 1B XRD 图谱中,43.33°、50.45°、74.07°分别对应了单质铜的(111)、(200)、(220)特征峰(JCPDS card no.03-1005);在 32.58°、35.52°、38.73°、48.73°、53.50°、58.27°、61.60°、68.09°分别对应了氧化铜(110)、(11-1)、(111)、(20-2)、(020)、(202)、(11-3)、(220)的特征峰(JCPDS card no.48-1548),表明改性后碳纳米管表面负载了金属Cu及其氧化物(纳米Cu的表面在空气中易被氧化)。
2.1.3 透射电镜分析
碳纳米管改性前后的透射电镜(TEM)结果如图2所示,在图2A中由快速傅里叶变换得知CNTs的晶面间距为3.55 Å,与石墨的(002)晶面相一致;图2B中,Cu/CuO-CNTs中测得的晶面间距2.09、2.52 Å,分别对应了纳米Cu(111)、纳米CuO(11-1)晶面,和XRD的测定结果相符。
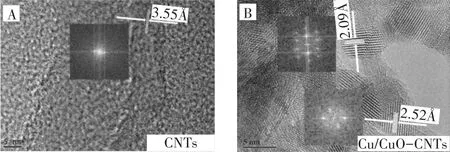
图2 Cu/CuO-CNTs和CNTs的透射电镜图Figure 2 TEM images of Cu/CuO-CNTs and CNTs
2.2 CNTs和Cu/CuO-CNTs对亚甲基蓝的吸附
2.2.1 吸附动力学
CNTs和Cu/CuO-CNTs对亚甲基蓝的吸附动力学结果如图3所示。在吸附初期,吸附过程基本呈线性变化,而后吸附速率减缓,直至达到吸附平衡,平衡时间为2 h左右。这种现象主要是由于在吸附初期,污染物主要占据碳纳米管表面的吸附位点,吸附速率较快,随着表面吸附接近饱和,吸附速率减缓;而后亚甲基蓝分子在碳纳米管内部扩散,吸附速率缓慢,直至达到吸附平衡。
分别用准一级动力学模型(式1)和准二级动力学模型(式2)对动力学数据进行拟合,来探讨改性碳纳米管对亚甲基蓝的吸附机理。

表1 碳纳米管的部分理化性质Table 1 Part of physical and chemistry properties of carbon nanotubes
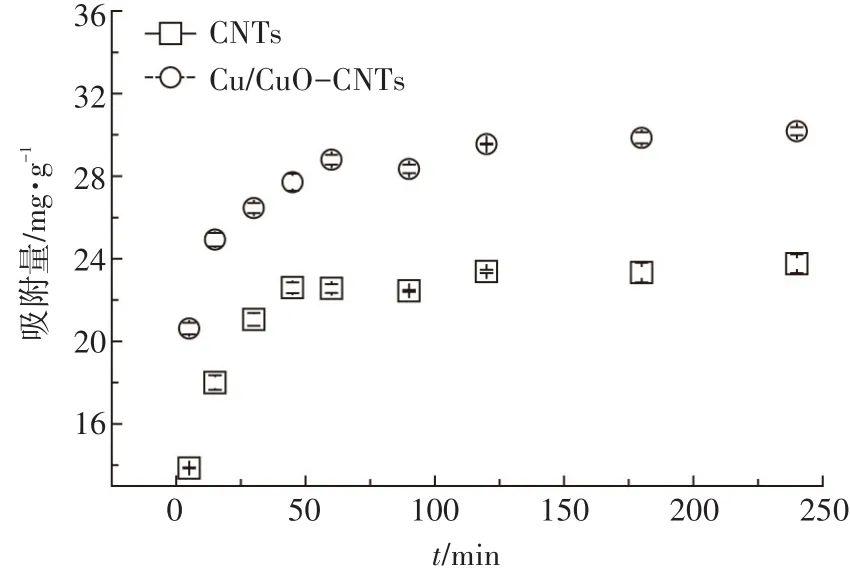
图3 CNTs和Cu/CuO-CNTs对亚甲基蓝的吸附动力学Figure 3 Adsorption kinetics of MB on Cu/CuO-CNTs and CNTs

式中:qt为在 t时刻亚甲基蓝的吸附量,mg·g-1;qe为吸附平衡时亚甲基蓝的吸附量,mg·g-1;t为时间,min;ka为准一级动力学方程的表观速率常数,min-1。

式中:kb为准二级动力学方程的表观速率常数,g·mg-1·h-1。
拟合曲线见图4,拟合参数见表2。由拟合结果可知,CNTs和Cu/CuO-CNTs对亚甲基蓝吸附的准一级方程拟合相关系数R2分别为0.415 6和0.741 7,准二级方程R2为0.997 7和0.999 8,同时准二级动力学模型计算出的平衡吸附量qe,cal与实际吸附量qe,exp更相近。因此,改性前后碳纳米管对亚甲基蓝的吸附更适合用准二级动力学方程拟合。改性后碳纳米管的比表面积、微孔体积和微孔直径等均降低,但是改性后碳纳米管对亚甲基蓝的吸附量增大。物理吸附是由吸附质和吸附剂分子间作用力(范德华力)所引起,而化学吸附主要是吸附质分子与固体表面原子(或分子)发生电子的转移、交换或共有,形成吸附化学键的吸附。因此比表面积、微孔体积和微孔直径主要影响改性后碳纳米管对亚甲基蓝的物理吸附,所以化学吸附是影响Cu/CuO-CNTs吸附亚甲基蓝的一个重要影响因素。
2.2.2 吸附剂对亚甲基蓝的等温吸附曲线
在供试浓度范围内CNTs和Cu/CuO-CNTs对亚甲基蓝的平衡吸附量随平衡浓度的增加而增大(图5),这是由于浓度梯度的驱动力增大,在相同条件下,溶液中亚甲基蓝浓度越大,碳纳米管表面越多的活性位点被占据,因此平衡吸附量随着平衡浓度的增大而增大。其中Cu/CuO-CNTs对亚甲基蓝的吸附量高于CNTs对亚甲基蓝的吸附,可能是因为改性后碳纳米管表面官能团数量增加(表1),提高了碳纳米管与亚甲基蓝之间的π-π相互作用和静电相互作用,促进了碳纳米管对亚甲基蓝的吸附。另外,由于Cu可以通过与羧基、羰基、氨基等官能团的相互作用与有机物发生络合[24],因此碳纳米管表面负载的Cu可能与亚甲基蓝发生络合反应,促进碳纳米管对亚甲基蓝的吸附。
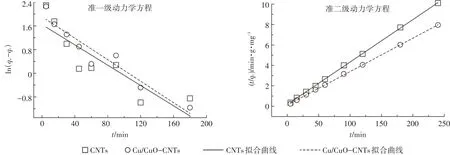
图4 准一级、准二级模型拟合吸附动力曲线Figure 4 Fitting of sorption kinetics of MB on CNTs and Cu/CuO-CNTs
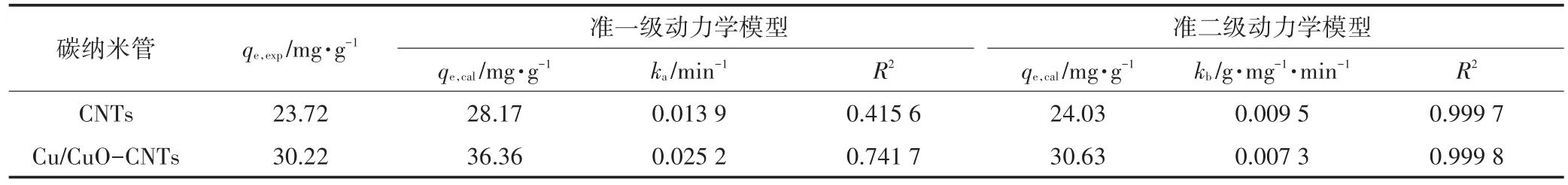
表2 CNTs和Cu/CuO-CNTs对亚甲基蓝吸附的动力学模型参数Table 2 Parameters describing the PFO and PSO rate equation of sorption kinetics of MB
对等温吸附数据用Langmuir(式3)和Freundlich(式4)模型进行拟合。

式中:qe和qm分别是平衡吸附量和最大吸附量,mg·g-1;Ce是平衡浓度,mg·L-1;KL是 Langmuir平衡常数,L·mg-1。

式中:KF是 Freundlich吸附平衡常数,mg(1-1/n)·L1/n·g-1;n是一个无量纲值。
拟合相关参数见表3,Freundlich模型在对CNTs和Cu/CuO-CNTs对亚甲基蓝的吸附等温线拟合的相关系数比Langmuir模型拟合的相关系数要高,表明亚甲基蓝的吸附更符合Freundlich模型的吸附假设。1/n表示位能非线性或者不均匀因子,用来表征偏离线性吸附的程度,当1/n=1时,为线性分配等温线;1/n小于1时,为非线性吸附等温线。从表中由拟合度较Freundlich模型可以看出两种碳纳米管的1/n值均小于1,表明两种碳纳米管对亚甲基蓝的吸附为非线性等温吸附。

图5 CNTs和Cu/CuO-CNTs对亚甲基蓝的吸附等温线Figure 5 Adsorption isotherm of MB on Cu/CuO-CNTs and CNTs
2.3 环境因素对Cu/CuO-CNTs和CNTs吸附亚甲基蓝的影响
2.3.1 温度对吸附的影响
Cu/CuO-CNTs和CNTs对亚甲基蓝的吸附均随温度的升高而降低(图6),与Tabrizi等[25]和Fan等[26]研究亚甲基蓝的吸附去除结果相同,表明两种碳纳米管对亚甲基蓝的吸附均为放热反应。由于Cu/CuO-CNTs对亚甲基蓝的吸附主要包括放热的化学吸附过程,如改性后引入的羟基、羧基等官能团与亚甲基蓝之间的疏水性相互作用、静电相互作用和Cu与亚甲基蓝之间的络合作用,所以Cu/CuO-CNTs对亚甲基蓝的吸附为放热反应。
2.3.2 pH对吸附的影响

图6 温度对亚甲基蓝在CNTs和Cu/CuO-CNTs上吸附的影响Figure 6 Effect of temperature on the adsorption of MB on CNTs and Cu/CuO-CNTs

表3 CNTs和Cu/CuO-CNTs对亚甲基蓝的Langmuir和Freundlich等温吸附方程拟合参数Table 3 Simulated parameters of MB sorption isotherm by Langmuir and Freundlich models
溶液初始pH是影响吸附过程的一个重要因素,溶液pH能改变吸附剂的表面电荷以及污染物的存在状态[15],最终影响吸附剂对污染物的吸附效果。不同pH条件下CNTs和Cu/CuO-CNTs对亚甲基蓝的吸附结果如图7所示,CNTs和Cu/CuO-CNTs对亚甲基蓝的吸附量随着溶液初始pH的增加不断增大,常春等[27]在研究亚甲基蓝在生物炭上的吸附得出了相同结论,Pang等[28]在研究石墨烯对亚甲基蓝的吸附时也得到了类似结论。主要因为在酸性条件下,溶液中存在大量的H+,与带正电荷的阳离子型染料亚甲基蓝竞争吸附剂表面的活性位点[29],同时pH较低时,大量的H+使阳离子染料中的氨基质子化成NH+3,碳纳米管表面的官能团也发生质子化,与亚甲基蓝之间的静电斥力不利于亚甲基蓝在碳纳米管上的吸附[30]。另外,亚甲基蓝分子结构中存在苯环,碳纳米管中含有碳碳双键和碳碳三键,所以亚甲基蓝可以通过π-π相互作用被碳纳米管吸附。随着pH的增大,碳纳米管表面的负电荷增多,碳纳米管与亚甲基蓝静电相互作用增强,导致碳纳米管对亚甲基蓝的吸附量增大。Cu/CuO-CNTs在低pH时对亚甲基蓝的吸附量影响较小,在pH大于等电点pH时,吸附受pH影响较大,表明静电相互作用是影响Cu/CuO-CNTs吸附亚甲基蓝的一个重要影响因素[31]。

图7 pH对亚甲基蓝在CNTs和Cu/CuO-CNTs上吸附的影响Figure 7 Effect of pH on the adsorption of MB on CNTs and Cu/CuO-CNTs
2.3.3 离子强度对吸附的影响
Cu/CuO-CNTs对亚甲基蓝的吸附受离子强度的影响较小,而CNTs对亚甲基蓝的吸附随离子强度的增大而增大(图8),主要是因为溶液中引入具有强烈水化作用的Na+,使本来被吸引在染料极性基团周围的水分子数目减少,使得染料的亲水性降低,而疏水性则相对增强,染料更倾向于通过疏水作用被吸附在碳纳米管表面[32]。此外,离子强度的增大会导致染料分子的聚集,因此碳纳米管对染料的吸附增大[33]。而Cu/CuO-CNTs表面的纳米CuO会溶出一部分Cu2+进入溶液中[34],本身会增加碳纳米管对亚甲基蓝的疏水作用,所以离子强度对Cu/CuO-CNTs吸附亚甲基蓝的影响较小。

图8 离子强度对CNTs和Cu/CuO-CNTs吸附亚甲基蓝的影响Figure 8 Effect of ionic strength on the adsorption of MB on CNTs and Cu/CuO-CNTs
3 结论
(1)改性后Cu/CuO-CNTs表面负载了纳米Cu、CuO颗粒,并且引入了大量含氧基团,等电点明显提高。
(2)吸附动力学符合准二级动力学模型,在2 h左右达到吸附平衡。吸附等温线符合Freundlich模型,Cu/CuO-CNTs对亚甲基蓝的吸附量明显高于CNTs。
(3)Cu/CuO-CNTs和CNTs对亚甲基蓝的吸附量均随温度的增大而降低,表明吸附反应为放热反应;吸附量随pH的增大而增大,随离子强度的增大而增大,但Cu/CuO-CNTs对亚甲基蓝的吸附受离子强度影响相对较小。

