基于物种敏感性分布法预测芘对白菜毒害的生态风险阈值
杨肖松,刘月仙*,解小凡,张 萌,王 伟
(1.中国科学院大学资源环境学院,北京 100049;2.中国矿业大学化学与环境工程学院,北京 100083;3.农业部环境保护科研监测所,天津 300191)
多 环 芳 烃(Polycyclic aromatic hydrocarbons,PAHs)是指两个或两个以上的苯环稠合在一起的一类化合物,主要由碳氢化合物经过不完全燃烧产生,大多数PAHs具有致毒、致癌和致突变的作用[1]。PAHs主要通过叶片和根皮层进入植物体内[2],在植物体内迁移、代谢、积累,抑制植物种子萌发[3]、破坏植株体内的抗氧化系统以及降低光合作用[4],进而影响植物的生长。多环芳烃也可通过食物链传递进入人体内,给人体健康带来严重的危害。多环芳烃的致毒机理主要是PAHs胁迫使植物体内活性氧增加[5],产生大量自由基[6],导致细胞产生大量的活性氧簇(Reac⁃tive oxygen species,ROS)[7]。与低分子量 PAHs(≤3 个苯环)相比,高分子量PAHs(≥4个苯环)更难被降解而在土壤环境中长期存在[8],对植物产生的毒害作用更大[9]。芘是带有4个苯环结构的PAHs,是高分子量PAHs的典型代表,与PAHs总量有着良好的相关性[10]。对高环多环芳烃芘进行毒害风险评估,建立土壤芘对植物毒性的生态风险阈值,将为土壤环境污染基准的构建提供一定的科学依据。
物种敏感性分布法(Species sensitivity distribu⁃tion,SSD)是目前国际上制定相关环境标准的主要方法[11]。该方法是基于不同物种对同一污染物敏感性的差异,以多个有代表性敏感物种的急性或慢性毒性数据(EC10、EC50)为基础,构建统计分布模型来评估环境浓度下污染物对生态系统的风险,从而获得保护95%的物种不受影响情况下所允许的最大环境有害浓 度(HC5,Hazardours concentration for 5%of spe⁃cies)[12]。Silva等[13]运用SSD法评价土壤有机污染物三丁基锡对陆生生态系统的生态风险,得到土壤中的HC5为2.06 mg·kg-1。张晓惠等[14]基于SSD法开展了持久性8类污染物水生态风险阈值的研究,发现水生生物对不同化学物质的敏感度差异较大。然而,国内尚未发现运用SSD法推导土壤多环芳烃生态风险阈值的相关研究。
白菜是我国栽培面积最大的蔬菜,年种植面积267万hm2左右,占全国蔬菜作物总种植面积的15%,占全国蔬菜总产量的18.8%[15]。因此研究土壤芘对白菜的毒性阈值具有重要的经济意义。本文通过土培试验,以华北地区11个常见的白菜品种为试验对象,研究不同品种白菜在典型多环芳烃芘胁迫下的生长响应特征,建立剂量-效应关系,运用物种敏感性分布法推导出基于保护95%白菜品种的生态风险阈值,为我国蔬菜多环芳烃污染防治以及土壤限量标准提供一定的参考依据。
1 材料与方法
1.1 供试材料
供试白菜为我国华北地区11个不同白菜品种:京翠60(JC-60),京秋65(JQ-65),京春娃2号(JCW-2),京春白(JCB),京翠70(JC-70),京春绿(JCL),北京桔红二号(JH-2)7个品种种子购自北京市农林科学院京研益农种业科技有限公司;中白50(ZB-50),吉红308(JH-308),菊心(JX),快菜1号(KC-1)4个品种种子购自中国农业科学院蔬菜花卉研究所。
供试土壤采自北京怀柔区中国科学院大学校区附近,风干后拣去枯枝石砾过3 mm筛,保存于阴凉处。
芘(GC,>95%)购自上海阿拉丁生化股份有限公司。
1.2 试验设计
1.2.1 白菜生长预试验
称取50 g土壤于直径为90 mm玻璃培养皿中,芘浓度配制参照孙铁珩等[16]推荐方法,配制完成后置于通风橱中,待丙酮挥发至干。然后每皿放置15粒饱满种子,置于25℃恒温培养箱中培养。当空白对照发芽率达到65%,根的长度达到2 cm,试验结束。通过芘浓度与根伸长的回归方程y=7.241x0.314(R2=0.939 8),拟合剂量-效应曲线求得EC10与EC50,得出EC10=2.83 mg·kg-1,EC50=470.46 mg·kg-1。
1.2.2 土壤染毒试验
正式染毒试验芘的浓度参照孙铁珩等[16]推荐的方法,要求至少设置5个不同的处理浓度(除对照外),范围应在预试验所求的EC10与EC50之间。本研究正式染毒试验芘的添加浓度分别为0(对照)、5、15、45、135、405 mg·kg-16个处理水平。具体配制方法:称取35 g芘于螺口瓶中,加入适量丙酮使其溶解后加入到10 kg土壤中,配制成芘浓度为3500 mg·kg-1的污染土壤,放入通风橱内过夜,待丙酮完全挥发后,搅拌混匀,保存于-20℃冰箱中备用。将该芘浓度的土壤用未污染土壤进行不断稀释,搅拌均匀,最后配制成试验所需的不同处理浓度。分别称取不同芘浓度土壤7 kg于上口直径为227 mm、下口直径为207 mm、高为180 mm的花盆中,浇水保持土壤湿润平衡一周。为保证白菜正常生长,每盆添加肥料KCl 0.32 g、KH2PO43.07 g、CO(NH2)22.24 g。平衡一周后,各个处理土壤中芘实际浓度见表1,空白对照土壤中芘有检出,但芘在土壤中<0.4 mg·kg-1时,可忽略不计[17]。其余处理芘实际浓度较添加浓度均有一定降低。
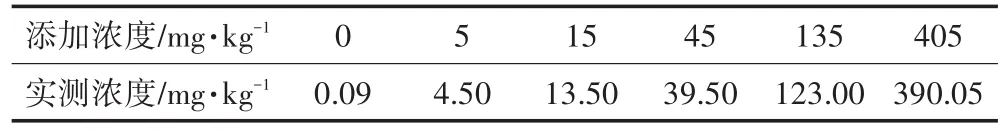
表1 供试土壤平衡一周后芘实际浓度Table 1 The concentration of pyrene in experimental soil after one week
1.2.3 白菜培养试验
白菜种子经75%酒精浸泡5 min,用蒸馏水洗净后再浸泡于55℃水中,并且不断搅拌。每盆播种15粒白菜种子,待白菜长出四片真叶后间苗,每盆留1株幼苗,每个品种重复3次。待白菜成熟时,分别采集土壤和植株样品,立即保存于-20℃冰箱中,共历时80 d。
1.3 试验方法
1.3.1 生物量(鲜质量计)测定
本试验以鲜质量来表示白菜生物量。白菜植株收获后,先用自来水冲洗植株,然后用去离子水冲洗,最后用天平称取植株质量。
1.3.2 土壤芘测定
土壤样品前处理及测定条件:土壤样品冷冻干燥,研磨过80目筛后保存于-20℃冰箱中。取2 g上述制备的土壤样品于25 mL玻璃离心管中,加入10 mL二氯甲烷,盖紧后超声萃取1 h;恒温振荡30 min,以4000 r·min-1离心10 min。取1 mL上清液过佛罗里硅土小柱净化,用10 mL二氯甲烷∶正己烷=1∶1混合溶液洗脱,氮吹至干,用二氯甲烷定容至2 mL,GC-MS测定。
气相条件:30 m×0.25 mm×0.25 μm TG-1MS色谱柱,载气He,进样口温度280℃,不分流进样,初始温度40℃,保持1 min,以30℃·min-1速度升温至150℃,接着以10℃·min-1速度升温至290℃,并在此温度下保持20 min。
质谱条件:EI电子源70 eV,离子源温度280℃,传输线温度280℃,扫描方式SIM[18]。
1.3.3 剂量-效应曲线拟合
土壤中芘植物毒性剂量-效应曲线采用Log-lo⁃gistic分布模型进行拟合[19]。该模型拟合参数均与实际生物效应有关,被广泛应用于剂量-效应曲线拟合[20]。

式中:Y为各个处理水平的白菜鲜质量与对照鲜质量比值,%;a、b为拟合参数,a反映了对照和低剂量之间的毒性效应,b为曲线的斜率,b值越大说明随着毒害剂量增加生物反应率迅速增加;X为土壤中芘实测浓度,mg·kg-1;M为效应浓度(ECx)的自然对数值。
当低剂量芘对白菜生长产生刺激效应时,上述模型不能够很好地拟合实验数据,因此采用Brain-Cousens模型[21],拟合方程如下:
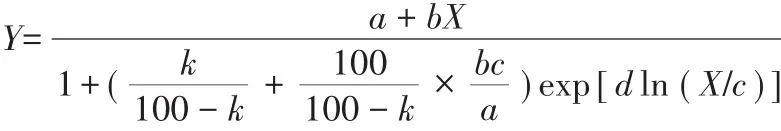
式中:Y为各个处理水平的白菜鲜质量与对照鲜质量比值,%;X为土壤中芘实测浓度,mg·kg-1;a、b、c、d为方程参数,a表征反应率上限和下限值之差,b表征低剂量区间效应增加趋势,d为ECx的变化率。当k为10、50时,参数c定义为EC10及EC50。
1.3.4 物种敏感性分布曲线拟合
物种敏感性分布曲线采用USEPA开发的SSDGenerater V1软件进行拟合[22],该软件利用的是logprobit模型。目前,用于进行SSD分析的函数模型很多,如 Log-logistic、Log-normal、Gompertz、Weibull和指数函数等。到目前为止,还未发现一个特定的分布模型是适合所有的毒性数据集的拟合。郑师梅等对SSD法利用评估模型ETX2.0、BurrliOZ2.0、SSD Gener⁃ator V1开展苯系物淡水水质基准推荐值的比较研究发现,不同方法推导出的基准值没有数量级的差异,但使用的模型不同,拟合出的曲线不同,得出的基准值也不尽相同。目前还没有一种适合所有毒性数据的模型,因此很难去界定模型的优劣。相对而言,SSD Generator V1与其他两种评估模型相比,在计算的时候可直接给出拟合度,能够给出模型拟合程度的直接评判[23]。
1.4 数据处理及分析
采用Excel 2007、SPSS 19.0进行数据处理方差分析,利用1stopt软件进行模型参数估计,Origin 2017进行方程拟合及图形绘制。
2 结果与分析
2.1 不同品种白菜土壤芘含量的变化
从表2可以看出,不同品种白菜土壤芘残留量差别较大。在芘处理浓度为5 mg·kg-1条件下,种植不同白菜品种土壤芘浓度在0.41~1.89 mg·kg-1之间变化,相差3.61倍。其中JH-2品种芘残留浓度最大为1.89 mg·kg-1,JC-70、JX品种芘残留浓度最小,均为 0.41 mg·kg-1;在芘处理浓度为15 mg·kg-1时,JH-2品种芘残留浓度最大为5.34 mg·kg-1,JC-70品种芘残留浓度最小为1.27 mg·kg-1;同样在芘处理浓度为45 mg·kg-1和405 mg·kg-1时,JH-2品种的土壤中芘残留浓度均达到最大值,分别为 14.85 mg·kg-1和189.72 mg·kg-1,品种JX、KC-1土壤芘残留浓度最小,分别为4.82 mg·kg-1和 114.14 mg·kg-1;在芘处理浓度为 135 mg·kg-1时,芘残留浓度最大和最小的品种分别为JC-60(66.83 mg·kg-1)和KC-1(31.27 mg·kg-1)。可见,在添加相同浓度芘条件下种植不同白菜品种,土壤中芘残留量存在较大差别,可能是芘对不同白菜品种的毒性不一样,也可能与白菜对多环芳烃的抗逆性有关。
2.2 土壤多环芳烃芘对白菜生物量(鲜质量)的影响
从图1可以看出,随着土壤中外源芘的浓度增加,不同品种白菜的生物量(鲜质量)呈现出不同的变化趋势。本实验结果表明,JCW-2、JCB、JC-70、JCL、JH-2、ZB-50、JH-308、JX、KC-1 9个品种随着芘的添加浓度增加呈现出先升高后降低的趋势,而JC-60和JQ-65生物量(鲜质量)随着芘处理浓度的增加逐渐降低,呈现抑制效果。在芘处理浓度为5 mg·kg-1时,JC-60、JCB和JX 3个品种的鲜质量跟对照相比有着显著性差异(P<0.05),其中JC-60生物量跟对照相比有显著降低,其余白菜品种在芘处理浓度为5 mg·kg-1时与对照相比无显著性差异(P>0.05)。JCW-2、JC-70和JH-308 3个品种白菜在外源芘添加量为15 mg·kg-1时生物量达到最大值,相比对照分别增加了21.11%、16.11%和20.43%。JCL、JH-2、JX、ZB-50和KC-1品种在芘处理浓度为45 mg·kg-1时生物量达到最大值,且与对照相比有显著差异。当土壤中芘添加浓度达到405 mg·kg-1时,9个不同品种的白菜生长(鲜质量)产生显著的抑制效应(P<0.05),抑制率分别为59.25%、47.95%、75.84%、29.34%、44.16%、19.50%、40.77%、25.12%、46.45%。
2.3 基于白菜生物量(鲜质量)测试终点的芘毒性剂量-效应曲线
通过Log-logsitic模型以及Brain-Cousens模型对土壤中芘植物毒性的剂量-效应关系进行拟合,得出不同条件下芘对白菜毒性的剂量阈值(EC10、EC50)。从图2可以看出除品种JC-60和JQ-65随着多环芳烃芘的增加呈现抑制效应外,其余白菜品种生物量随着芘的浓度增加呈现先升高后降低的趋势。从表3可以看出多环芳烃芘对不同白菜EC10变化范围为4.14~52.76 mg·kg-1。其中 JQ-65 品种 EC10值最小为4.14 mg·kg-1,ZB-50 品种 EC10值最大为 52.76 mg·kg-1,相差11.74倍。多环芳烃芘对11种白菜毒性阈值EC50变化范围为28.35~545.11 mg·kg-1,从大到小的顺序依次是 JH-308>JH-2>JC-70>JCB>ZB-50>JX>JC-60>JCL>JQ-65>KC-1>JCW-2,最大值和最小值相差18.23倍。
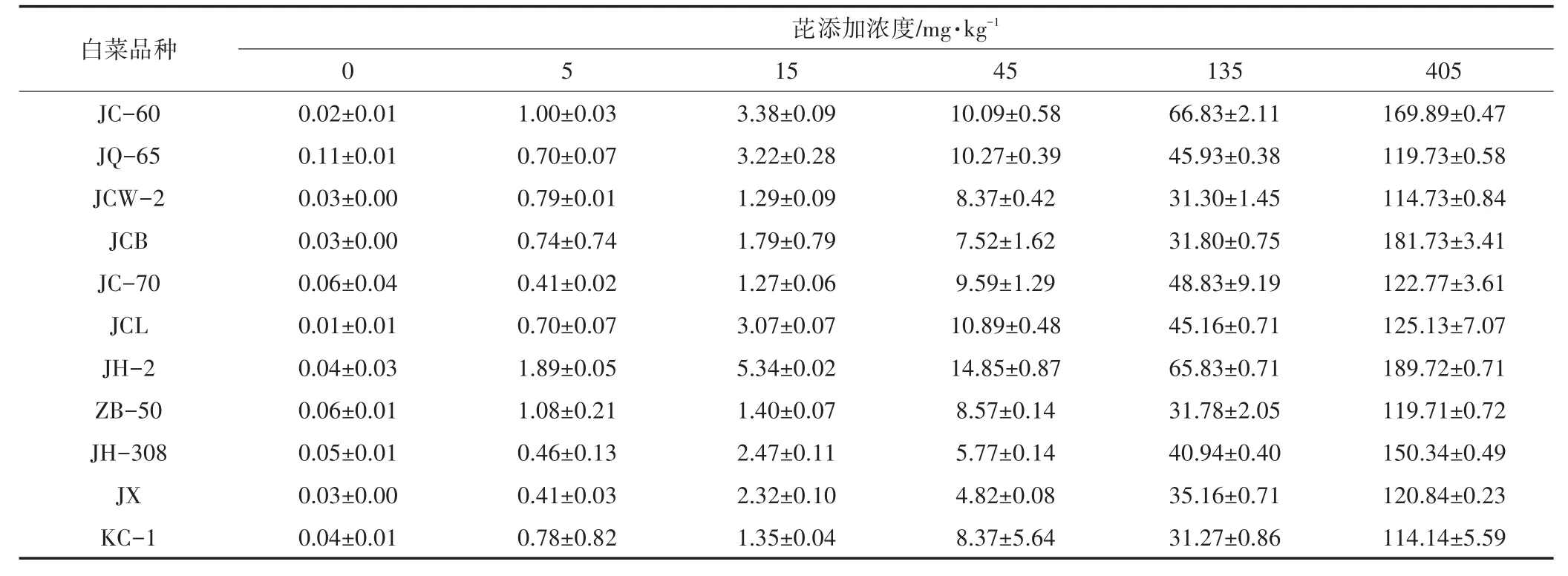
表2 种植不同品种白菜的土壤中芘残留浓度(mg·kg-1)Table 2 The residual concentration of pyrene in soil after planting different varieties of Chinese cabbage(mg·kg-1)
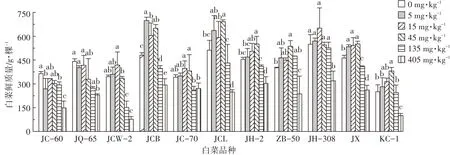
图1 多环芳烃芘添加对白菜生物量(鲜质量)的影响Figure 1 The effect of pyrene on the biomass(fresh weight)of various cabbage
2.4 基于毒性阈值(EC10、EC50)的白菜物种敏感性分布及HC5值预测
构建单一污染物SSD曲线模型的方法主要包括基于确定概率的参数模型法和基于抽样分布的非参数模型法。本文利用USEPA推荐物种敏感性分布软件SSD-GeneraterV1对不同品种白菜芘的毒性阈值(EC10、EC50)进行拟合,得到SSD曲线(图3)。从SSD曲线可以看出,不同的白菜品种在芘的胁迫下表现出不同敏感性,品种ZB-50对芘的胁迫表现出较强的抗性,而JCW-2、JQ-65、JC-60对芘较为敏感。基于毒性阈值EC50的SSD曲线不同白菜对芘的物种敏感性顺序分别为JC-60>JCW-2>JQ-65>JH-308>JX>JCB>JH-2>JCL>JC-70>KC-1>ZB-50,而基于EC10敏感性顺序为JQ-65>JC-60>JCW-2>JH-308>JX>JCL>JCB>JC-70>KC-1>JH-2>ZB-50,品种JQ-65分布频次略有降低,JH-2分布频次略有升高。
通过物种敏感性分布模型拟合及计算(表4),得到基于保护95%白菜品种的EC10值HC510%为4.52 mg·kg-1,置信区间为 2.02~10.04,EC50值 HC550%为37.68 mg·kg-1,置信区间为24.99~56.79。
3 讨论
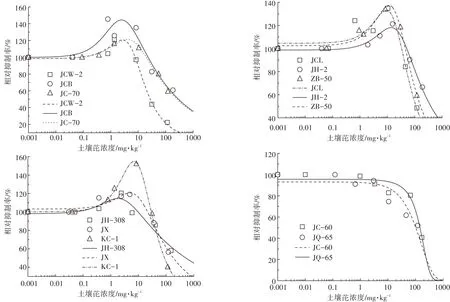
图2 不同品种白菜芘胁迫下的剂量-效应关系曲线Figure 2 Dose-response curves of pyrene to Chinese cabbage cultivars
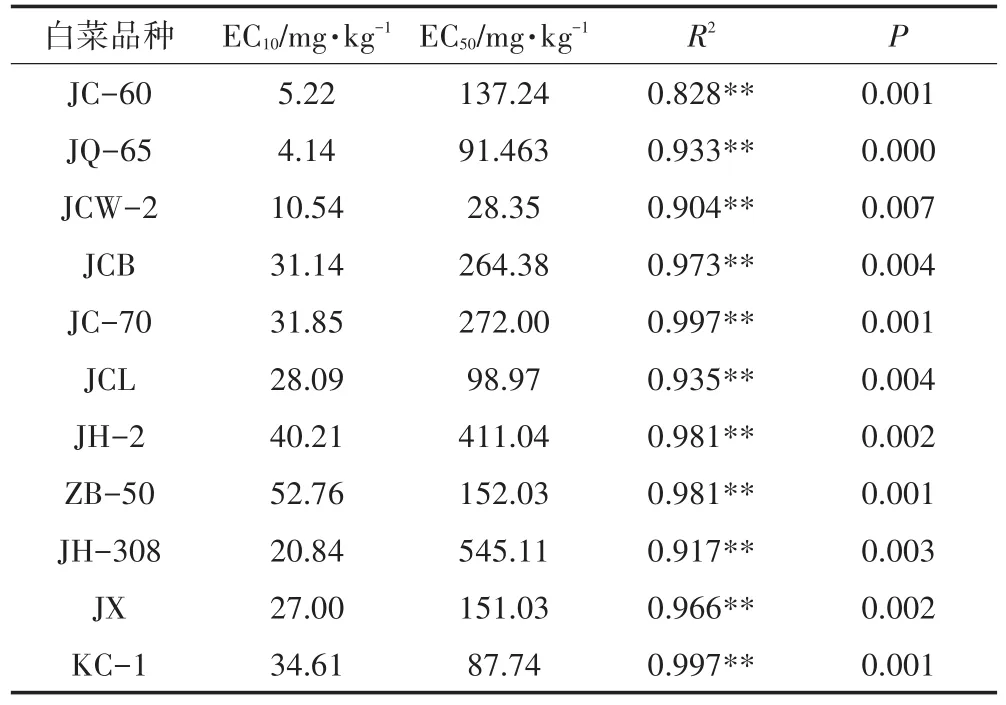
表3 基于生物量(鲜质量)的白菜多环芳烃芘毒性阈值(EC10、EC50)Table 3 Toxicity thresholds of pyrene to cabbage based on biomass(fresh weight)response(EC10、EC50)
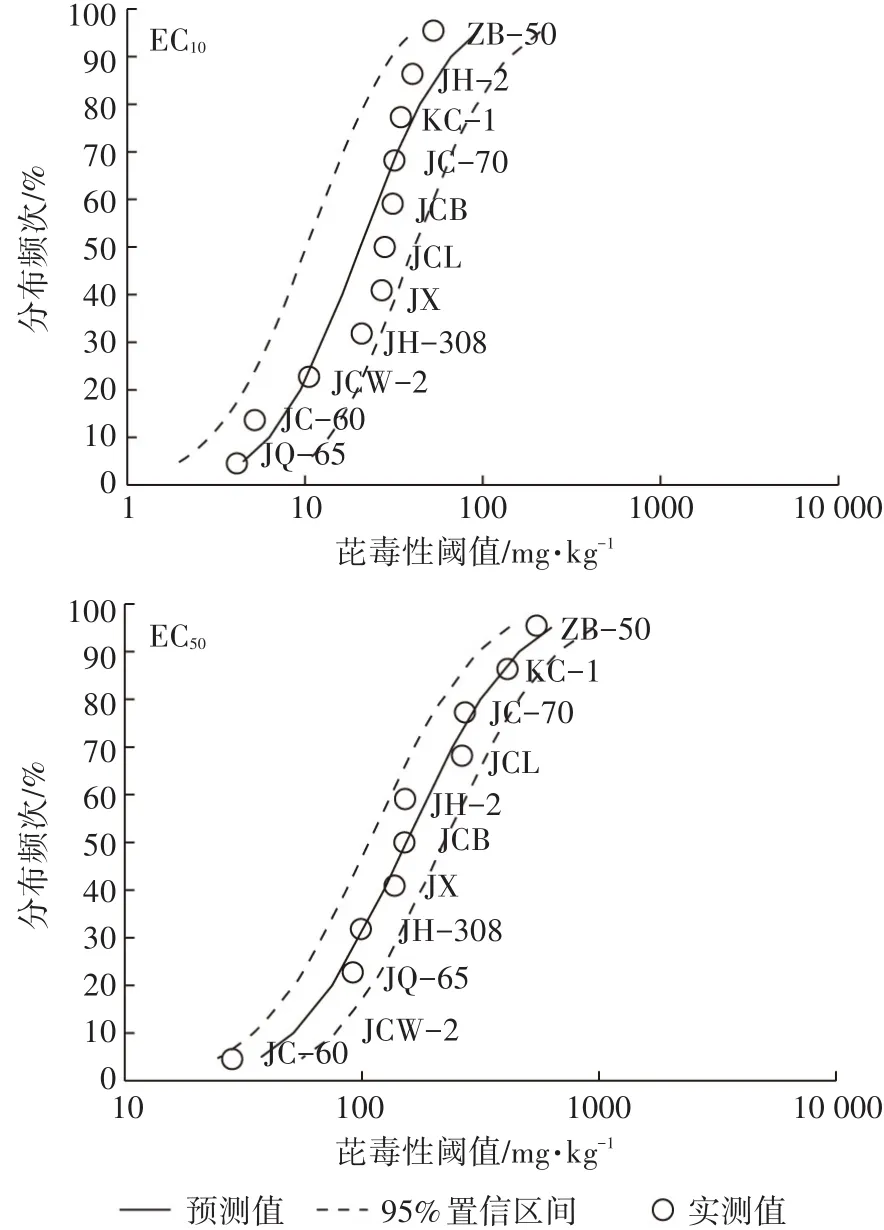
图3 不同白菜品种基于芘剂量-效应毒性阈值的物种敏感性分布频次曲线Figure 3 Cumulative frequency of SSD of Cd to cabbage varieties based on the ECx
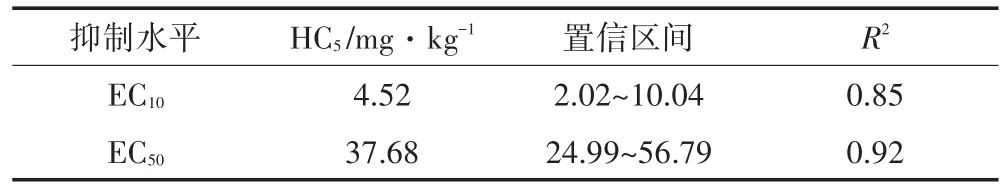
表4 基于SSD拟合的保护95%白菜品种芘生态阈值HC5值Table 4 Ecological hazard concentration(HC5)of pyrene to cabbage based on SSD
多环芳烃在一定范围内对植物生长具有一定的刺激作用,较高浓度时可抑制植物的生长[24]。张军[25]通过土培实验发现,当PAHs含量为1~10 mg·kg-1范围时,对小麦株高有一定的促进作用,在100 mg·kg-1时,达到显著抑制作用。洪有为等[26]研究发现随着菲处理浓度的增高,秋茄幼苗地上部的生长量呈现先升高后降低的趋势。本实验结果表明,芘在一定处理浓度范围(5~45 mg·kg-1)内能够对不同品种白菜的生长产生不同程度的促进作用,但超过该浓度范围后对白菜生长产生抑制效果,并且不同白菜品种在芘胁迫下表现出了不同的敏感性,品种JC-60和JQ-65表现出抑制作用,其他9个白菜品种在不同芘处理浓度下表现出不同程度的刺激作用。王海翠等[27]研究表明油菜在不同浓度荧蒽处理下表现为低浓度促进生长,高浓度抑制生长,这与本试验结果大体一致。有学者提出在低浓度产生促进作用,可能是PAHs与多数植物的生长激素(如生长素和赤霉素)具有类似的环状结构[28]。然而其他学者认为,低浓度多环芳烃促进植物生长,主要是低浓度多环芳烃可以增加植物的根数,根系活力影响较小,使地上部分生长所需的养分和水分能得到较充足的供应,从而促进植物的生长[29]。在高暴露浓度(405 mg·kg-1)芘处理下11种白菜生长都受到抑制,一方面是多环芳烃能够影响植物光合作用,通过抑制光系统Ⅱ(PSⅡ)的活动,从而降低光合电子的传递速率,进而影响光合作用[30]。尹冬雪等[8]发现随着芘浓度的升高,叶绿体逐渐受到损伤,拟南芥叶片中叶绿素含量先升高后显著下降,进而影响光合作用。另一方面,当植物受到逆境胁迫时会产生ROS,ROS会引起植物中蛋白质的分解、DNA损伤、脂肪损伤,从而抑制植物生长[31]。Liu等[32]研究菲胁迫下拟南芥体内H2O2和MDA的含量变化,发现其含量随着多环芳烃的浓度升高而升高,说明多环芳烃对拟南芥叶片细胞产生了损伤。
剂量-效应关系是指不同剂量的外源化学物与其引起的质效应发生率之间的关系[33]。在环境科学领域,质效应评价指标选择通常有植物的根伸长、发芽率、生物量(鲜质量、干质量)和遗传毒性等指标。已有研究发现随着芘的暴露浓度增加,干质量/鲜质量比值逐渐增加,与干质量相比,以鲜质量为评价终点推导的EC20与EC50值更低,说明鲜质量相比干质量对芘的响应更为敏感[34]。故本文选择以鲜质量作为芘毒性评价终点。污染物毒性阈值EC10与环境标准制定关系较为密切,在长期暴露的生物学效应中常报道EC50[35],ECx(x=10,50)的推导则需要环境介质中污染物浓度数据和相关的评价终点指标。本文通过剂量-效应关系曲线推导得出毒性阈值(EC10、EC50),毒性阈值的大小受植物生长介质中污染物浓度与植物评价指标效应强度的影响,低浓度多环芳烃刺激生长,高浓度抑制植物生长,其抑制程度的大小跟多环芳烃对植物的损伤程度有很大关系[36]。Baud-Grasset等[37]研究三环和四环多环芳烃对生菜和燕麦两种农作物的根伸长抑制情况,得出基于生菜发芽率的EC50值是590 mg·kg-1,基于燕麦发芽率的EC50是1170 mg·kg-1。Sverdrup等[34]通过芘对黑麦草、红车轴草、白芥根伸长抑制试验,得出基于芽鲜质量的EC50分别为>1000 mg·kg-1、380 mg·kg-1、>1000 mg·kg-1,基于干质量的 EC50值分别为>1000 mg·kg-1、640 mg·kg-1、>1000 mg·kg-1。这说明不同种的植物对相同污染物具有不同的抑制效应值,这不仅与受试作物有关,而且跟评价终点也有很大的关系。本试验结果表明多环芳烃芘对不同白菜品种EC10最大值与最小值相差11.74倍,EC50最大值与最小值相差14.49倍,其原因有可能是不同品种白菜对芘的敏感性不同,对芘的富集能力也不相同,同时植物根际作用对多环芳烃的消解起重要作用。夏雯[38]通过水稻盆栽试验发现水稻品种对芘消解有显著影响,而且根际土壤中芘的消解率显著高于非根际土壤。白菜根系分泌物有可能促进根际微生物种群数量,进而强化根际微生物对芘的降解能力,导致芘在土壤中浓度发生不同程度改变,进而导致EC10与EC50的变化。其具体变化原因有待进一步研究。
生态风险阈值即污染物对生态系统产生影响的临界值,HCq即保护(100-q)的物种不受影响时所允许的最大剂量浓度。本实验通过物种敏感性分布模型拟合EC10与EC50,分别得到保护95%白菜品种生态风险阈值HC5值为4.52 mg·kg-1和37.68 mg·kg-1。
4 结论
(1)芘在一定浓度范围可以促进白菜的生长,但是高浓度时会抑制白菜的生长,并且与白菜品种有很大的关系。
(2)在11种受试白菜中中白50(ZB-50)对芘表现出较强的抗性,并且芘对不同白菜毒性阈值变化差异明显,EC10在4.14~52.76 mg·kg-1之间变化,EC50在28.35~545.11 mg·kg-1之间变化。
(3)通过物种敏感性分布法得出基于EC10和EC50,保护95%白菜品种的生态风险阈值HC5分别为4.52 mg·kg-1和37.68 mg·kg-1。

