外源La(Ⅲ)和Si对水稻幼苗植硅体固镧能力的影响
司 勇 ,王丽红 ,周 青 ,4*
(1.江南大学环境与土木工程学院,江苏 无锡 214122;2.江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;3.皖西学院环境与旅游学院,安徽 六安 237012;4.苏州科技大学江苏省水处理技术和材料合作创新中心,江苏 苏州 215009)
植硅体(Phytolith)也称植物蛋白石,是沉积在各种植物组织细胞壁、细胞间隙和细胞腔中的一种无定型水合硅[1]。植硅体能够包裹植物的活细胞器,例如叶绿体、线粒体、质粒或其他的细胞器[2]。前人利用植硅体包裹碳作为安全碳汇并提出许多有效管理未来气候变化的方法[3]。植硅体是植物体内的胶体硅通过发生聚合作用而形成,与植物的硅吸收联系密切。尽管硅(Silicon)不是高等植物必需的基本元素,但其几乎存在于所有的植物种类中[4],对控制植物疾病非常有效,能增加叶、茎、叶鞘等器官的抵抗能力[5],并且能缓解化学胁迫(如盐、金属毒害、营养失衡等)和物理胁迫(如干旱、辐射、高温、低温、UV等)[4-7]。此外,硅能改进植物叶片的光截获能力,从而激发冠层光合作用[5]。这些有益影响都归结于植物根对硅的吸收能力[8]。
稀土元素在工业中有着广泛的应用[9]。人类对稀土资源日益增加的需求,引发了稀土元素在环境中的持续释放[9],从而加速稀土元素在环境中的积累[10]。与其他稀土元素相比,镧(Lanthanum)的数量在微肥和环境中较多[11],因而大量的毒理研究集中在植物对镧的吸收方面。生理研究显示,镧对植物生理功能具有“低促高抑”效应(Hormesis),如低浓度(如30~35 μmol·L-1LaCl3)促 进 辣 根(Armoracia rusticana Gaertn.)细胞伸长,高浓度(大于80 μmol·L-1LaCl3)抑制细胞伸长甚至破坏细胞[12]。镧可调控菜豆(Phaseo⁃lus vulgaris Linn.)和玉米(Zea mays L.)过氧化氢酶(CAT)和过氧化物酶(POD)[13]活性,降低丙二醛(MDA)含量,维持膜透性及光合能力,减轻镉(Cd)对2种作物胁迫伤害。镧还能以胞吞作用影响钙调蛋白(CaM)的表达[14],阻碍镧在细胞间和器官间有效运输。
水稻(Oryza sativa L.)是典型的硅高积累作物,其硅含量是植物大量营养元素如氮、磷、钾等的几倍甚至更高[4-5]。水稻各种器官中硅的高积累主要源自根硅内流(Lsi1)和外流(Lsi2)载体对硅的主动运输。如果敲除Lsi1和Lsi2,水稻的硅吸收会显著减少[15]。水稻Lsi1和Lsi2均可编码一种水通道蛋白,两者编码的蛋白分别拥有6个和11个横跨膜区域[16-17]。植物植硅体会包裹受到镧污染的活细胞物质,将镧元素吸附在表面或固定在内部[18]。这可能会影响植物体内物质转运、能量交换和信息传递等一系列功能实现。目前,外源镧与植物植硅体镧固定之间的关系还不清晰,植硅体在植物镧固定中的作用鲜有报道。本研究采用微波消解和实时PCR等一系列方法,考察镧和硅对水稻根、茎和叶植硅体镧固定的影响,以及对稻根基因绝对定量表达的影响,探讨植硅体镧固定的原因,为深入理解植硅体对植物镧的减毒机制,以及客观评价稀土污染的环境风险和农作物的食品安全提供参考。
1 材料与方法
1.1 试材培养与处理
在可控条件温室(Rheem puffer hubbard environ⁃mentalTM,美国)中开展水培实验。供试水稻种子为淮稻8号。种子用3%(V/V)双氧水消毒20 min,去离子水冲洗若干次并浸种24 h后,置于恒温培养箱28℃萌发48 h。萌发后种子播种于装有石英砂的塑料容器(5 L),并灌入1/2高度Hoagland营养液。可控温室光强为 400 μmol·m-2·s-1,光照时长 13 h(光)/11 h(暗),相对湿度为70%~80%,昼温35℃,夜温25℃。待长至两叶一心时,将幼苗移栽至5 L塑料容器中,每个容器栽种96株,添加4 L营养液,每2 d更换营养液一次。3 d后开始添加有效硅(NaSiO3·9H2O,表示为Si)和有效镧[LaCl3,La(Ⅲ)]。培养液pH保持5.5。基于当前全球土壤中镧水平[9,19]和土壤中单硅酸水平[20],实验设置9个处理:对照(CK)、Si 15 mg·L-1、Si 210 mg·L-1、La(Ⅲ)20 mg·L-1、La(Ⅲ)300 mg·L-1、15 mg·L-1Si+20 mg·L-1La(Ⅲ)、15 mg·L-1Si+300 mg·L-1La(Ⅲ)、210 mg·L-1Si+20 mg·L-1La(Ⅲ)、210 mg·L-1Si+300 mg·L-1La(Ⅲ);用NaOH溶液与体积比为3∶1的H2SO4和HNO3的混合溶液调制pH至5.5。每2 d用1 mmol·L-1KH2PO4溶液喷洒叶部,以补充磷素。每3 d换一次含硅和镧的无磷营养液。每个处理3个重复。
1.2 植硅体含量与形态测定
待测植物器官和种子用超声波浴清洗15 min,再用超纯水冲洗若干次。将样品置于恒温鼓风干燥箱,105℃烘干20 min,然后降为75℃烘至恒质量。烘干后样品需粉碎待测。
提取植硅体用微波消解方法[21],并用Walkley-Black type digest方法处理[22]。植硅体用鼓风恒温干燥箱75℃烘干至恒质量,用事先称质量的离心管密封并称量以计算植硅体含量。植硅体含量计算方法见公式(1),并参见文献[1,18]。

植硅体形态分析使用Lu等[23]描述的热消解方法,从植物消解液中取5 μL均匀一致的液体,用中性树脂制成固定玻片,用光学显微镜观察代表性植硅体形态[24]。
1.3 元素测定
样品(植硅体或植物)置于高纯石墨坩埚,均匀混入偏硼酸锂(BLiO2,无水,纯度99.99%),置于马弗炉灰化[18]。温控过程参见文献[18]。冷却后,灰分用稀硝酸溶解,期间用磁力搅拌器缩短溶解时间。样品镧含量和硅含量分别用电感耦合等离子发射光谱(ICPAES)和钼蓝比色法测定[25]。用土壤标准物质(GBW07405,GSS-5)和植物标准物质(GBW 07603,GSV-2)监控,误差率<5%。水稻植硅体La含量为La(Ⅲ)在植硅体中的质量分数(%,wt)。水稻器官植硅体La含量(PhytLa content of organs,PLCO,%)计算方法见公式(2),并参见文献[18],式中植硅体含量用公式(1)计算得出。植硅体镧固定能力(Sequestration ability of phytoliths on La,PLSA)用 PLCO与 La含量(%)比值估算,计算方法见公式(3),并参见文献[18]。其中,植硅体La含量和La含量分别为植硅体和植物稀硝酸溶解液的ICP-AES实测值。

1.4 基因绝对表达量测定
实时荧光定量法(RT-PCR)检测稻根基因(Lsi1和Lsi2)的绝对定量水平[16-17]。基因测序公司:上海美吉生物医疗有限公司。RNA提取:上海美吉生物柱式植物总RNA抽提纯化试剂盒(SK8661)。反转录:上海美吉生物第一链cDNA合成试剂盒(SK2445)。RT-PCR反应体系(10 μL反应体系)如下:1 μL cDNA(×10);7.4 μL ddH2O;0.8 μL引物-F;0.8 μL引物-R(引物见表1)。加好样的孔板放在定量PCR仪(ASI 7500,杭州朗基科学仪器有限公司)中进行反应:95℃反应5 min,95℃反应5 s,55℃反应30 s,72℃反应40 s,40个循环。最后测出各目的基因的绝对表达量。
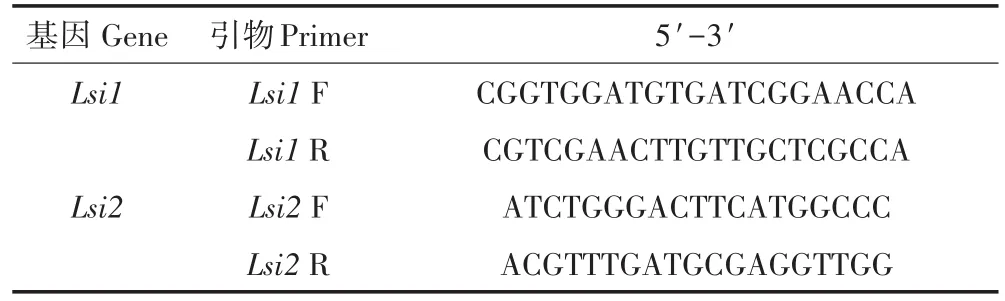
表1 目的基因的引物序列Table 1 The primer sequence of the target genes
1.5 统计分析
使用One-way ANOVA方法进行数据统计学分析,并用Duncan′s multiple range test方法分析处理组间的差异显著性。数据统计和做图利用Excel和SPSS软件完成。
2 结果与分析
2.1 镧对水稻幼苗各器官植硅体Si/La和植硅体Si含量的影响
La(Ⅲ)对水稻植硅体Si/La和植硅体Si含量的影响见图1。与CK相比,叶、茎和根中的植硅体Si/La伴随镧浓度升高均显著下降。当镧浓度为20 mg·L-1时,与CK相比,各器官植硅体Si/La下降幅度顺序为根>叶>茎;而当镧浓度为300 mg·L-1时,与CK相比各器官植硅体Si/La的下降幅度顺序为根>茎>叶。与植硅体Si/La变化趋势相反,根、茎和叶植硅体Si含量均伴随镧浓度增加而递增。当镧浓度为20 mg·L-1时,与CK相比,各器官植硅体Si含量增加幅度差别不显著;而当镧浓度为300 mg·L-1时,各器官植硅体Si含量增加幅度顺序则为根>茎>叶。
此外,本研究还将文献[26]中植硅体SiO2含量转换为植硅体Si含量,并将文献[26]植硅体Si含量与其Si含量相比,结合本研究数据统计如图2所示。结果显示,文献[26]中茎的植硅体Si含量与Si含量比值显著大于叶,而本研究不同器官植硅体Si含量与Si含量比值从大到小排序为根>茎>叶;另外,图中本研究数据略低于文献[26]。
2.2 镧和硅对水稻幼苗各器官PLSA的影响

图1 La(Ⅲ)对水稻幼苗各器官植硅体Si/La和植硅体Si含量的影响Figure 1 Variation of phytolith Si/La and phytolith Si content in the combined treatments with different La level in various rice seedlings′tissues
La(Ⅲ)和SiO2对水稻PLSA影响如图3所示。(1)与CK相比,20 mg·L-1La(Ⅲ)使水稻幼苗叶、根中PLSA增加,茎中PLSA减少,300 mg·L-1La(Ⅲ)则使PLSA均减少。与CK相比,15 mg·L-1SiO2和210 mg·L-1SiO2均使叶、茎、根中PLSA增加;(2)与CK、15 mg·L-1SiO2处理相比,20 mg·L-1La(Ⅲ)+15 mg·L-1SiO2组叶、茎、根中PLSA均显著增加。20 mg·L-1La(Ⅲ)+15 mg·L-1SiO2组叶和茎PLSA均高于20 mg·L-1La(Ⅲ)处理,根则相反。与CK相比,20 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组PLSA均显著增加。20 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组叶和茎高于20 mg·L-1La(Ⅲ)处理,根PLSA则相反。与210 mg·L-1SiO2处理相比,20 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组的茎PLSA增加,叶和根中PLSA 则均下降;(3)300 mg·L-1La(Ⅲ)+15 mg·L-1SiO2组的叶、茎PLSA低于CK,根PLSA高于CK。300 mg·L-1La(Ⅲ)+15 mg·L-1SiO2组3种器官PLSA都高于300 mg·L-1La(Ⅲ)处理,低于15 mg·L-1SiO2处理。300 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组的叶和根PLSA显著高于CK,茎PLSA则显著低于CK。300 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组3种器官PLSA均高于300 mg·L-1La(Ⅲ)处理,叶、茎PLSA均显著低于210 mg·L-1SiO2处理,而根则相反。
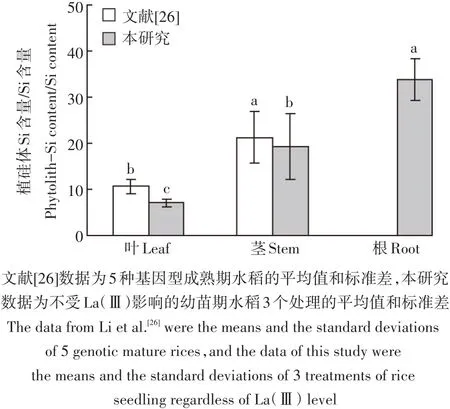
图2 水稻各器官植硅体Si含量与Si含量的比值Figure 2 Variation of the ratio of phytolith Si content and Si content in different parts of rice
2.3 镧和硅对水稻幼苗叶哑铃形植硅体形态的影响
水稻器官中哑铃型植硅体居多。SiO2和La(Ⅲ)对叶哑铃型植硅体形态特征的影响如图4。(1)与CK相比,20 mg·L-1La(Ⅲ)使水稻幼苗叶植硅体变大,而300 mg·L-1La(Ⅲ)则使其变小,并且形状趋向于不规则。与CK相比,15 mg·L-1SiO2使叶植硅体变大,而210 mg·L-1SiO2反而使其变小,但排列更加规则有序,密度增加。(2)与CK、La(Ⅲ)和SiO2单一处理相比,20 mg·L-1La(Ⅲ)+15 mg·L-1SiO2组植硅体变小;而20 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组植硅体较CK和210 mg·L-1SiO2组尺寸变大,但与20 mg·L-1La(Ⅲ)组相比变化不显著。(3)300 mg·L-1La(Ⅲ)+15 mg·L-1SiO2组植硅体尺寸大于CK和300 mg·L-1La(Ⅲ)组,但小于15 mg·L-1SiO2组。另外,300 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组植硅体尺寸均比CK、300 mg·L-1La(Ⅲ)组和210 mg·L-1SiO2组大。
2.4 硅和镧对水稻幼苗根Lsi1和Lsi2表达的影响
La(Ⅲ)和SiO2对水稻幼苗根运载体Lsi1和Lsi2基因表达的影响如图5所示。(1)与CK相比,15 mg·L-1SiO2使根Lsi1和Lsi2表达水平显著减少,210 mg·L-1SiO2使Lsi1显著增加,而Lsi2变化不大。与CK相比,20 mg·L-1La(Ⅲ)虽然使Lsi1表达水平略微增加,但却使Lsi2显著下降。300 mg·L-1La(Ⅲ)使Lsi1和Lsi2表达水平均显著低于CK,约为其1/2,其中Lsi2最低。(2)与CK和20 mg·L-1La(Ⅲ)单一处理相比,20 mg·L-1La(Ⅲ)+15 mg·L-1SiO2组的Lsi1表达水平增加,而Lsi2则减少。对比15 mg·L-1SiO2单一处理,20 mg·L-1La(Ⅲ)+15 mg·L-1SiO2组的Lsi1和Lsi2表达水平均显著增加。与CK相比,20 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组的Lsi1表达水平显著增加,而Lsi2则显著减少。20 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组的Lsi1和Lsi2表达水平均显著高于20 mg·L-1La(Ⅲ)单一处理,并均显著低于210 mg·L-1SiO2单一处理。(3)300 mg·L-1La(Ⅲ)+15 mg·L-1SiO2组的Lsi1和Lsi2表达水平均小于CK,并均略微小于15 mg·L-1SiO2单一处理,但都显著高于300 mg·L-1La(Ⅲ)单一处理。300 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组的Lsi1和Lsi2表达水平均显著低于CK和210 mg·L-1SiO2单一处理,其中Lsi1表达水平约为CK的1/4,为最小值。300 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组Lsi1表达水平显著低于300 mg·L-1La(Ⅲ)单一处理,而其Lsi2则相反。

图3 La(Ⅲ)和SiO2对水稻幼苗叶、茎和根PLSA的影响Figure 3 The PLSA in leaves,stems and roots of rice seedlings with the pretreatments with different La and Si levels
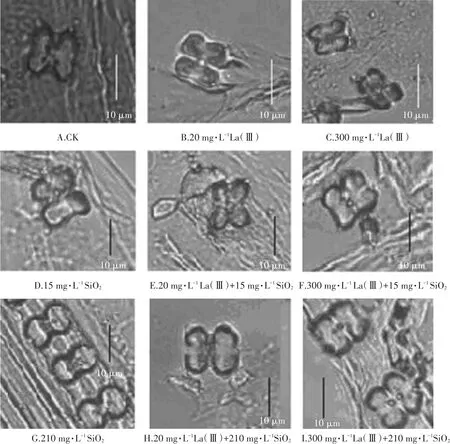
图4 La(Ⅲ)和SiO2对水稻幼苗叶哑铃型植硅体的影响Figure 4 Effects of La(Ⅲ)and SiO2on dumb-bell phytoliths in rice seedlings
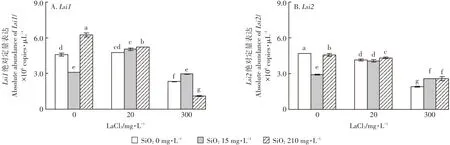
图5 La(Ⅲ)与SiO2对水稻幼苗根系Lsi1(A)和Lsi2(B)基因绝对定量表达的影响Figure 5 The absolute quantification of Lsi1(A)and Lsi2(B)gene in the roots of rice seedling under various La and Si concentration
图6 是9种处理水稻根Lsi1和Lsi2基因的表达水平与3种器官PLSA之间的相关性。统计分析表明,水稻根PLSA与Lsi1和Lsi2基因的表达水平相关性均不显著,其相关系数分别为0.139 3和0.221 1,P>0.05。与根相反,茎PLSA分别与根Lsi1和Lsi2基因表达水平呈现显著相关性,相关系数分别为0.725 6和0.638 8,P<0.01。与茎类似,叶PLSA与根Lsi1和Lsi2之间相关性都很显著,相关系数分别为0.739 3和0.717 3,P<0.01。
3 讨论
3.1 镧对水稻器官植硅体固镧效率的影响
理解REEs对植物影响的关键是弄清稀土在植物中的固定方式,即REEs是以何种形式赋存在植物体内?Kameník等[27]发现,在无REEs污染地区生长的植物中形成的植硅体含有少量REEs。弄清植硅体在植物La(Ⅲ)固定中的作用至关重要。目前,外源La(Ⅲ)对植物不同器官植硅体固镧能力的影响机理并不清晰,相关研究未见报道。本研究发现(图1),伴随外源La(Ⅲ)浓度增加,水稻幼苗各器官植硅体Si/La均出现减少趋势,而植硅体Si含量则均呈现增加趋势,说明La(Ⅲ)应用可以通过植物各器官植硅体积累而增强植硅体的固镧效率。根是水稻吸收环境元素的主要器官[28]。图1显示,在La(Ⅲ)胁迫下(20 mg·L-1或300 mg·L-1)根植硅体Si/La降幅均显著低于叶和茎,而植硅体Si含量则相反,说明根植硅体通过Si-O-La-O-Si键形成的复合结构[18]更稳定,能在结构上吸收更多的La(Ⅲ),固镧效率更高。这与之前有关水稻秸秆植硅体溶解度会随环境中Al3+浓度增加而降低的观点一致[29]。因为这意味着植硅体会通过增加自身Si积累而同时提升自身的La(Ⅲ)束缚能力和稳定性,进而缓解La(Ⅲ)毒性。可见,水稻植硅体La(Ⅲ)固定能力的变化与外源La(Ⅲ)密切相关。我们推测这主要是由植硅体结构上的特点决定的。植硅体主要是由水合无定型硅组成[1],在这种物质的化学结构中,许多不同的羟基伴随在硅的周围,这些硅与羟基组成的结构几乎没有重复,这种硅结构有很低的表面电荷[30]。随着植硅体结构变得复杂,无定型硅的表面电荷会轻微下降[31]。这些性能使植硅体更易与La(Ⅲ)结合[18],形成非常稳定的植硅体-La(Ⅲ)复合体,提升植物对La(Ⅲ)的固定能力。
3.2 镧和硅对水稻器官植硅体固镧能力的影响
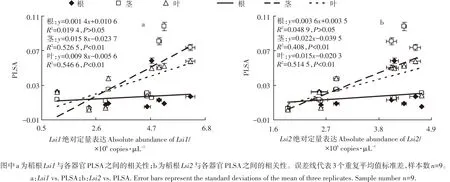
图6 水稻幼苗根Lsi1和Lsi2基因绝对定量表达与根茎叶PLSA之间的相关性Figure 6 Correlations between the absolute quantification of Lsi1 and Lsi2 gene in the roots of rice seedling and the PLSA in the different organs of rice seedling under various Si and La levels.
本课题组发现[18],水稻叶、茎和根植硅体积累量与植硅体镧固定存在密切的联系,植硅体在各器官对外源La(Ⅲ)的响应存在“低促高抑”趋势,但从上到下器官依次减弱。本研究发现,除茎以外,20 mg·L-1La(Ⅲ)促进了叶和根的PLSA。通过观察水稻幼苗叶哑铃型植硅体也发现,20 mg·L-1La(Ⅲ)使植硅体变大(图4B)。然而,仅根Lsi1表达获得促进。细胞内流硅酸大于外流硅酸,从而使质外体硅存贮增加,增加植硅体固定La(Ⅲ)污染细胞概率,提高固镧效率和能力。因此,植硅体La(Ⅲ)复合结构稳定性、植硅体大小和根Lsi1表达水平是促进PLSA增加的重要因素。这可能与La(Ⅲ)对水稻的Hormesis效应有关[32]。另外,单一300 mg·L-1La(Ⅲ)处理使叶、茎和根PLSA均受到显著抑制。通过观察叶哑铃型植硅体也发现,此时植硅体显著变小,而且根Lsi1和Lsi2均显著减少,说明水稻Lsi1和Lsi2的表达会因为过高浓度La(Ⅲ)而共同受到抑制,抑制其体内硅转运和吸收,进而通过抑制植硅体形成,降低植硅体在各器官中的固镧能力。
通过对水稻各器官PLSA的La(Ⅲ)和Si复合影响分析,我们归结以下四点:(1)20 mg·L-1La(Ⅲ)+15 mg·L-1SiO2组与单一15 mg·L-1SiO2处理相比,叶、茎、根PLSA和根Lsi1、Lsi2表达水平都增加,Lsi1和Lsi2相互协作,共同提升了植硅体固镧能力。该组与单一20 mg·L-1La(Ⅲ)处理相比,叶、茎PLSA与根Lsi1都增加,而根PLSA则与Lsi2都减少,表明根Lsi1可能是地上部植硅体固镧能力增加的主要因素,而Lsi2则相反。同时鉴于该组叶哑铃型植硅体变小,根Lsi2可能与植硅体形态改变有关。(2)20 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组与单一20 mg·L-1La(Ⅲ)处理相比,除根PLSA外,叶、茎PLSA与根Lsi1、Lsi2都显著增加;而该组与单一210 mg·L-1SiO2处理相比,叶根PLSA与根Lsi1、Lsi2都显著减少。这些说明根Lsi1、Lsi2可能是提升20 mg·L-1La(Ⅲ)影响下叶植硅体固镧能力的主要因素。而高浓度SiO2则为叶植硅体较多产出和较大尺寸提供保证。(3)300 mg·L-1La(Ⅲ)+15 mg·L-1SiO2组与单一300 mg·L-1La(Ⅲ)处理相比,叶、茎、根PLSA,叶哑铃型植硅体大小,根Lsi1、Lsi2都显著增加,而与单一15 mg·L-1SiO2处理相比,叶、茎、根PLSA,叶哑铃型植硅体大小,根Lsi1、Lsi2都显著减少,说明根Lsi1、Lsi2和叶植硅体形态都可能调控水稻植硅体固镧能力,同时也说明15 mg·L-1SiO2能缓解300 mg·L-1La(Ⅲ)的抑制作用。(4)300 mg·L-1La(Ⅲ)+210 mg·L-1SiO2组与单一300 mg·L-1La(Ⅲ)处理相比,叶、茎、根PLSA,叶哑铃型植硅体大小和根Lsi2都显著增加,而与单一210 mg·L-1SiO2处理相比,根PLSA和Lsi2仍然显著增加,说明Lsi2可能是影响根植硅体固镧能力的重要因素。原因可能是由于高浓度Si和高浓度La(Ⅲ)的复合胁迫会使根部外皮层和内皮层的细胞内流硅酸受到抑制,减少水稻从外部吸收硅,同时通过增加同一细胞的外流作用[33],促使Si从细胞中更多地流向质外体,进而提升了根植硅体固镧能力。
文献显示[34],Lsi1和Lsi2表达主要负责了不同基因型水稻幼芽和根部的硅吸收。本研究发现,水稻根部Lsi1和Lsi2表达量分别与茎、叶PLSA之间呈现显著正相关,而与根PLSA之间相关性较差(图6),表明根Lsi1和Lsi2表达水平是决定水稻叶、茎植硅体固镧能力的关键因素。水稻根有高度发达的通气组织,在外皮层和内皮层之间没有皮质细胞[35],较难将近端Lsi2载体排出的硅酸在质外体中聚合形成植硅体。受本课题组植硅体提取技术的限制,根植硅体提取的数量稀少[18],增加了统计误差。因此,根在硅吸收系统中的独特作用可能是导致本研究根PLSA-Lsi1、Lsi2有较差相关性的重要原因。根PLSA与Lsi1和Lsi2的真实相关性有待今后通过改进植硅体提取技术进行验证。
4 结论
(1)外源La(Ⅲ)应用能够提升水稻叶、茎、根植硅体与镧复合结构的稳定性,增加植硅体固镧效率。低浓度La(Ⅲ)可以使叶哑铃型植硅体大小和根Lsi1表达水平增加,促进叶和根PLSA。而过高浓度La(Ⅲ)则会使叶哑铃型植硅体大小、根Lsi1、Lsi2和叶、茎、根PLSA受到抑制。
(2)低浓度La(Ⅲ)和Si复合处理能提升叶和茎PLSA,根Lsi1是影响叶植硅体固镧能力的重要因素。外源Si能够缓解高浓度La(Ⅲ)对叶、茎和根PLSA的抑制作用,根Lsi2是影响根PLSA的重要因素。

