关于双链特异性核酸酶介导的生物传感器研究进展
肖星凝 朱龙佼 李相阳 罗云波 许文涛
(1. 北京食品营养与人类健康高精尖创新中心 中国农业大学食品科学与营养工程学院,北京 100083;2. 农业部农业转基因生物安全评价(食用)重点实验室,北京 100083;3. 北京农学院食品科学系,北京 102206)
2002 年,Shagin等[1]从虾、蟹等十足目动物的消化腺或肝胰腺中分离得到一种DNA核酸酶,被称为双链特异性核酸酶(Duplex-specific nuclease,DSN)[2]。以往的实验多利用DSN酶为介导等温扩增检测miRNA[3]或构建均一化全长 cDNA文库[4]、 检 测 单 核 苷 酸 多 态 性(Single nucleotide polymorphism,SNP)[1]、测定端粒长度[5]等。目前,结合DSN酶对核酸链特有的性质及生物传感器快速、微量检测的优点,人们设计出了许多精确度越来越高的DSN酶介导的核酸生物传感器,可以用来检测不同种类的RNA、重金属[6]、蛋白质[7]等,使得DSN酶的运用越来越广泛。本文对近年来运用DSN酶为介导的生物传感器进行了分类,旨在使人们更多的了解DSN酶在生物传感器中的作用,指导人们有效、合理地设计和使用DSN酶介导的核酸生物传感器。
1 DSN酶的介绍
1.1 DSN酶的结构
Anisimova等[8]利用特定引物和cDNA末端快速 扩 增(Rapid amplification of cDNA ends,RACE)技术,在堪察加半岛蟹的肝胰脏中克隆了DSN基因并测定了它完整的初级结构,还建立了一个有效的纯化DSN酶的方法。DSN酶的初级结构与著名的沙雷氏菌中的非特异性核酸酶相类似,但与其性质不同,DSN酶能准确地切割(或水解)双链DNA 或是DNA/RNA杂交链中的DNA链,同时能保证单链DNA /RNA、单链的完整性;沙雷氏菌中的非特异性核酸酶却是水解RNA和单、双链DNA。
1.2 DSN酶的性质
Anisimova等[8]、Qiu 等[2]对 DSN 酶的相关性质进行了总结。DSN酶蛋白是一种分子量为41.5 kD的单体,等电点为4.2。DSN酶活化需要加入镁离子(至少5 mmol/L,最佳浓度为7 mmol/L),Ca2+并不能直接激活DSN酶,但能显著增强Mn2+、Co2+和Mg2+对酶的激活能力,产生协同作用,同时,DSN酶活性随离子浓度增加而降低。DSN酶是一个高度耐热的酶,最适温度60℃,在70℃下加热30 min,DSN酶只会失去部分活性,即使是在100℃下加热30 min,还会留有7%的活性[8]。有效pH值区间3-9,最佳pH值为6.6。EDTA能完全抑制酶活性,且DSN酶对多胺和离液剂比较敏感。DSN酶可以区分完全互补配对和不完全互补配对的双链杂交物,能实现单碱基区分。底物长度要求:DNA双链中最小 9 bp[8]或 10 bp[2]DNA,较短的 DNA 双链不会被切割,保留完整,DNA/RNA杂交双链的有效切割长度为 15 bp[2]。
1.3 DSN酶的切割产物
Liu等[9]在利用DSN酶对SNP进行无标记检测的实验中,阐述了当检测样品中的正常序列与探针完全互补配对时,可被DSN酶降解为dNMPs,dNMPs是含有一个磷酸的单核苷酸,验证了DSN酶可能将底物双链DNA水解成单个核苷酸,且没有位点的切割,降解部位可能为磷酸二酯键。
Anisimova等[8]使用放射性同位素分别标记含有7、8、9 nt的单链DNA,再将这3条单链DNA分别与没有标记的含43 nt的核苷核酸链杂交,用DSN酶去水解发现只有被标记的含9 nt的双链DNA能被正常水解,且电泳图显示,水解产生较多的3、5 nt的核苷酸小片段。同时,Zhao等[5]利用DSN酶测量端粒长度,其原理主要是DSN酶能将双链染色体切割成了小于10 bp的碎片,使单链的端粒保留完整,从而测量其长度。所以,由DSN酶切割所得的产物可能是由大部分短核苷酸链和小部分单核苷酸组成。Zhao等[5]还检测了DSN酶切割剩余片段长度,设计了16 bp长的双链DNA加18 nt长的单链,其中单链重复TTAGGG序列。经DSN酶水解后,除了发现了一个长为24 nt的核苷酸链,比实际设计的悬臂模板长了6 nt。说明了在双链区域有5-6个核苷酸仍然未被降解,不管16 nt DNA片段是否含有75%或25%的GC含量,表明这个消化的限度是独立的,不会进行特异性识别碱基对序列的切割。
2 DSN酶介导的检测miRNA的光学传感器
2.1 比色传感器
比色法是通过观察体系中溶液颜色的变化来判断样液中是否含有靶物质,其优点是用肉眼即可看出颜色的变化,但不足之处是精确度不高,所以如需定量,可以使用核酸信号放大方法。
Wang等[10]利用A、B两条探针去检测miRNA,当90℃温度下加热5 min,达到解旋目的,如果有miRNA,则B探针会与之结合,加入的DSN酶会把B探针水解掉,只剩下A探针,这时A探针就会使金纳米聚沉,从红色变为蓝色,达到检测目的;反之,如果没有miRNA,A、B探针就会随温度下降再次结合,就不会使金纳米变色,检测限为20 pmol/L-1 nmol/L。Xia等[11]利用金纳米特性设计了单探针检测miRNA,然后最先提议的比色法转变成了电化学法,达到了更低的检测限,检测范围为0-25 fmol/L,最低检测限为0.1 fmol/L。
2.2 荧光传感器
荧光法检测因为响应快速、灵敏度高、操作简单,成为了一种较常用的检测技术[12],我们将以不同表达方式的物质分类的荧光传感器进行介绍。
2.2.1 在纳米网荧光传感器中的应用 Guo等[13]设计了利用氧化石墨烯纳米网可以淬灭荧光来检测miRNA,带有荧光基团的单链探针DNA与miRNA结合以后,就能被DSN酶降解,释放出荧光基团而发出荧光;若没有miRNA,探针DNA则不会被降解,就会被吸附到石墨烯上,荧光会被淬灭,最低检测限是160 fmol/L。Xi等[14]首次利用WS2纳米网来检测miRNA,原理和Guo等[13]设计的一样,不过是WS2纳米网代替氧化石墨烯来淬灭单链探针DNA上的荧光基团,检测限扩大到了300 fmol/L。
2.2.2 在磁性粒子荧光传感器中的应用 Hao等[15]设计了一种双重信号放大的检测法检测miRNA,如图1。单链DNA探针分为蓝色的miRNA识别探针和绿色的带有荧光基团的转换探针两部分,首先,识别探针与miRNA完全互补配对后,DSN酶将识别探针切成碎片,进而荧光基团连同绿色转换探针从磁珠上切离下来,游离到溶液中,同时靶标miRNA也释放到溶液中与磁珠上新的捕获探针进行结合,最终,一个miRNA可以释放多个转换探针,DSN酶切割完成后,利用磁场,将磁珠上未释放的荧光基团从溶液中分离出来,溶液的荧光强度与被释放的转换探针数量有关,即与靶分子数量成正相关,可以通过荧光强度初步对靶标miRNA进行定量(图1-A)。当分析物浓度过低,荧光强度无法准确识别时,本法又设计了电化学传感进行二次信号放大(图1-B),主要是通过转换探针催化组装固定在电极上的发卡探针进行取代反应,将荧光信号进一步转化、扩增为电信号实现的。具体转化扩增路径如下:镉纳米粒子黏附在玻璃碳电极上,发卡H1连接在镉纳米粒子上,转换部位的探针将与H1互补,使H1展开,露出H1的茎,另一个发夹H2与露出的H1茎互补配对,释放出转换部位的探针,再次达到循环目的。进行充足扩增以后,H1-H2复合体就能抓住连有多个G-四联体/氯高铁血红素的具有DNA酶功能化的磁珠,导致电化学发光减少,这样的H1-H2复合体数量取决于转换部位的数量。
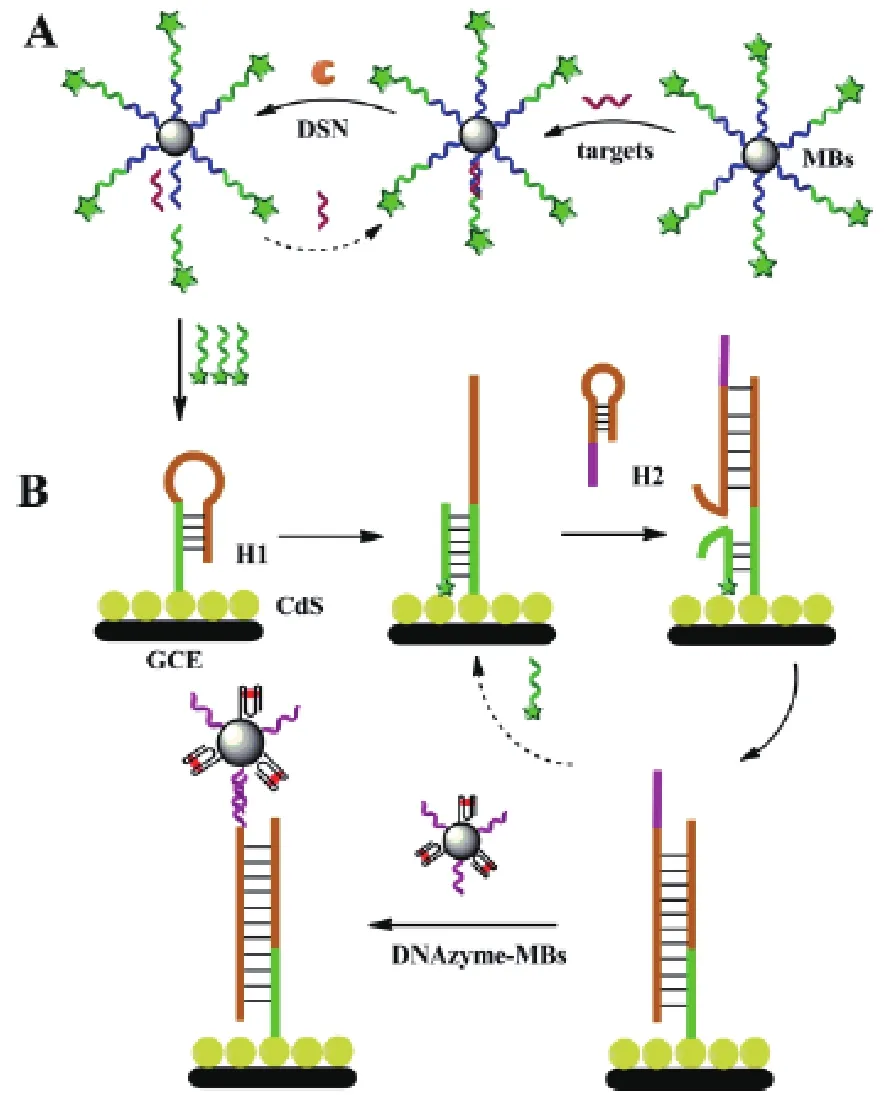
图1 荧光检测miRNA的原理示意图[15]
Zhang等[16]设计了一种无标记的miRNA检测方法,单链DNA探针通过链霉亲和素和生物素连接在小磁珠上,探针分为两部分,下部分可与miRNA结合,被DSN酶切割,然后释放出的上部分探针单链DNA与Tb3+结合,使荧光强度增强。
Lv等[17]又设计了一种可以双重信号扩增检测miRNA的方法,其最低检测限为7.3 fmol/L,miRNA来源于人体癌细胞,磁半球上连接的探针由两部分组成,下部分为DNA,上部分为2-OMe-RNA,第一次信号扩增是由miRNA与下部分的DNA结合,DSN酶切碎DNA,释放出miRNA和剩余的2-OMe-RNA部分,磁半球被磁铁吸附,只剩2-OMe-RNA;第二次信号扩增,带有荧光基团的Taqman探针可与2-OMe-RNA结合,再次被DSN酶切割,发出荧光,达到双重检测的目的。
2.2.3 在金纳米粒子荧光传感器中的应用 2016年,Xu等[18]设计了一种可以同时检测多种miRNA的方法,将具有3D结构、不同颜色的荧光染料标记的四面体DNA探针固定在金纳米粒子上,靶物质可以是miRNA-16、miRNA-21、miRNA-26a,与之对应的DNA探针结合,即可被DSN酶切碎,释放出不同颜色的荧光物质,同时还能区别1个碱基、3个碱基错配的情况。
2.3 化学发光传感器
2016年,Wang等[19]发明一种化学发光传感器,如图2,使用聚多巴胺(PDA、能量受体)-纳米半球为媒介,实现共振能量转换,此法不需要有机染料或者任何标记。整个反应体系包括了检测探针、聚多巴胺、氯高铁血红素、鲁米诺、H2O2和DSN酶,该检测探针由一个与miRNA碱基对互补的单链DNA和一个G-四联体-氯高铁血红素DNA酶两个部分组成,首先当有miRNA时,就会与DNA探针结合,DSN酶切碎探针后,释放出的G-四联体-氯高铁血红素就会和H2O2发生化学反应,使鲁米诺发光,实现化学发光,但此时不发生能量共振传递;但没有靶标存在下,G-四联体不会剥离下来,加入过氧化氢、鲁米诺发光,但同时,会和多巴胺纳米球发生共振能量转移,化学光被淬灭。检测限范围为80 pmol/L-50 nmol/L,最低检测值为49.6 pmol/L。
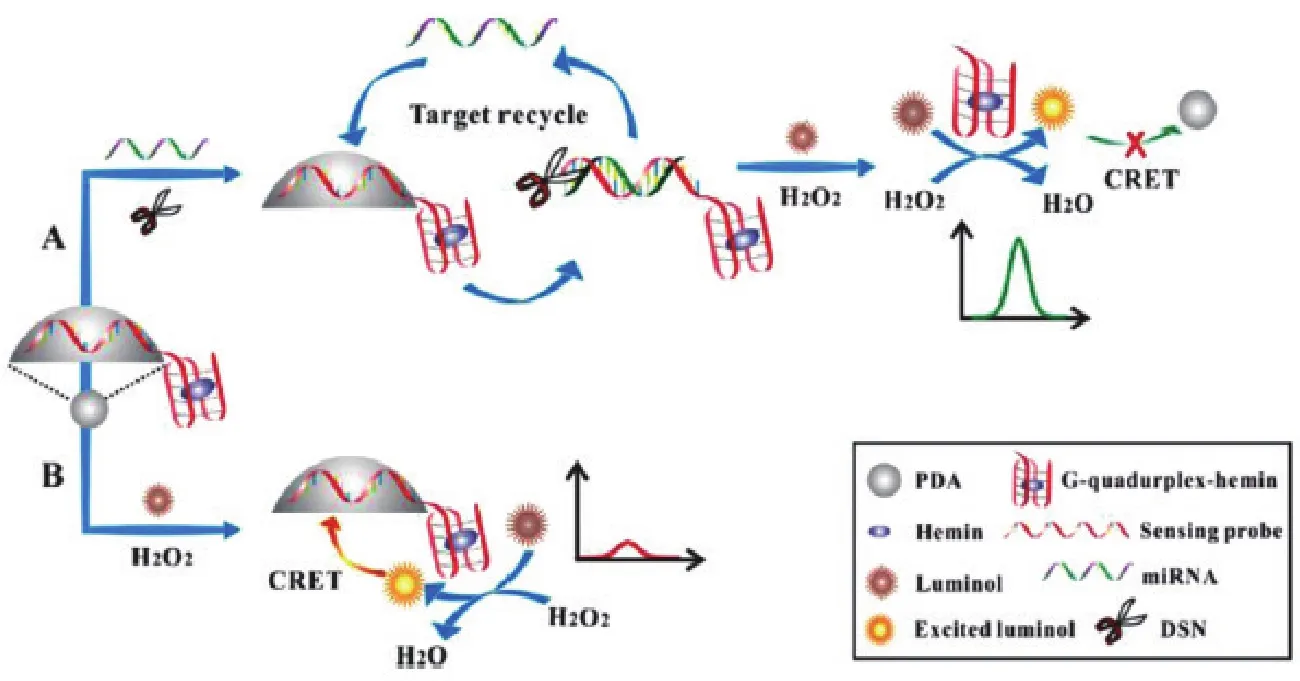
图2 化学发光传感器的检测miRNA原理图
2.4 表面增强拉曼光谱传感器
Pang等[20]将Cy3-DNA修饰到Fe3O4@Ag-磁纳米粒子上,该磁纳米粒子以Fe3O4为中心粒子,溶解于PEI活性剂溶液中,可吸附一层金,再从PVP活性剂和硝酸银溶液中置换出银,给磁纳米粒子外面包裹上一层银外壳,其形成过程如图3。表面增强拉曼散射光,同时,DSN酶信号扩增。首先,miRNA被DNA探针捕获,形成可被DSN酶切割的DNA-RNA杂交双链。DSN酶切后,产生Cy3-DNA碎片,且不停地释放miRNA,激发信号扩大循环。然后,用磁铁浓缩溶液,Cy3-DNA碎片被清洗,即可读出拉曼指数。基于Fe3O4@Ag-磁纳米粒子的超顺磁效应,miRNA let-7b无需PCR,可被DNA探针直接捕获。最低检测限为0.3 fmol/L,比传统的荧光法检测miRNA(- 100 fmol/L)低了3个数量级。
3 DSN酶介导检测miRNA的电化学传感器
荧光传感器虽然简便、易操作,但对环境要求较严格,相比之下,电化学传感器的检测灵敏度更高、且易于微型化和集成化,在未来具有很好的研究前景[21]。

图3 Fe3O4@Ag-磁纳米粒子的形成过程
3.1 金电极修饰传感器
Zhang等[22]设计了一个光电化学传感器,其分为连续的两部分,上边黑色部分是具有识别序列的单探针,硫醇在5′末端,下面蓝色部分为2′-O-甲基修饰富含G碱基序列,通过硫-金共价物,连接在金电极上,miRNA将与黑色部分单探针结合,被DSN酶切碎后,释放出的miRNA循环数次,直到金电极上仅剩2′-O-甲基修饰富含G碱基的序列可与加入氯高铁血红素结合形成2′-O-甲基修饰G-四联体-氯高铁血红素,催化H2O2反应,与TMB发生变色,增强电流信号,该传感器的检测限为8 amol/L miR-21。2017年,Lu等[23]设计了一种双重信号扩增检测的方法,首先小磁珠上修饰着由两部分组成的单链DNA探针,下面绿色部分可与需要检测的靶物质结合,然后DSN酶切割,释放出剩余上面蓝色单链DNA部分,离心后,获得上清液,蓝色的单链DNA可与修饰在金电极上的单链DNA结合,此时再加入两个发卡探针H1、H2,是H1、H2展开形成网状与阿霉素磷酸盐结合可形成量子点产生电化学发光信号。检测let-7d的范围为10 amol/L-10 nmol/L,最低检测限为 10 amol/L。Liu等[24]也是利用DNA探针修饰在金纳米上的原理设计了一种较复杂的电化学方法检测miRNA,最低检测限是0.2 fmol/L。
3.2 玻璃碳电极修饰传感器
2016年,Zhang等[25]设计了一个利用链霉亲和素-生物素结合,DSN酶介导的靶物质循环,富集捕获探针,磁小珠吸附到玻璃碳电极上,产生相应电阻的传感器。捕获探针一端接有生物素,下面部分探针与miRNA杂交后,可以被DSN酶切碎,释放出的生物素可与磁小珠上的链霉亲和素结合,但因为生物素上的DNA探针太短,阴极带电层不能形成,就会产生较小的电荷转移电阻;当没有miR-21时,探针将无法杂交,DSN酶不会水解单链DNA,因此,完整的探针可以吸附到玻璃碳电极表面,产生一个紧密的阴极电层,产生较大电子转移电阻。上述的实验方案达到了超灵敏检测,miR-21检测限为 60 amol/L。Hao 等[26]、Shuai等[27]也利用了玻璃碳电极修饰传感器用来检测miRNA,Hao等运用了DSN酶、金纳米、鲁米诺-金纳米和半导体纳米晶体等介导,能量发生共振转移。Shuai等使用了结合链霉亲和素碱性磷酸酶、DSN酶等介导。
3.3 ITO电极修饰传感器
ITO电极就是铟锡氧化物玻璃电极。Fu等[28]设计了一个ITO电极修饰的传感器检测miR-10b,电击上带有负电荷,DNA探针一段带有亚甲基蓝,与miR-10b结合以后,可被DSN酶切碎,释放出带亚甲基蓝的碎片可与电极之间发生电子转移,产生电流电压;反之,如果没有靶物质的存在,亚甲基蓝就无法与ITO电极传递电子。Li等[29]也使用了ITO电极及DSN酶,运用光电化学的原理来检测miRNA。
4 DSN酶介导检测miRNA的光磁传感器
Tian等[30]利用光磁效应检测两种不同的miRNA,他们设计了一种组装磁纳米结构,内核是磁小珠,不同颜色的单链DNA探针连接在磁珠不同的层面,所以当miRNA与探针结合,被DSN酶切碎后,释放出的磁性纳米颗粒,光磁设备将会检测车这些磁性纳米颗粒的数量。光磁传感器将记录二次谐波,透射光密度及频率。对于单定位点检测let-7b,可观察到检测限在10 fmol/L - 10 nmol/L之间,实验进行70 min时,最低检测限可为4.8 fmol/L(图 4)。
5 DSN酶介导检测其他物质的生物传感器
5.1 检测重金属Hg2+的应用
具有功能性的核酸生物传感器在检测重金属领域中体现出越来越重要的地位,因为它们具有易操作、价格较便宜的特点。2017年,Ou等[7]就借助DSN酶介导设计了一种通过荧光检测重金属Hg2+的简单的生物传感器,核酸探针上只有荧光团,没有淬灭基团,荧光基团后的序列可以对折互补,里面有T-T碱基错配,DSN酶就不可以切割;当加入Hg2+后,Hg2+将两个不互补的碱基连接在一起形成T-Hg2+-T结构,荧光峰值增加到137%;此时,再加入DSN酶,核酸链被切碎,释放出荧光基团,荧光峰值增加到了1251%。这种实验方法高效、简单,可准确的检测水样中或生物细胞内的Hg2+浓度。

图4 光磁传感器检测miRNA的工作原理
5.2 检测蛋白质的应用
Yuan等[6]使用电化学的方法检测家蚕微孢子全蛋白,首先在Au@Fe3O4粒子(即一层金附着在Fe3O4粒子上的结合物)上修饰A1单链DNA,Ab标记的探针S1与A1完美互补,根据邻近效应,加入的靶物质家蚕微孢子全蛋白与S1、S2产生一种三明治结构,暴露出的A1单链DNA可与H1、H2、亚甲基蓝发生杂交链式反应,再经过DSN酶切割以后,释放出金属离子、亚甲基蓝、Ab,然后磁铁吸附金属离子,取上清液,得到的亚甲基蓝溶液和电极之间发生电子传递,从而通过检测电流达到检测家蚕微孢子全蛋白的目的(图5)。

图5 检测蛋白质的工作原理
5.3 检测mRNA的应用
2015年,Li等[31]设计了一种双信号扩增的方法检测mRNA,整个设计由两部分组成,探针S1连接在磁性纳米颗粒5′端上,生物条码连接在3′端,即S1上的末端连接金纳米粒子,金纳米上再连接修饰了CdS纳米粒子的序列S2,形成了MNPs-S1-AuNPs-S2-CdS NP传感体系,当靶物质mRNA与S1结合后,形成可被DSN酶切割的双链,酶切以后,金纳米粒子和由S2连接在一起的CdS纳米粒子被释放出来,当有超过100个CdS连接在金纳米上时,实验灵敏度就会大大增加。当纳米粒子被HNO3溶解20 min后,然后用溶出伏安法测量。这种方法具有很灵敏的检测能力,最低检测限是0.48 fmol/L(图 6)。
6 不同方法的检测限对比
不同DSN酶介的生物传感器主要是用来检测miRNA,从表1中可以看出,使用电化学传感器明显比光学传感器更加灵敏。在电化学传感器中,金电极修饰和玻璃碳电极修饰的传感器相对于其他的电化学传感器能检测到浓度更低的目标物质;在光学传感器中,表面增强拉曼光谱传感器的检测限最低,表明它的灵敏度较高,但不如电化学传感器。
7 结语
目前,DSN酶切割的具体方式还没完全阐述清楚,而且,对DSN酶的一些性质也不太清楚,需要更多的研究,如DSN最大切割限度,将扩大DSN酶的应用范围。同时,目前对新兴的核酸或者人工核酸的作用探索较少,使用DSN酶介导的生物传感器主要应用于检测miRNA,通过采用不同检测原理如比色法、荧光法、电化学法等,借助金纳米粒子、小磁珠等物质来放大检测信号,设计巧妙,但我们发现DSN酶仍可应用于检测重金属和蛋白质等物质中,而且这方面应用较少,所以这可能是未来的研究趋势。
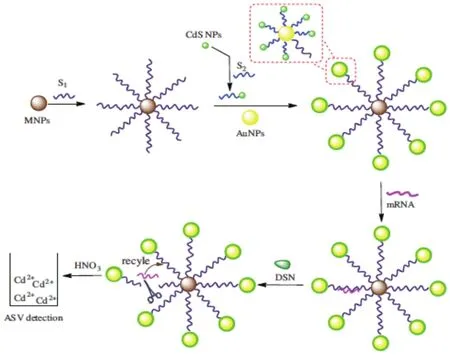
图6 检测mRNA的工作原理
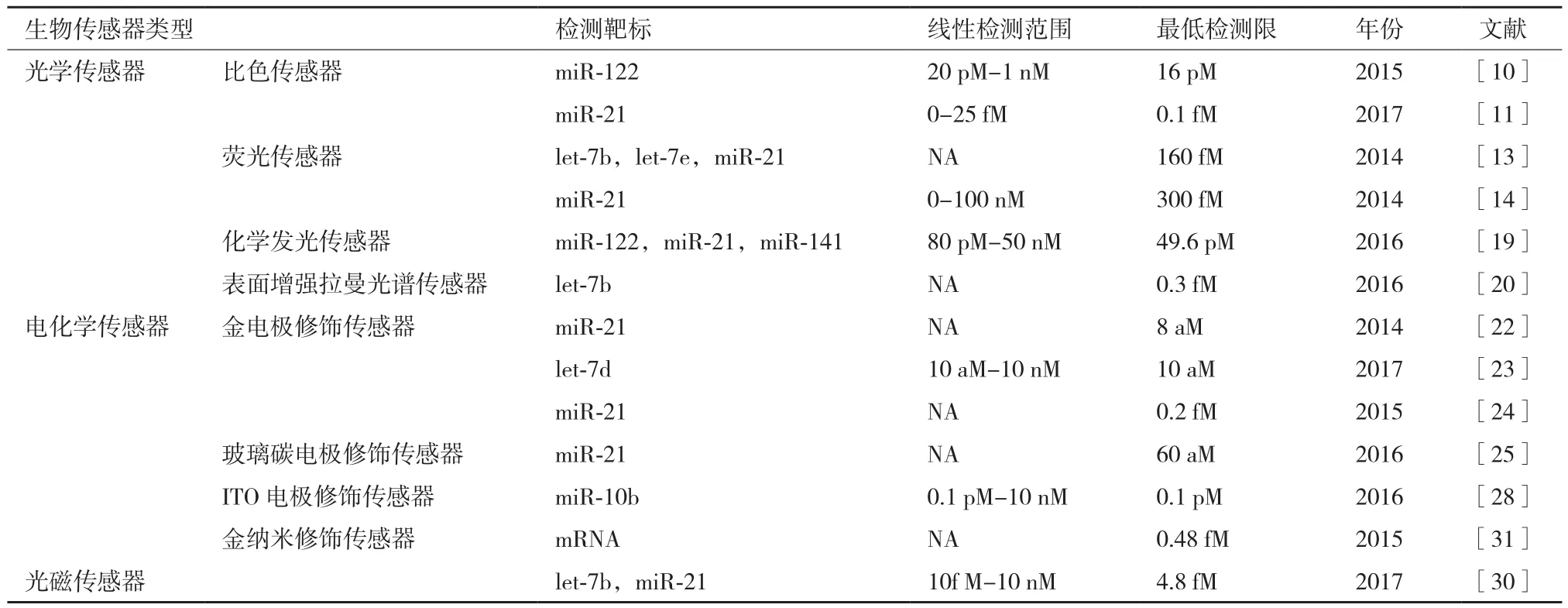
表1 不同DSN酶介生物传感器检测方法的比较
常用的方法中,比色法虽然直观,但精密度较低,可能只适用于miRNAs 的定性检测,无法实现准确定量低浓度的miRNAs。而化学发光等这类检测方法应该是比较新颖,可显著提高检测miRNAs的灵敏度和特异性。尽管电化学传感器检测方便、快速,但是其对检测平台的稳定性要求较高,尤其是电极的加工工艺和探针的包被技术直接影响了电化学传感器的应用前景[32]。同时检测几种物质成为最近设计生物传感器的主要趋势,为了检测更低限度的物质,多重检测信号扩增也是未来发展方向,而且,我们可以合理地利用金纳米等其他有助于提高检测限度的纳米物质。

