海鞘真菌的形态鉴定及其代谢产物抗菌活性研究
罗国聪 黄蕴怡 柴慧子 雷晓凌 聂芳红
(1. 广东海洋大学食品科技学院,湛江 524088;2. 暨南大学生命科学技术学院,广州 510632)
由于海洋高盐、高压、低温、寡营养等特殊生境,使得海洋微生物可产生结构新颖的生物活性物质,包括抗肿瘤、抗炎症、抗菌、抗寄生虫等化合物,海洋微生物已经成为新型药物开发的重要来源。尤其是海洋动植物共附生微生物,积极地参与动植物的代谢活动,在动植物的抗感染、抗吞噬的生态防卫中起了重要的作用[1]。而就近几年已报导的数据来看,从海洋微生物中发现的新活性物质中,有60% 以上来自于海洋真菌[2-3]。海鞘是脊索动物、尾索动物亚门、海鞘纲的尾索动物,是海洋污损生物之一,我国目前已记录的海鞘种类有66 种[4]。近年来,从海鞘中发现了生物碱、环肽、神经酰胺、萜类、甾体等活性物质,且含量相对较高,具有抗肿瘤、抗病毒、抗菌等显著的生物活性,引起了许多研究人员的高度重视[5],人们开始关注这些活性的物质的化学结构,并对海鞘共附生真菌展开抗菌活性的研究。
对于真菌来说,其形态特征是一种重要的分类依据,主要根据菌落、分生孢子梗、孢子及其发育时的形态特征来进行形态学鉴定,依据鉴定结果进行分类[6]。本研究选择湛江雷州的海鞘作为研究原料,从中分离纯化出海鞘共附生真菌,对菌株进行形态学的初步鉴定以及抗菌活性的筛选;筛选出抗菌活性较强且抗菌谱较广的菌株,结合对海鞘中真菌多样性的分析确定优选的种属,旨在为开发海洋真菌代谢产物的资源以及海洋药物的研究提供参考。
1 材料与方法
1.1 材料
1.1.1 样品来源 海鞘样品于2014年3月采自广东省雷州市流沙虾塘。
1.1.2 抗菌活性试验指示菌 细菌指示菌:铜绿假单胞菌(Pseudomons aeruginosa),藤黄八叠球菌(Sarcina lutea),金黄色葡萄杆菌(Staphylococcus aureus)。腐败菌 :假单胞菌属(Pseudomonassp.),库特氏菌属(Kurthia gibsonii strainsp.),金黄杆菌属(Chryseobacteriumsp.)。
1.1.3 培养基 马铃薯葡萄糖琼脂(PDA)培养基,淀粉培养基,真菌发酵培养基[7]用盐度为3%的人工海水进行配置。营养琼脂(NA),琼脂培养基用蒸馏水配置。
1.1.4 试剂及仪器 乙酸乙酯、甲醇、氯化钠购自广州华大化学试剂有限公司;琼脂粉、营养琼脂、马铃薯葡萄糖琼脂培养基(北京陆桥技术有限责任公司);YS100双目生物显微镜(日本尼康公司);722型紫外可见分光光度计(上海仪电科学仪器股份有限公司)。
1.2 方法
1.2.1 海鞘共附生真菌的分离[8-9]采用平板涂布法,在无菌环境下先用无菌水洗去除海鞘表面的泥沙,再分别取海鞘的外壳、内脏,用均质机均质后,放入无菌水中,震荡混匀,吸取上述匀浆液制成梯度稀释液。吸取稀释液到PDA培养基、淀粉培养基平板上,用涂布棒将其均匀涂布,于28℃培养4-5 d。发现有新的菌丝或菌落长出后立即转接,分别统计在PDA培养基、淀粉培养基中分离出来的真菌种类及数量。
1.2.2 海鞘共附生真菌的形态鉴定 菌株采用点植法接种,即用接种针沾取少量孢子点植在平板上中心,于28℃培养3-5 d,每隔1 d观察其菌落表面大小、质地、高度、颜色等菌落特征,借助显微镜观察菌株的个体形态,包括是否产孢、孢子等的大小、规则及颜色等,结合真菌鉴定手册等对菌株进行形态鉴定[10-14]。
1.2.3 海鞘共附生真菌抗菌活性的筛选 (1)海鞘共附生真菌发酵液粗提物的制备:按40%的装液量在500 mL锥形瓶中加入真菌发酵培养液,挑取三环菌种接种到培养液中,28℃、180 r/min条件下摇床培养7 d后,经过真空抽滤得发酵液与干菌体。取200 mL发酵液用乙酸乙酯等体积萃取3 次,合并萃取液,于旋转蒸发仪中减压浓缩,蒸干萃取液中的有机溶剂,用甲醇清洗旋蒸瓶,将提取物溶解于10mL的甲醇中,即为乙酸乙酯粗提液供试样品。(2)指示菌菌悬液的制备:将保存的指示菌接种到营养琼脂斜面37℃传代培养3次后,用接种环刮取适量的菌体于生理盐水中,振荡1 min直至菌体均匀分布,测量OD值,并根据OD值将指示菌浓度调整至细菌数约为106CFU/mL。
1.2.4 海鞘共附生真菌抑菌活性测定 采用双层平板法[15],首先在无菌平板上铺一层素琼脂,放置无菌牛津杯,然后采用稀释倒平板法制备含菌平板,待平板凝固后将牛津杯取出,分别将乙酸乙酯粗提液供试样品150 μL加入到牛津杯中。每组实验重复3次,并设阴性对照(不加粗提物)。将加好粗体液的含菌平板置于冰箱中扩散3 h后放置于37℃恒温培养。24 h后观察抑菌圈的透明程度和边缘整齐程度,测量并记录抑菌圈直径。
2 结果
2.1 海鞘共附生真菌的分离纯化
经分离纯化排重后,从海鞘中共分离出14株菌,其中12株分离自PDA培养基,2株分离自淀粉培养基,分别占总菌株分离率的85.7%、14.3%。这说明PDA培养基中的营养成分比淀粉培养基更适合于海鞘共附生真菌的生长繁殖。
2.2 海鞘共附生真菌的形态鉴定
从海鞘中所分离的14株菌株的菌落形态、个体形态菌落见图1,个体形态的特征描述见表1。根据真菌鉴定手册对其进行形态学的初步鉴定,以上的鉴定结果显示,所分离出的14 株真菌分属4 个属,分别为青霉属、曲霉属、枝孢属和麦轴梗霉属。以青霉属和曲霉属居多,其中青霉属为第一优势种群,青霉属的菌株占总分离出的菌株的比例为64.3%,曲霉属为第二优势种群,占总分离出的菌株21.4%。说明从海鞘中分离出的真菌以青霉属和曲霉属为主。另外,麦轴梗霉属在海洋真菌中的报道出现较少,说明海鞘真菌中多样性较丰富。
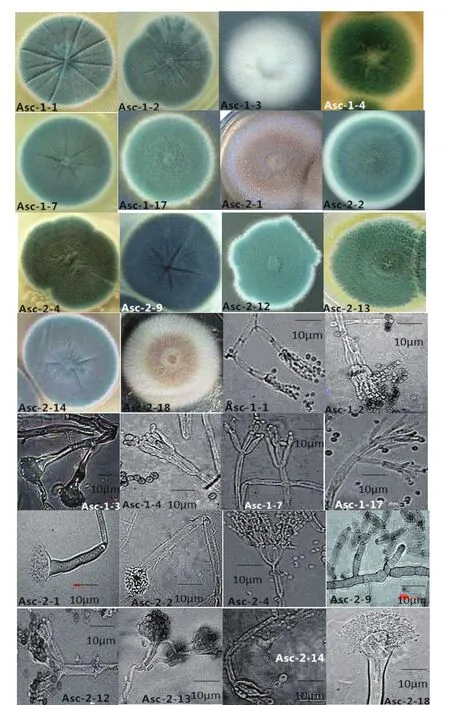
图1 14株海鞘真菌形态鉴定
2.3 海鞘共附生真菌抗菌活性筛选
海鞘共附生真菌乙酸乙酯粗提物抗菌活性,如表2和图2所示。从表2中可以看出,在这14 株真菌中,至少有11 个菌株对一种以上的指示菌有一定的抗菌活性。其中有4 株真菌对6 种指示菌都有抗菌活性,分别为Asc-2-4、Asc-2-12、Asc-1-1和Asc-2-1,这4株菌的抗菌活性较强且抗菌谱较广。比较这4株菌的抑菌能力发现,菌株Asc-2-12的乙酸乙酯粗提物的平均抑菌圈直径最大,均大于21.00 mm,其对铜绿假单胞菌的抑菌圈直径最大达到21.91 mm,对金黄色葡萄球菌的抑菌圈直径最大达到21.37 mm,对SL1 的抑菌圈直径最大达到23.13 mm,对SL2 的抑菌圈直径最大达到23.94 mm。
3 讨论
海鞘独特的摄食习性使其富集大量的共附生微生物[16],而海洋真菌能够耐受海洋中的特殊生境如高盐、高压、低氧、低光照等,形成能够产生独特次级代谢产物的生理特性[17]。本研究以海鞘为原料,从中分离纯化出海鞘共附生真菌并以其为研究对象,对其进行形态学的鉴定和抑菌活性研究,共分离鉴定出14株菌株,分属4个属,其中青霉属9株、占64.3%,属于优势菌属。目前,国内已经有对海鞘共附生细菌的研究报道[18],然而关于海鞘共附生真菌代谢产物抗菌活性的研究报道还比较少[19]。
通过测试14株菌菌丝体乙酸乙酯的粗提取物的抗菌活性,以铜绿假单胞菌、黄八叠球菌、金黄色葡萄杆菌、假单胞菌属、库特氏菌属、金黄杆菌属为指示菌,其中有4株真菌对这6种指示菌都有抑菌活性,分别是Asc-2-4、Asc-2-12、Asc-1-1和Asc-2-1,在这抗菌活性较强的4株真菌,Asc-2-1属于曲霉属,其余3株属于青霉属。并且青霉属菌株Asc-2-12 的抑菌活性最明显,对铜绿假单胞菌的抑菌圈直径最大达到21.91 mm。珊瑚和海绵共附生真菌的研究发现,分离得到的部分青霉和曲霉菌表现出对细菌的广谱抑菌活性[20]。因此有必要对以上4株海洋真菌的活性代谢产物进行深入研究。海洋微生物天然产物正在成为创新药物的一个重要来源,而海洋真菌作为海洋微生物的一个重要类群,具有研究和开发的巨大潜力[21]。
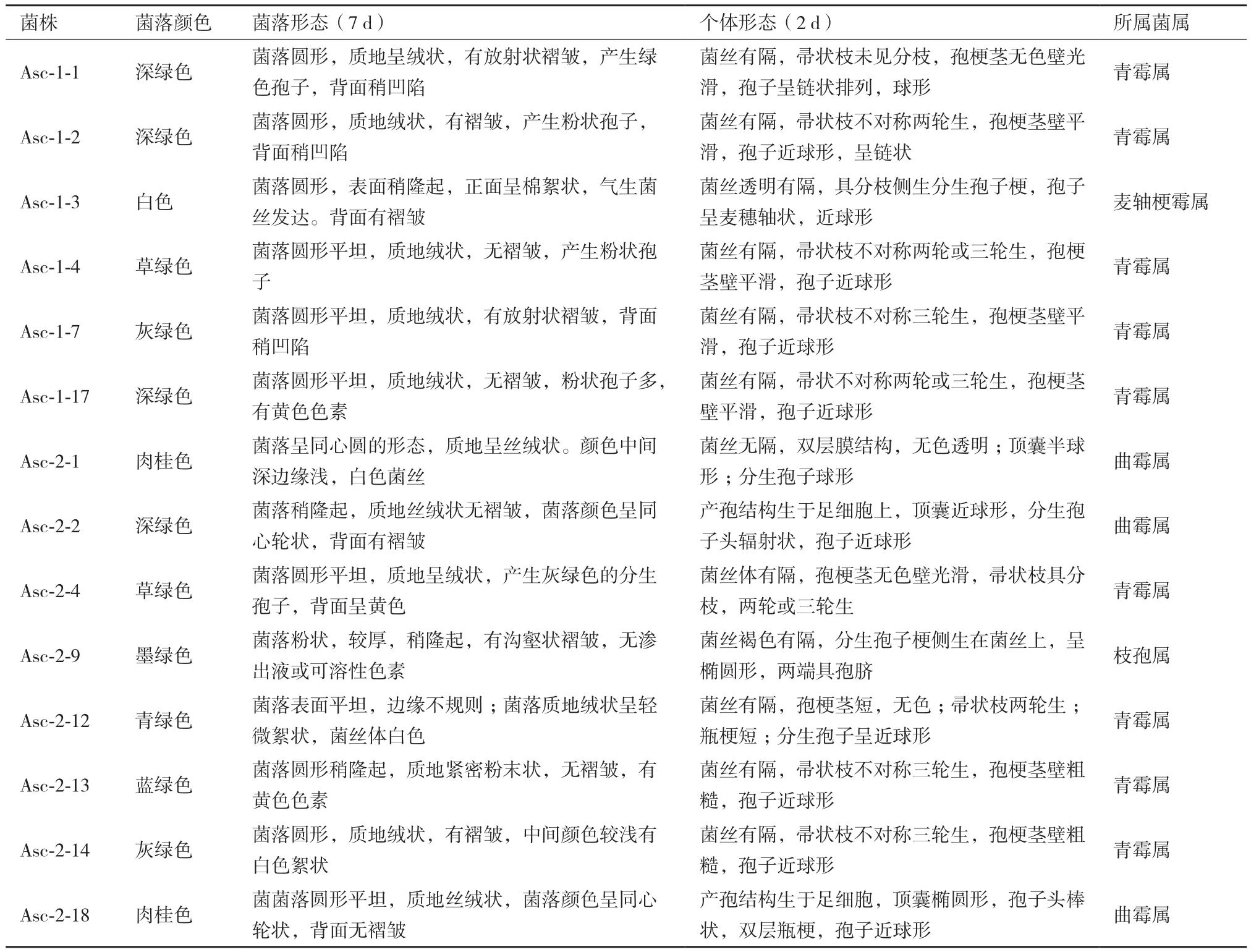
表1 14株海鞘共附生真菌的形态鉴定

表2 海鞘共附生真菌乙酸乙酯粗提物抗菌活性的筛选
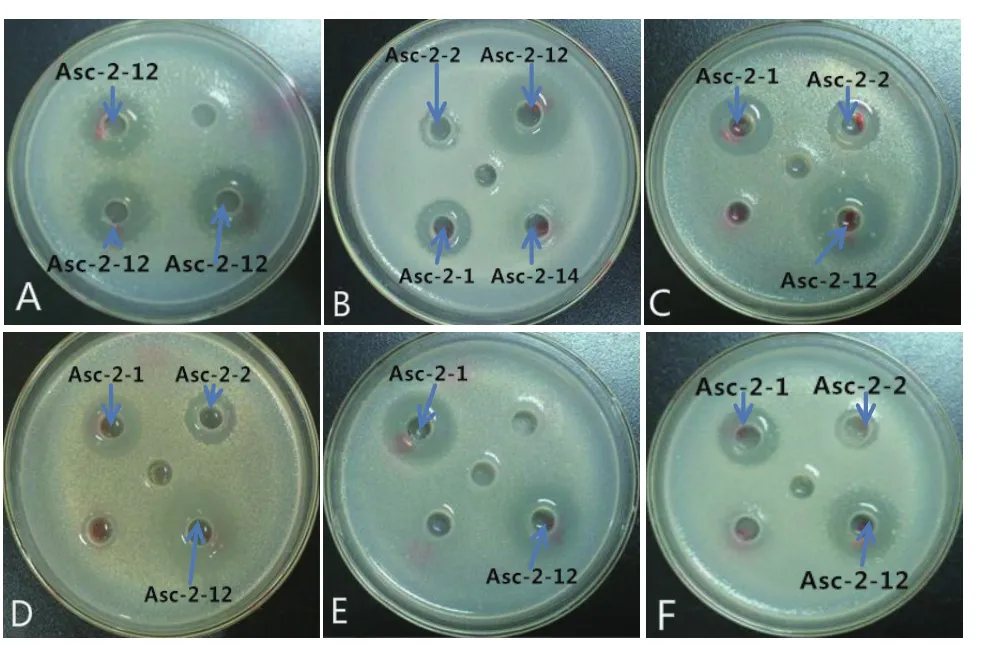
图2 海鞘部分真菌发酵液乙酸乙酯粗提物抗菌活性
4 结论
从海鞘中纯化出14 株真菌,经初步鉴定14 株真菌分属于青霉属、曲霉属、枝孢属和麦轴梗霉属等4 个属,其中青霉属9株,曲霉属3株,枝孢属和麦轴梗霉属各1株。最后对分离纯化出的14 株海鞘真菌的乙酸乙酯粗提物进行抗菌活性筛选,发现14 株菌中有11 株菌对一种以上的细菌指示菌有抗菌活性,其中有4 株菌的抗菌活性较强且抗菌谱较广,编号分别为Asc-2-4、Asc-2-12、Asc-1-1和Asc-2-1,菌株Asc-2-12 的抑菌活性最明显,对铜绿假单胞菌的抑菌圈直径最大达到21.91 mm。综上表明,海鞘共附生真菌存在良好的应用开发潜力,可作为发现新颖抗菌活性物质的潜在资源。

